Содержание
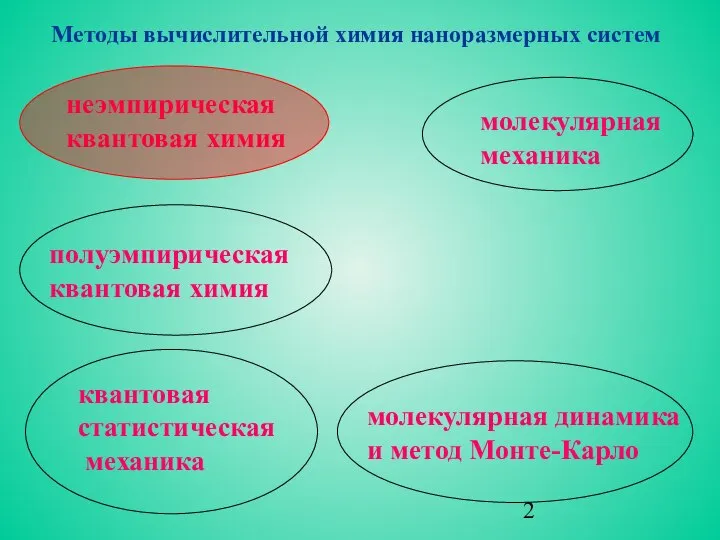
- 2. молекулярная динамика и метод Монте-Карло неэмпирическая квантовая химия полуэмпирическая квантовая химия квантовая статистическая механика молекулярная механика
- 3. Квантовая химия молекул. Электронная корреляция Метод ХФ дает для энергии диссоциации молекулы Н2 значение 2.65 эВ,
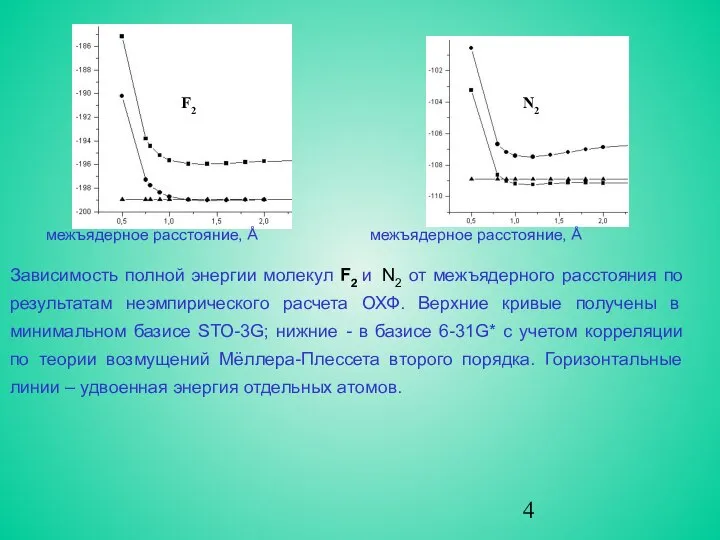
- 4. межъядерное расстояние, Å межъядерное расстояние, Å Зависимость полной энергии молекул F2 и N2 от межъядерного расстояния
- 5. Иллюстрация: Метилен СН2 низколежащее синглетное возбужденное состояние 1A1 Δэкспер=9.2 ккал/моль триплетное основное состояние 3B1 Из-за малости
- 6. Полный метод КВ → точное (в пределах базисного набора) решение электронного уравнения Шредингера. Для больших молекул
- 7. Метод многоконфигурационного взаимодействия (МКВ или МС, англ. MCSCF) - вариационный метод, в котором, в отличие от
- 8. Теория возмущений В ряде задач фигурируют разные по порядку величины: отбрасывая малые величины, задачу можно сильно
- 9. Условие применимости теории возмущений: Н'mn т.е. матричные элементы возмущения должны быть меньше, чем разность энергий невозмущенных
- 10. Если H0 - оператор Фока → теория возмущений Мёллера-Плессета (англ. MPPT), где самая низкая отличная от
- 11. Метод валентных связей Метод валентных связей учитывает, что атомы в молекулах сохраняют во многом свою индивидуальность,
- 12. Электронное строение и свойства системы, таким образом, представляются как среднее по различным ВС, число которых может
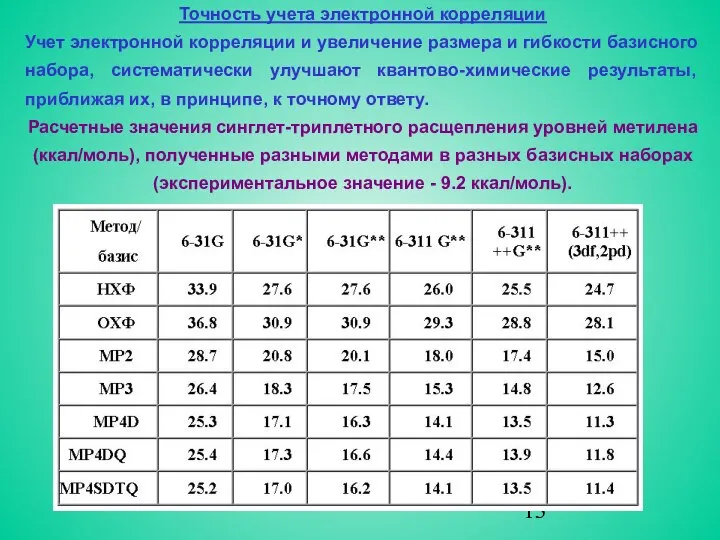
- 13. Точность учета электронной корреляции Учет электронной корреляции и увеличение размера и гибкости базисного набора, систематически улучшают
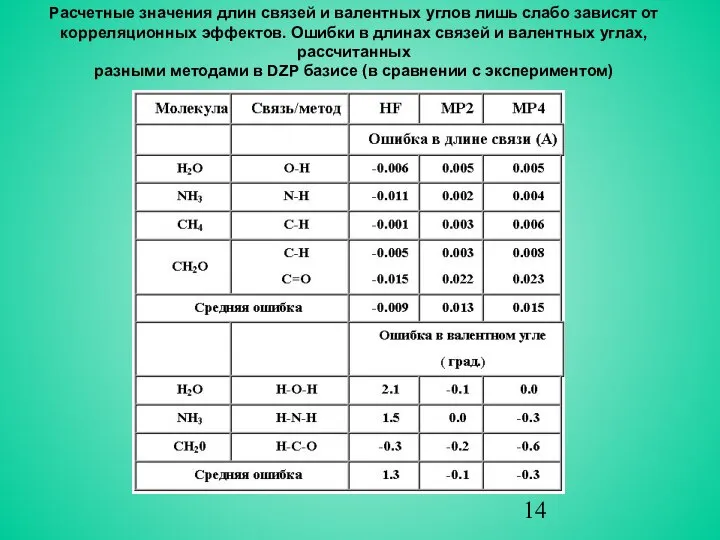
- 14. Расчетные значения длин связей и валентных углов лишь слабо зависят от корреляционных эффектов. Ошибки в длинах
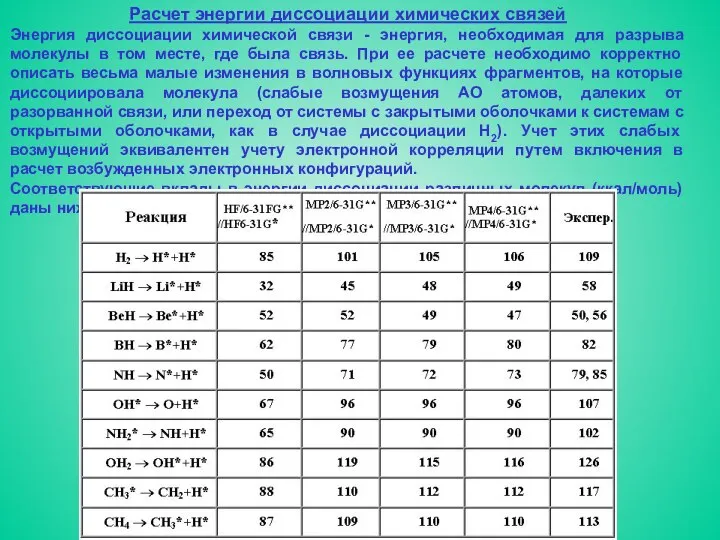
- 15. Расчет энергии диссоциации химических связей Энергия диссоциации химической связи - энергия, необходимая для разрыва молекулы в
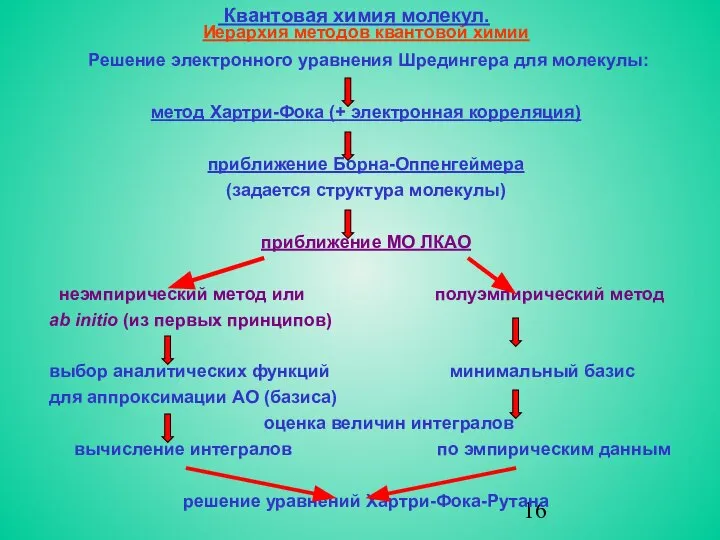
- 16. Квантовая химия молекул. Иерархия методов квантовой химии Решение электронного уравнения Шредингера для молекулы: метод Хартри-Фока (+
- 18. Скачать презентацию









 Verb Tenses Review
Verb Tenses Review Створення креслень в КОМПАС-3D V14/16
Створення креслень в КОМПАС-3D V14/16 Аналого-цифровые преобразователи (АЦП)
Аналого-цифровые преобразователи (АЦП) Психологические и психиатрические подходы к понятию «вменяемости»
Психологические и психиатрические подходы к понятию «вменяемости» Программа түсінігі. Құрылымы. Шамаларды сипаттау
Программа түсінігі. Құрылымы. Шамаларды сипаттау Нормативная база ценообразования в строительстве
Нормативная база ценообразования в строительстве Романтизм или реализм?
Романтизм или реализм? Связь зарядов и потенциалов проводников
Связь зарядов и потенциалов проводников Welsh festivals
Welsh festivals устные вычисления - презентация для начальной школы
устные вычисления - презентация для начальной школы Движение – это жизнь. Валеология
Движение – это жизнь. Валеология ПРОЕКТ «ДЕТСКИЙ САД»
ПРОЕКТ «ДЕТСКИЙ САД» Функционально - планировочная организация города
Функционально - планировочная организация города ЭРА-ГЛОНАСС: общая информация. Государственная система экстренного реагирования при авариях
ЭРА-ГЛОНАСС: общая информация. Государственная система экстренного реагирования при авариях Организация общевойсковых частей и подразделений
Организация общевойсковых частей и подразделений  Тягач «Майло» и его друзья. Тяга. Конструктор
Тягач «Майло» и его друзья. Тяга. Конструктор Как вас зовут? - презентация для начальной школы
Как вас зовут? - презентация для начальной школы Розв’язування крайових задач для звичайних диференціальних рівнянь методом Гальоркіна
Розв’язування крайових задач для звичайних диференціальних рівнянь методом Гальоркіна ПРОЩАНИЕ С АЗБУКОЙ
ПРОЩАНИЕ С АЗБУКОЙ Глава 3. Экономика фирмы 20. Рынок капитала
Глава 3. Экономика фирмы 20. Рынок капитала  Реализм – художественный стиль эпохи
Реализм – художественный стиль эпохи  Молоко Товароведение и экспертиза в таможенном деле
Молоко Товароведение и экспертиза в таможенном деле  Стихи любимого поэта - презентация для начальной школы_
Стихи любимого поэта - презентация для начальной школы_ Основы информационных технологий в профессиональной деятельности агента рекламы
Основы информационных технологий в профессиональной деятельности агента рекламы Электродинамические явления в дуговых печах
Электродинамические явления в дуговых печах ЗАМОК ПРИНЦЕССЫ ОЛЬДЕНБУРГСКОЙ ЗАМЕЧАТЕЛЬНЫЕ МЕСТА ВОРОНЕЖСКОЙ ОБЛАСТИ
ЗАМОК ПРИНЦЕССЫ ОЛЬДЕНБУРГСКОЙ ЗАМЕЧАТЕЛЬНЫЕ МЕСТА ВОРОНЕЖСКОЙ ОБЛАСТИ Краеведческий кружок «Аскольд»
Краеведческий кружок «Аскольд» Материалы к обсуждению закона об образовании
Материалы к обсуждению закона об образовании