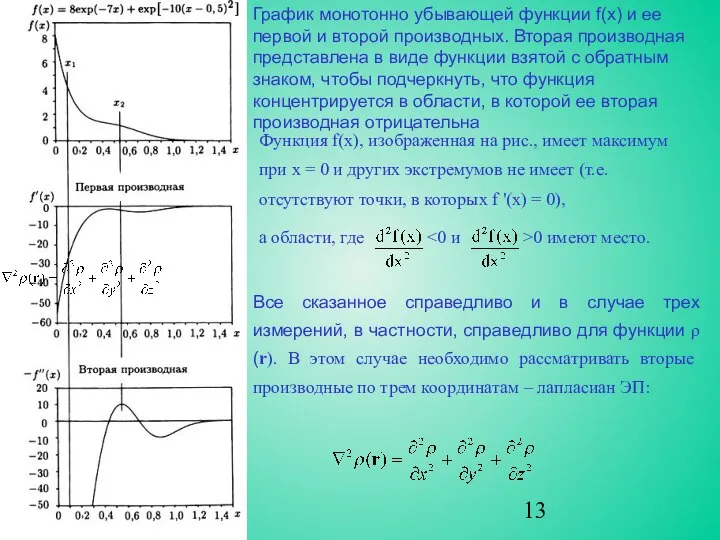
В направлении от ядра ЭП экспоненциально уменьшается, и в общем случае
кривизна ρ(r) вдоль радиального направления от ядра положительна, как и f(x) в точке x1 на рис. 10. Однако, две компоненты кривизны, перпендикулярные радиальной линии, отрицательны. Таким образом, функция ∇2ρ(r) будет принимать разные знаки по мере удаления от ядра, явно проявляя электронные оболочки атома.
Для каждой квантовой оболочки наблюдается пара областей (одна отрицательная и одна положительная) с внутренней областью, представляющей собой максимум концентрации электронов. Поскольку ЭП концентрируется при ∇2ρ<0, локальный максимум −∇2ρ будет соответствовать максимуму концентрации ЭП, а локальный минимум −∇2ρ указывает на локальное разрежение ЭП.
∇2ρ - удобная функция для анализа строения электронных оболочек атомов.
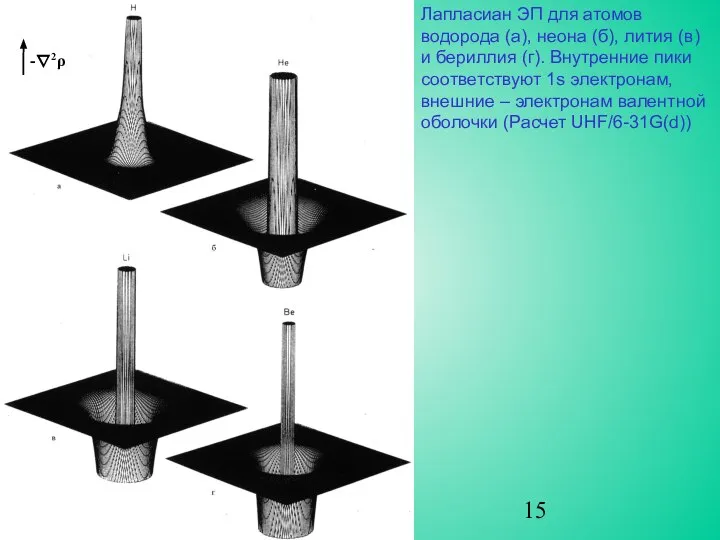
Лапласиан ЭП определяет концентрацию электронов на валентной оболочке. Она разделена на внутреннюю область, в которой ∇2ρ<0 и внешнюю, в которой ∇2ρ>0. Часть оболочки, внутри которой ∇2ρ<0, носит название области концентрации заряда валентной оболочки (КЗВО). При образовании химической связи валентная оболочка искажается, приводя к появлению максимумов, соответствующих числу и относительному расположению электронных пар, отвечающих предсказаниям модели Льюиса и модели отталкивания электронных пар валентной оболочки Гиллеспи.

![Приравнивая нулю дифференциал функционала электронной энергии d{E[ρ] – μN[ρ(r)]}Vяд = const](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1297932/slide-4.jpg)





 СУЩНОСТЬ И СОДЕРЖАНИЕ ПРОЦЕССА УПРАВЛЕНИЯ В ТАМОЖЕННЫХ ОРГАНАХ Дугинов Данила
СУЩНОСТЬ И СОДЕРЖАНИЕ ПРОЦЕССА УПРАВЛЕНИЯ В ТАМОЖЕННЫХ ОРГАНАХ Дугинов Данила  Правописание гласных в корне орфография
Правописание гласных в корне орфография ЭКОЛОГИЧЕСКИЕ ФАКТОРЫ
ЭКОЛОГИЧЕСКИЕ ФАКТОРЫ Элитарная культура
Элитарная культура ДИСТРОФИИ Стромально-сосудистые дистрофии
ДИСТРОФИИ Стромально-сосудистые дистрофии Дерево, кирпич, пенобетон
Дерево, кирпич, пенобетон Презентация "Какие налоги должно платить малое предприятие" - скачать презентации по Экономике
Презентация "Какие налоги должно платить малое предприятие" - скачать презентации по Экономике Красота вокруг нас (Цветы)
Красота вокруг нас (Цветы) My idol - Alina Kabaeva
My idol - Alina Kabaeva Моя любимая профессия техник-механник
Моя любимая профессия техник-механник Применение Matlab для обработки данных, полученных от детекторов космических излучений
Применение Matlab для обработки данных, полученных от детекторов космических излучений Принцип относительности Эйнштейна
Принцип относительности Эйнштейна Умножение многочлена на многочлен - презентация по Алгебре
Умножение многочлена на многочлен - презентация по Алгебре Презентация "Древнерусская иконопись" - скачать презентации по МХК
Презентация "Древнерусская иконопись" - скачать презентации по МХК MAN 2019
MAN 2019 Презентация по МХК Культура России 16 века
Презентация по МХК Культура России 16 века Таблица 9-5.6.7.10.11.12
Таблица 9-5.6.7.10.11.12  Операции над подмножествами
Операции над подмножествами Формирование государства на Руси. Русь Феодальная IX- начала XVII вв.
Формирование государства на Руси. Русь Феодальная IX- начала XVII вв. Педагогический совет Деятельность учителя по формированию межличностных отношений школьников в процессе их социализации.
Педагогический совет Деятельность учителя по формированию межличностных отношений школьников в процессе их социализации. Презентация на тему "Учебно-методические комплекты" - скачать презентации по Педагогике
Презентация на тему "Учебно-методические комплекты" - скачать презентации по Педагогике Потребительский Кооператив «Чайковский АгроСтрой»
Потребительский Кооператив «Чайковский АгроСтрой» Расцвет русской культуры XIХ века
Расцвет русской культуры XIХ века Средняя плотность микроскопических зарядов имеет вид
Средняя плотность микроскопических зарядов имеет вид Все о Пасхе. Библия
Все о Пасхе. Библия Современные аспекты антибактериальной терапии
Современные аспекты антибактериальной терапии Памятка. ЕГЭ по обществознанию
Памятка. ЕГЭ по обществознанию Ta’lim sifati monitoringini tashkil etish va o‘tkazishda xalqaro PISA baholash dasturidan foydalanish
Ta’lim sifati monitoringini tashkil etish va o‘tkazishda xalqaro PISA baholash dasturidan foydalanish