Содержание
- 2. Антитела (Antibody) =иммуноглобулины Белки макроорганизма, синтезируемые и экскретируемые В- лимфоцитами в ответ на попадание в организм
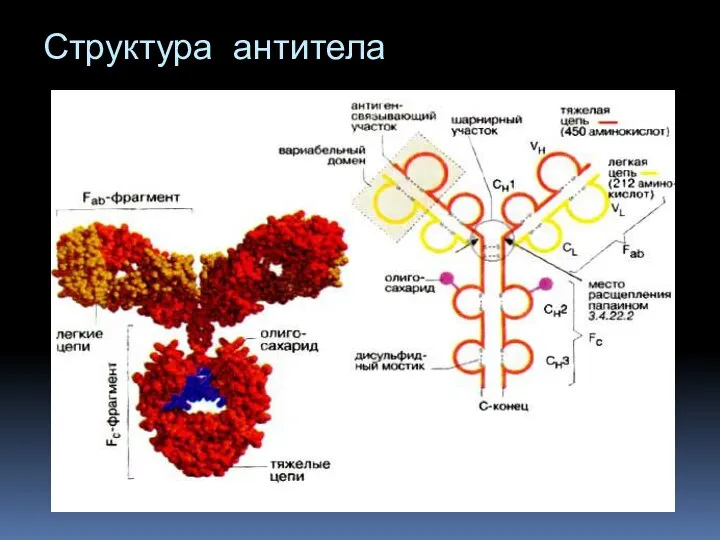
- 3. Структура антитела
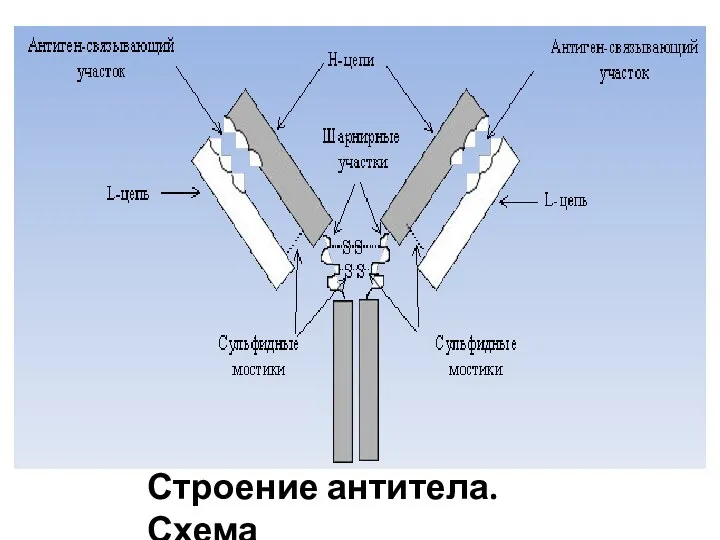
- 4. Строение антитела. Схема
- 5. Вариабельные области молекулы антитела Состоят из трех участков каждая. Определяют комплементарность антитела к антигену – антигенсвязывающие
- 6. Константные области молекулы антитела Каждая L-цепь содержит одну постоянную (константную) область (СL), Каждая Н-цепь – три
- 7. Система АНТИГЕН – АНТИТЕЛО
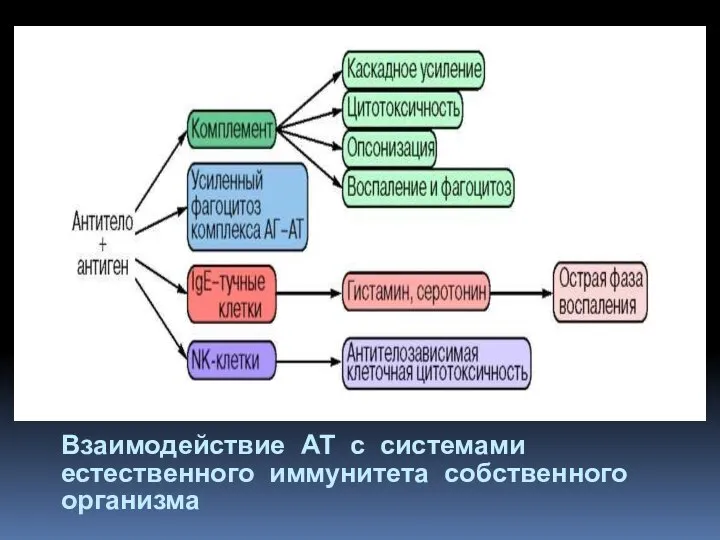
- 8. Взаимодействие АТ с системами естественного иммунитета собственного организма
- 9. Опсонизация (от др.-греч. ὀψώνιον — снабжение пищей) — процесс адсорбции опсонинов на поверхности антигенов (АГ), который
- 10. Современные направления использования МАТ в фармакотерапии - для нейтрализации токсинов, - для борьбы с бактериями, вирусами,
- 11. ИСПОЛЬЗОВАНИЕ МАТ ДЛЯ ДОСТАВКИ ЛВ К МИШЕНЯМ
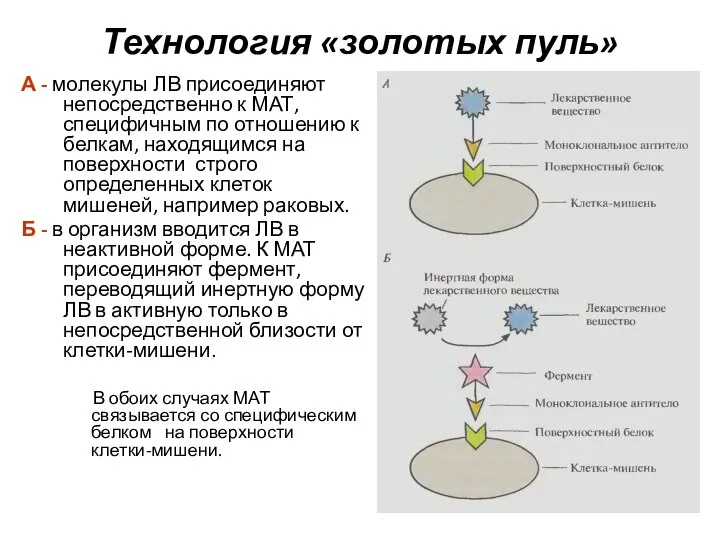
- 12. Технология «золотых пуль» А - молекулы ЛВ присоединяют непосредственно к МАТ, специфичным по отношению к белкам,
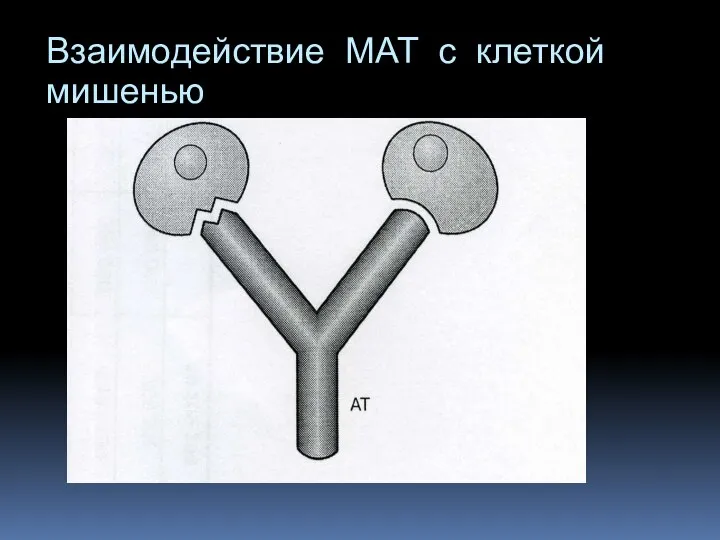
- 13. Взаимодействие МАТ с клеткой мишенью
- 14. Рекомбинантное МАТ (гуманизированное, приближённое к человеческому), которое селективно связывается с фактором роста эндотелия сосудов (vascular endothelial
- 15. Тромболитики и антикоагулянты Тромб состоит из молекул фибрина, образующих сеть. Сетчатая структура создается под влиянием факторов
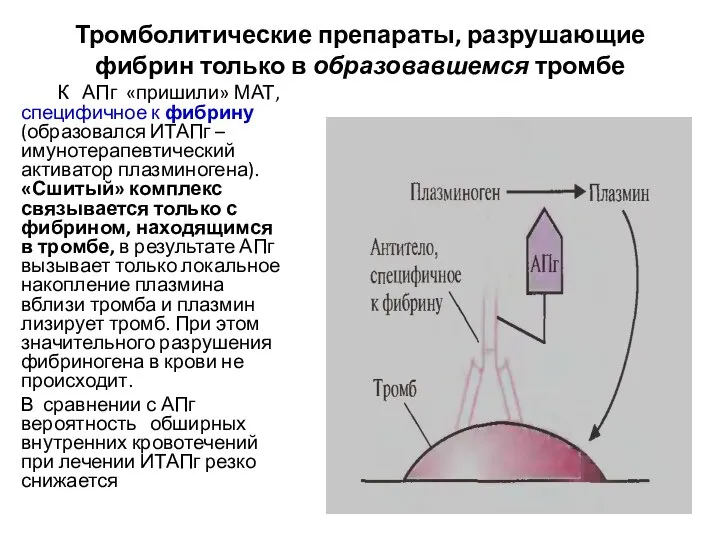
- 16. Тромболитические препараты, разрушающие фибрин только в образовавшемся тромбе К АПг «пришили» МАТ, специфичное к фибрину (образовался
- 17. Тромболитики первого поколения Стрептокиназа (РУП Белмедпрепараты). Активатор плазминогена. Получают из β-гемолитического стрептококка группы С. Это непрямой
- 18. Активаторы плазминогена тканевого типа (тАПг) тАПг используется для тромболитической терапии острого инфаркта миокарда, закупорки мозговых и
- 19. Активаторы плазминогена урокиназного типа Урокиназа – активатор плазминогена, содержащийся в моче человека. Состоит из двух полипептидных
- 20. ПОЛУЧЕНИЕ СПЕЦИФИЧЕСКИХ АНТИТЕЛ ЧЕЛОВЕКА
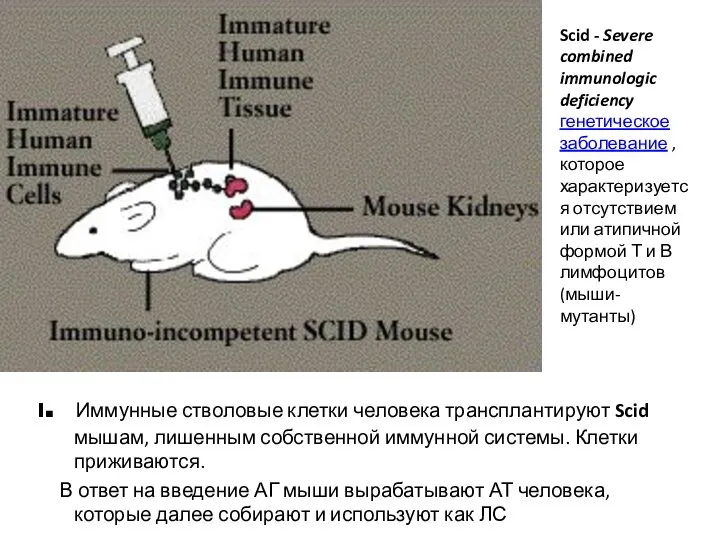
- 21. l. Иммунные стволовые клетки человека трансплантируют Scid мышам, лишенным собственной иммунной системы. Клетки приживаются. В ответ
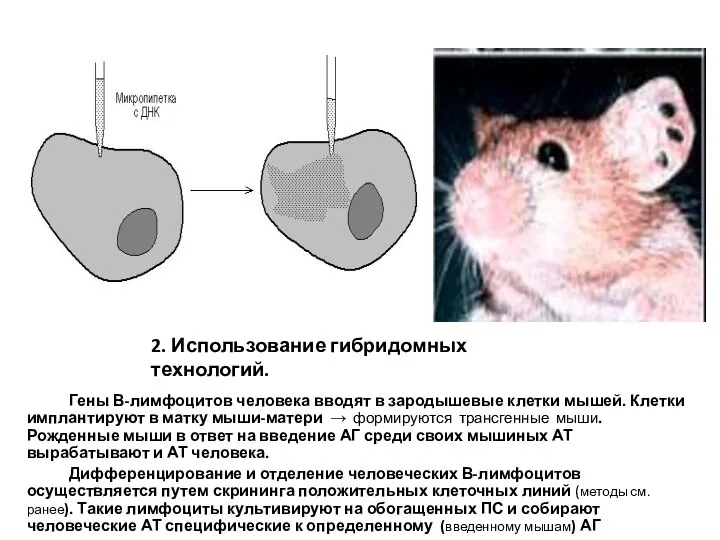
- 22. 2. Использование гибридомных технологий. Гены В-лимфоцитов человека вводят в зародышевые клетки мышей. Клетки имплантируют в матку
- 24. Скачать презентацию













 Презентация по факторам риска ССЗ
Презентация по факторам риска ССЗ Фарфор. Фарфоровая посуда
Фарфор. Фарфоровая посуда Деловые культуры мира и техника ведения международных деловых переговоров
Деловые культуры мира и техника ведения международных деловых переговоров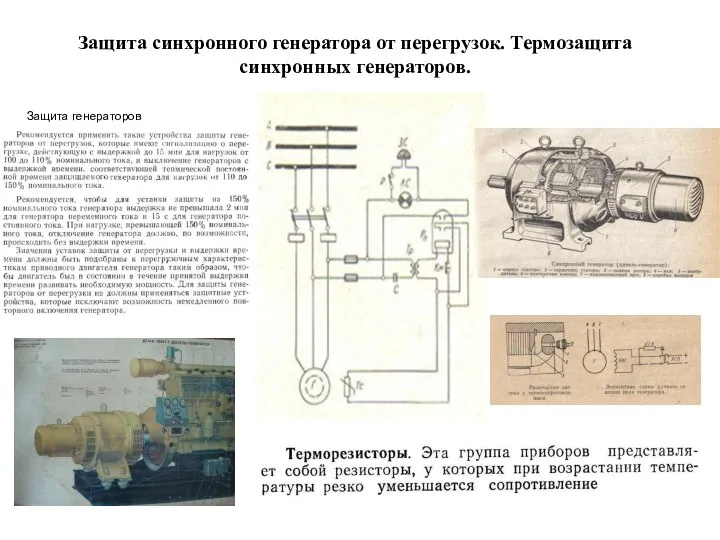 Защита синхронного генератора от перегрузок. Техническое обслуживание судовых электроприводов. (Билет 10)
Защита синхронного генератора от перегрузок. Техническое обслуживание судовых электроприводов. (Билет 10) Дополнение определителя
Дополнение определителя Корпоративный фитнес
Корпоративный фитнес Квантовая оптика
Квантовая оптика  Електроємність. Конденсатори. (Лекция 6)
Електроємність. Конденсатори. (Лекция 6) Anti-nuclear movement
Anti-nuclear movement Тепловые машины
Тепловые машины Серебрякова Галина Борисовна МОУ СОШ №17 Г. Карталы Челябинской области Учитель начальных классов serebriackowa.galina@yandex.ru Конкурс «Чуде
Серебрякова Галина Борисовна МОУ СОШ №17 Г. Карталы Челябинской области Учитель начальных классов serebriackowa.galina@yandex.ru Конкурс «Чуде Всероссийская акция, приуроченная к международному дню борьбы с коррупцией
Всероссийская акция, приуроченная к международному дню борьбы с коррупцией Роль пациентской организации в повышении качества жизни больных с хроническими заболеваниями почек
Роль пациентской организации в повышении качества жизни больных с хроническими заболеваниями почек Типология кризисов Петрова Маргарита Куркина Анна
Типология кризисов Петрова Маргарита Куркина Анна Қазіргі әлемдегі нанотехнология
Қазіргі әлемдегі нанотехнология Сложные случаи правописания суффиксов
Сложные случаи правописания суффиксов  Презентация Минеральные воды
Презентация Минеральные воды Презентация на тему "Как избежать умственных перегрузок в процессе обучения?" - скачать презентации по Педагогике
Презентация на тему "Как избежать умственных перегрузок в процессе обучения?" - скачать презентации по Педагогике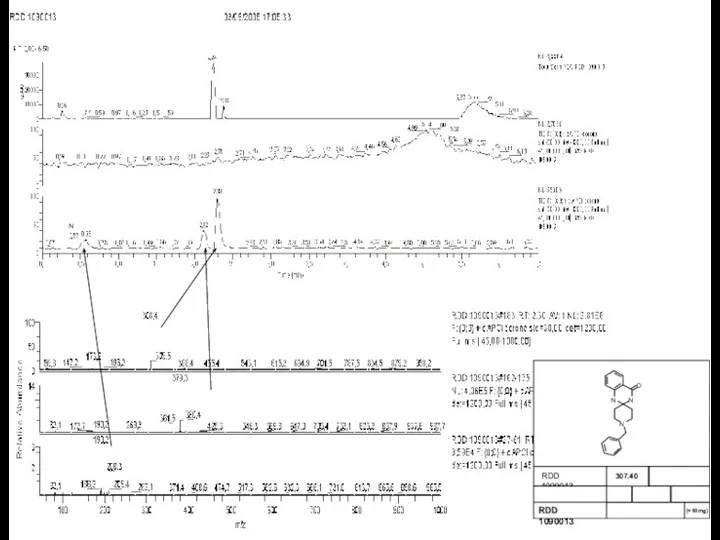 синтез спиросоединений из о-аминобензонитрила
синтез спиросоединений из о-аминобензонитрила Гренландия. Эскимосы
Гренландия. Эскимосы Презентация Виды ценных бумаг
Презентация Виды ценных бумаг Медико-социальные аспекты здоровья населения
Медико-социальные аспекты здоровья населения Подготовил воспитатель СП ГБОУ СОШ№6 г.о. Отрадный «Детский сад № 14» Логинова Н.В. Подготовил воспитатель СП ГБОУ СОШ№6 г.о. Отр
Подготовил воспитатель СП ГБОУ СОШ№6 г.о. Отрадный «Детский сад № 14» Логинова Н.В. Подготовил воспитатель СП ГБОУ СОШ№6 г.о. Отр Магнитные цепи и электромагнитные устройства. Трансформатор (продолжение)
Магнитные цепи и электромагнитные устройства. Трансформатор (продолжение) Облачение православного духовенства
Облачение православного духовенства Древние священные сооружения
Древние священные сооружения  Классификация отраслей
Классификация отраслей История возникновения и развития хоккея на Южном Урале
История возникновения и развития хоккея на Южном Урале