Содержание
- 2. Приближения методов молекулярной механики: - ядра и электроны образуют атом-подобные частицы; - атом-подобные частицы имеют сферическую
- 3. Пространственная структура молекулы определяется: числом входящих в нее N атомов их декартовыми координатами r1, r2,…, rN.
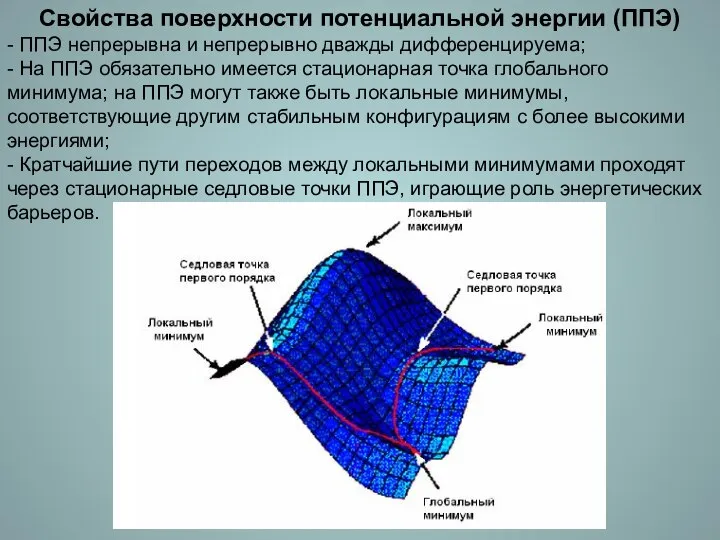
- 4. Свойства поверхности потенциальной энергии (ППЭ) - ППЭ непрерывна и непрерывно дважды дифференцируема; - На ППЭ обязательно
- 5. Потенциальная энергия молекулы: Uсв - вклад в потенциальную энергию, связанные с изменением межъядерных расстояний для пар
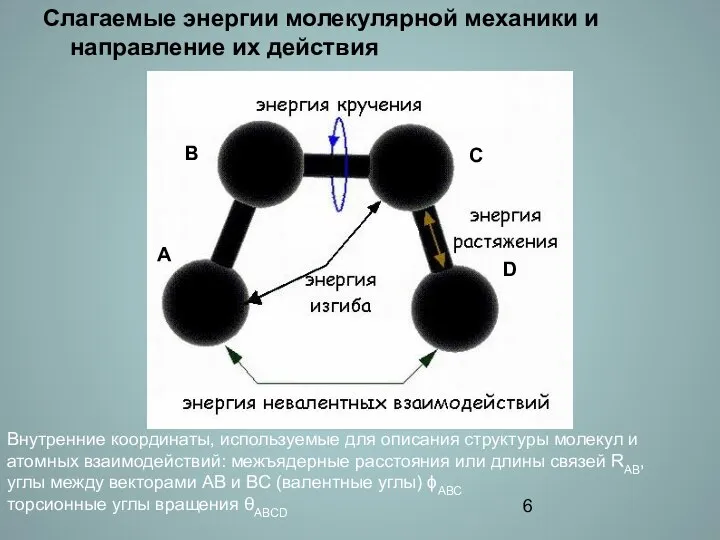
- 6. Слагаемые энергии молекулярной механики и направление их действия Внутренние координаты, используемые для описания структуры молекул и
- 7. Энергия растяжения и сжатия связи А-В Потенциал Морса Соотношение гармонической силовой постоянной и энергией диссоциации связи
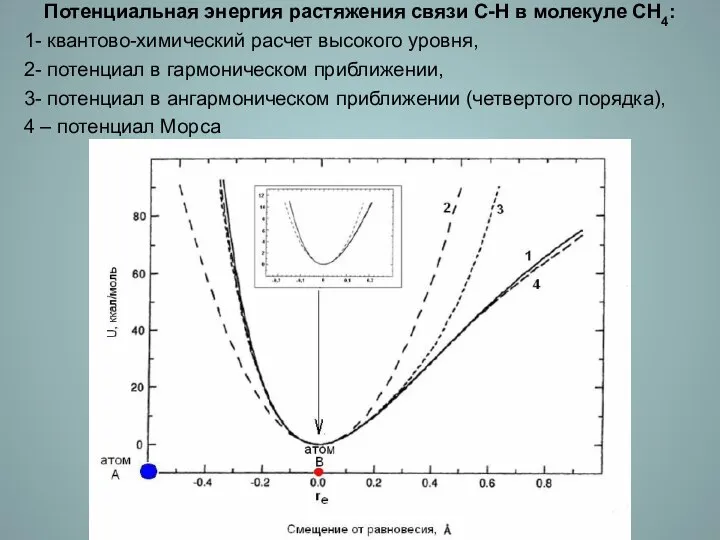
- 8. Потенциальная энергия растяжения связи С-Н в молекуле СН4: 1- квантово-химический расчет высокого уровня, 2- потенциал в
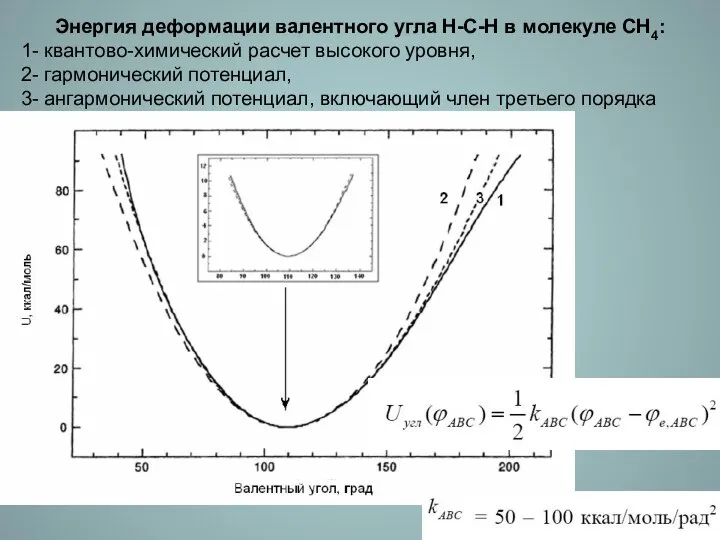
- 9. Энергия деформации валентного угла Н-С-Н в молекуле СН4: 1- квантово-химический расчет высокого уровня, 2- гармонический потенциал,
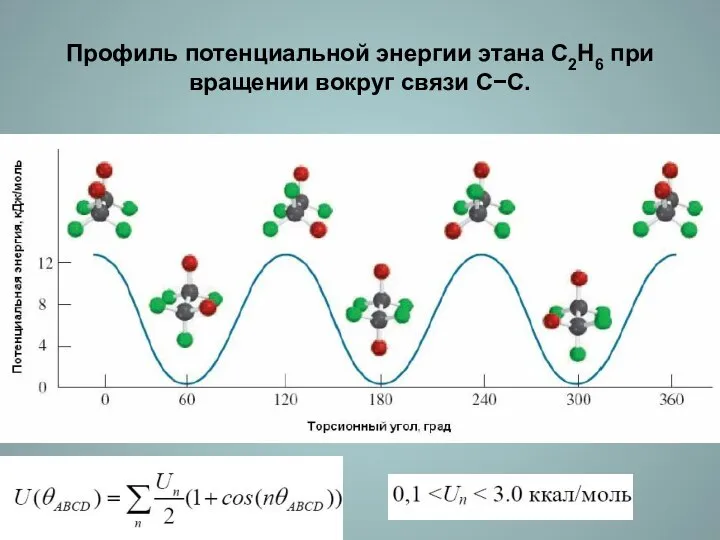
- 10. Профиль потенциальной энергии этана С2Н6 при вращении вокруг связи С−С.
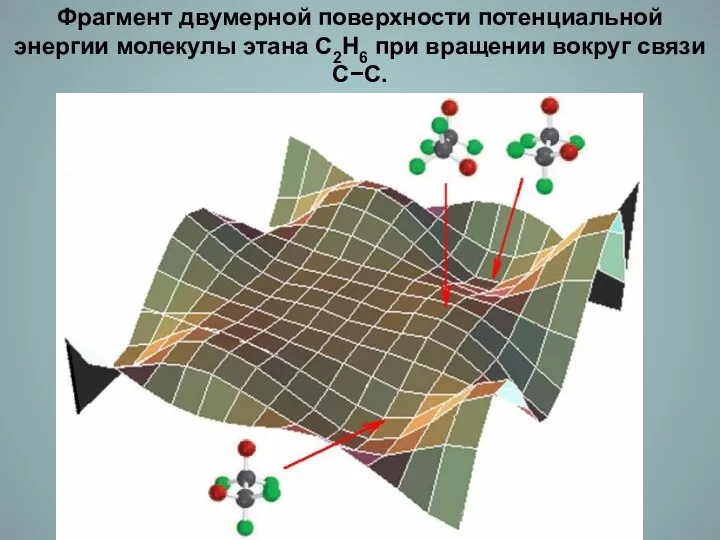
- 11. Фрагмент двумерной поверхности потенциальной энергии молекулы этана С2Н6 при вращении вокруг связи С−С.
- 12. Uневал = Uэлектрост + UВдВ + UН-св + Uдоп Потенциальная энергия невалентных взаимодействий Электростатический потенциал, создаваемый
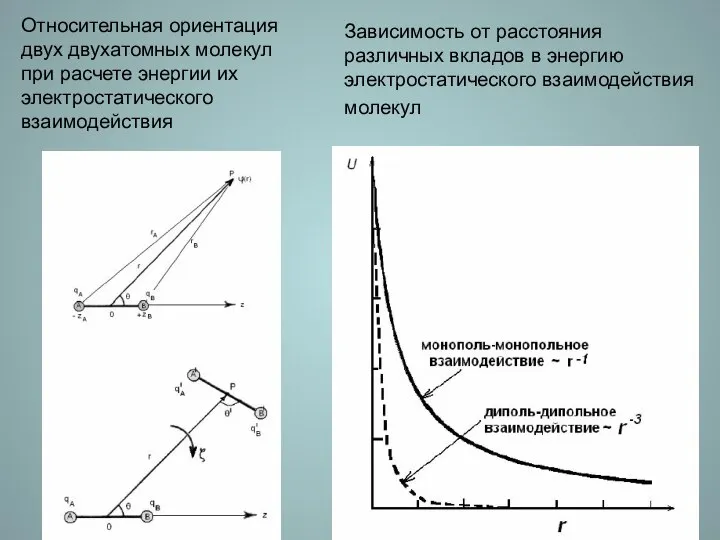
- 13. Зависимость от расстояния различных вкладов в энергию электростатического взаимодействия молекул Относительная ориентация двух двухатомных молекул при
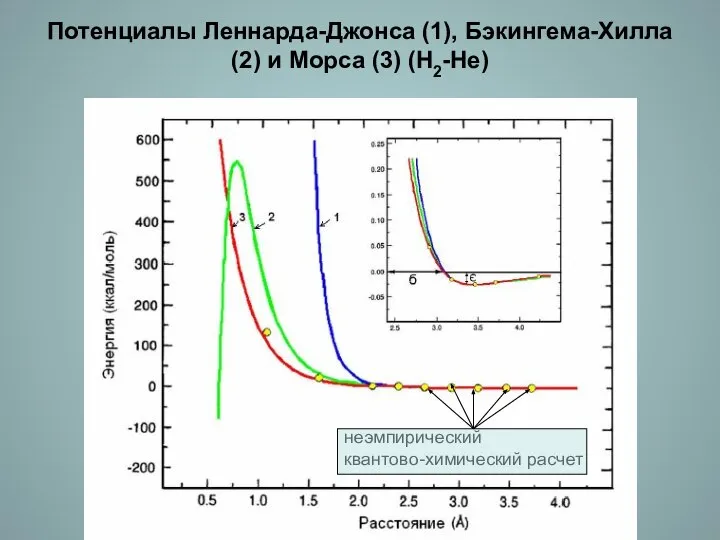
- 14. Потенциалы Леннарда-Джонса (1), Бэкингема-Хилла (2) и Морса (3) (Н2-Не) неэмпирический квантово-химический расчет
- 16. Скачать презентацию





 Понятие алгоритма и способы записи алгоритмов. (урок 1)
Понятие алгоритма и способы записи алгоритмов. (урок 1) Sony Bravia R5. Инструкция по настройке Fork плеера
Sony Bravia R5. Инструкция по настройке Fork плеера Химическая безопасность
Химическая безопасность Тренажер «Состав чисел первого десятка». Чекалина Наталья Анатольевна. Учитель начальных классов МОУ СОШ №12 г.Волгограда. 2012г.
Тренажер «Состав чисел первого десятка». Чекалина Наталья Анатольевна. Учитель начальных классов МОУ СОШ №12 г.Волгограда. 2012г. Методы принятия управленческих решений Подготовила студентка группы МЭ-102 Швейкина Алёна
Методы принятия управленческих решений Подготовила студентка группы МЭ-102 Швейкина Алёна  Презентация "Ключевые показатели эффективности деятельности персонала банка" - скачать презентации по Экономике
Презентация "Ключевые показатели эффективности деятельности персонала банка" - скачать презентации по Экономике Декор одежды куклы Купавки . Куклы в народной традиции
Декор одежды куклы Купавки . Куклы в народной традиции ОБЩИЕ ПОНЯТИЯ ТЕОРИИ ОШИБОК ИЗМЕРЕНИЙ
ОБЩИЕ ПОНЯТИЯ ТЕОРИИ ОШИБОК ИЗМЕРЕНИЙ Электронные таблицы
Электронные таблицы Купола над «белым безмолвием». Остров Ватерлоо
Купола над «белым безмолвием». Остров Ватерлоо Мовленнєва компетенція
Мовленнєва компетенція Бытовые электроинструменты
Бытовые электроинструменты Беркли и Юм субъективный идеализм
Беркли и Юм субъективный идеализм  Разделительные знаки Ъ и Ь - презентация
Разделительные знаки Ъ и Ь - презентация Где логика. Игра
Где логика. Игра Презентация Рекреационные ресурсы мира
Презентация Рекреационные ресурсы мира  Разработка электронных часов, на микроконтроллере с динамической индикацией
Разработка электронных часов, на микроконтроллере с динамической индикацией Создание планово-высотного обоснования и съемка карьера тахеометром Nikon NPL 332
Создание планово-высотного обоснования и съемка карьера тахеометром Nikon NPL 332 Alfresco ECM (Enterprise Content Management)
Alfresco ECM (Enterprise Content Management) Федя Клюков
Федя Клюков Твердотільна електроніка. Лекция 4. Лавинно-пролітні діоди
Твердотільна електроніка. Лекция 4. Лавинно-пролітні діоди Искусство рассказывает о красоте Земли 8 класс
Искусство рассказывает о красоте Земли 8 класс История государственного гимна России
История государственного гимна России Лекция 3 Электропроводность растворов электролитов
Лекция 3 Электропроводность растворов электролитов Презентация "Первобытное искусство (6 класс)" - скачать презентации по МХК
Презентация "Первобытное искусство (6 класс)" - скачать презентации по МХК Типы соединения костей. Строение и классификация суставов. Биомеханика суставов
Типы соединения костей. Строение и классификация суставов. Биомеханика суставов Классификация тепловых электростанций и их энергоэкономические особенности
Классификация тепловых электростанций и их энергоэкономические особенности Монтаж высотных инженерных сооружений
Монтаж высотных инженерных сооружений