Содержание
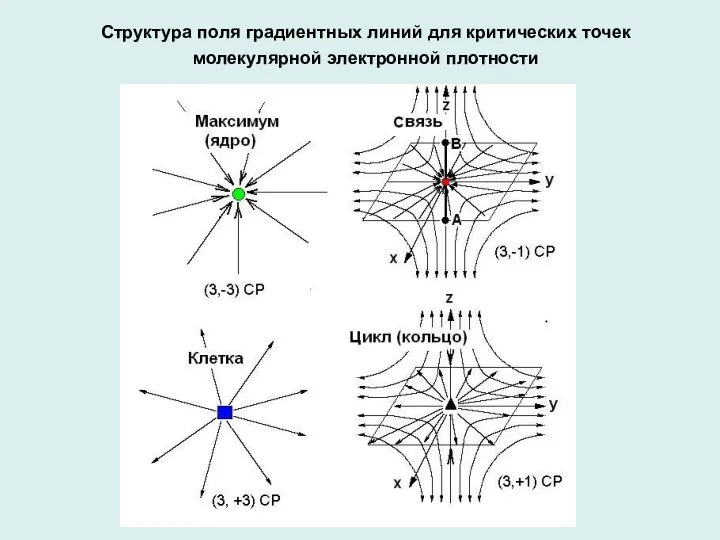
- 2. Структура поля градиентных линий для критических точек молекулярной электронной плотности
- 3. Возможные невырожденные критические точки ЭП: (3, -3), (3, -1), (3, 1), (3, +3) максимум седло (№1)
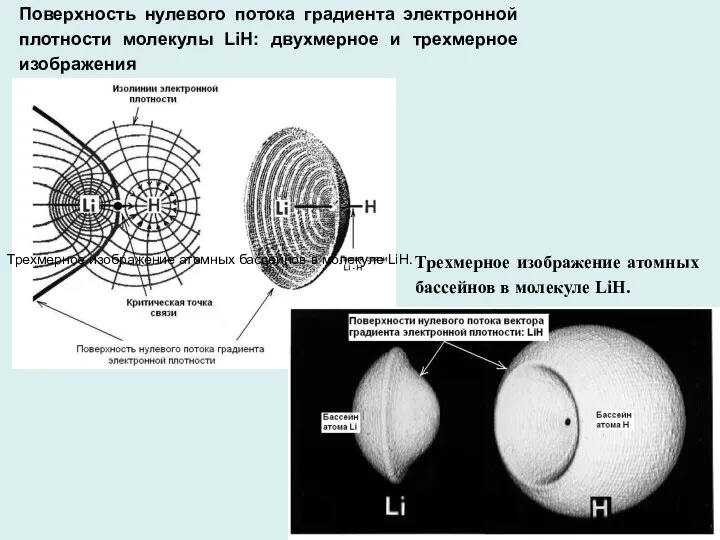
- 4. Поверхность нулевого потока градиента электронной плотности молекулы LiH: двухмерное и трехмерное изображения Трехмерное изображение атомных бассейнов
- 5. Собственный вектор гессиана, отвечающий положительной кривизне в точке rb, задает направления двух градиентных траекторий, которые заканчиваются
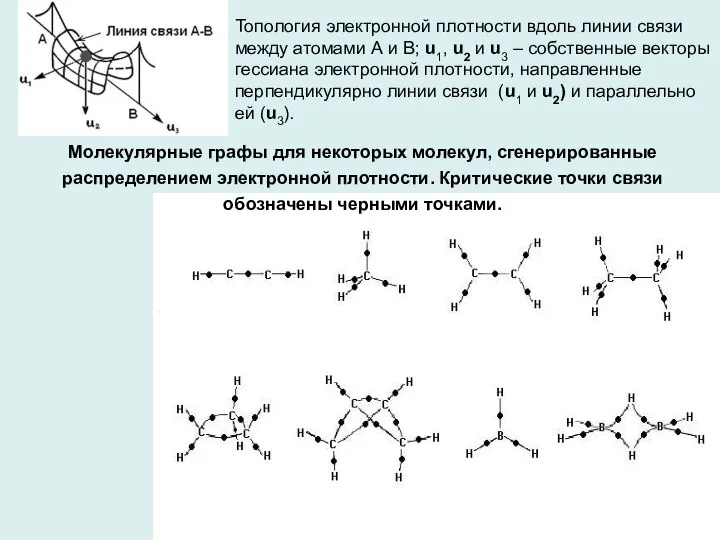
- 6. Молекулярные графы для некоторых молекул, сгенерированные распределением электронной плотности. Критические точки связи обозначены черными точками. Топология
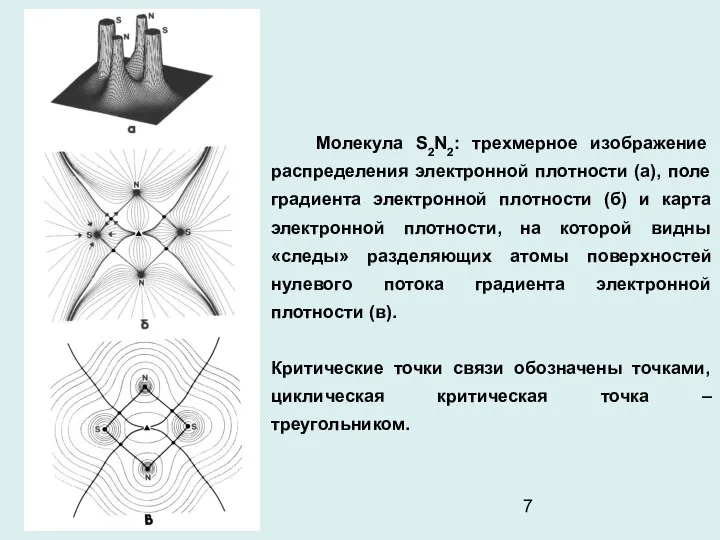
- 7. Молекула S2N2: трехмерное изображение распределения электронной плотности (а), поле градиента электронной плотности (б) и карта электронной
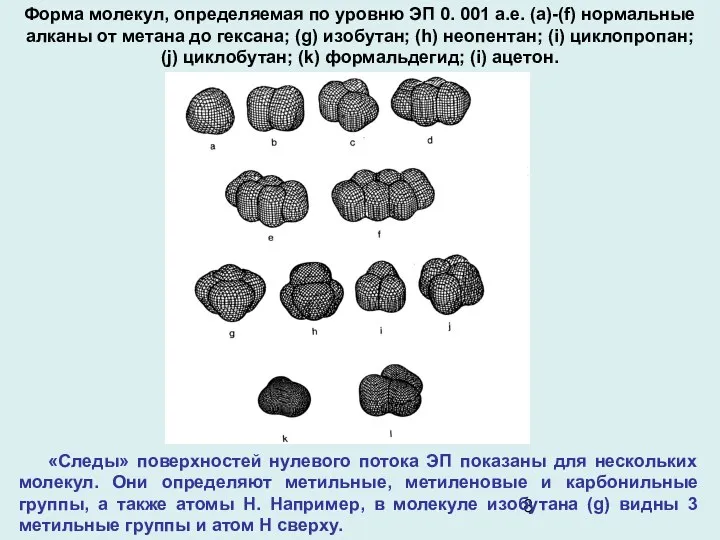
- 8. Форма молекул, определяемая по уровню ЭП 0. 001 а.е. (a)-(f) нормальные алканы от метана до гексана;
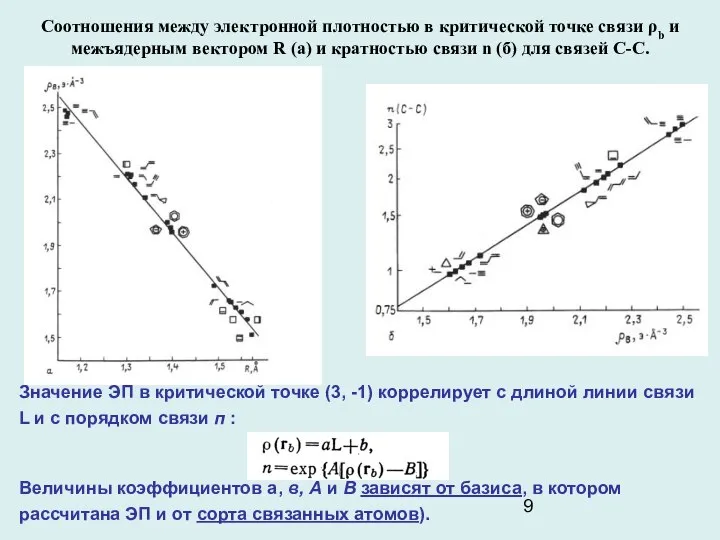
- 9. Соотношения между электронной плотностью в критической точке связи ρb и межъядерным вектором R (а) и кратностью
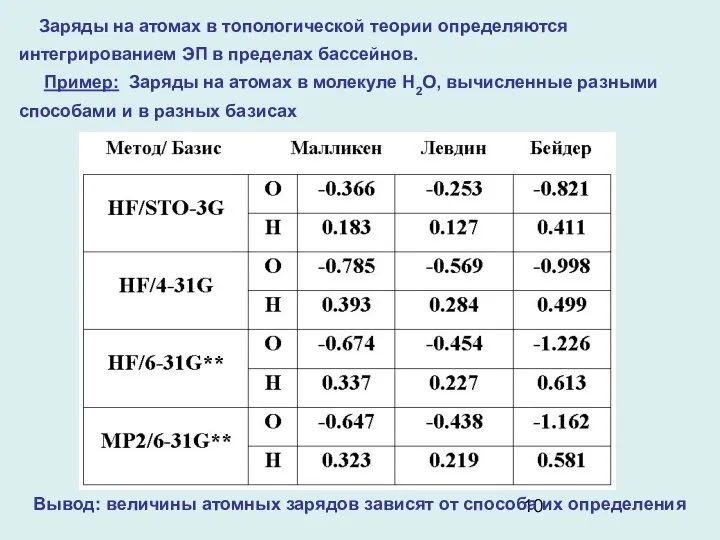
- 10. Заряды на атомах в топологической теории определяются интегрированием ЭП в пределах бассейнов. Пример: Заряды на атомах
- 11. Химическая информация и лапласиан ЭП ∇2ρ. Если ЭП в т. r превышает среднее значение ЭП в
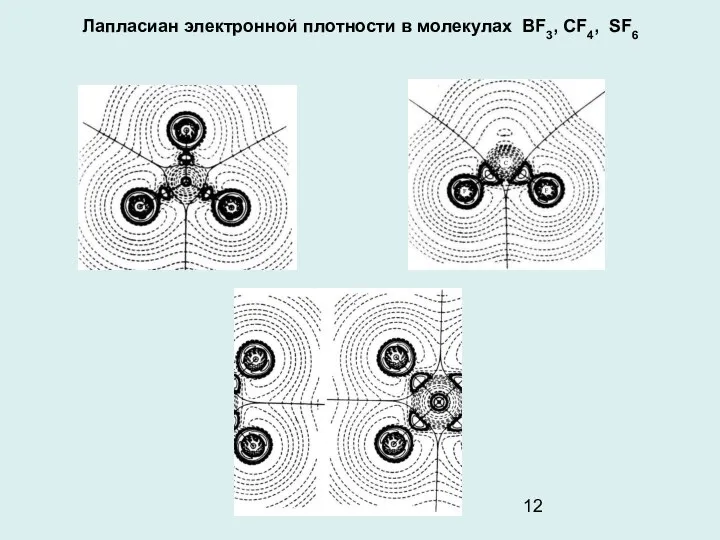
- 12. Лапласиан электронной плотности в молекулах BF3, CF4, SF6
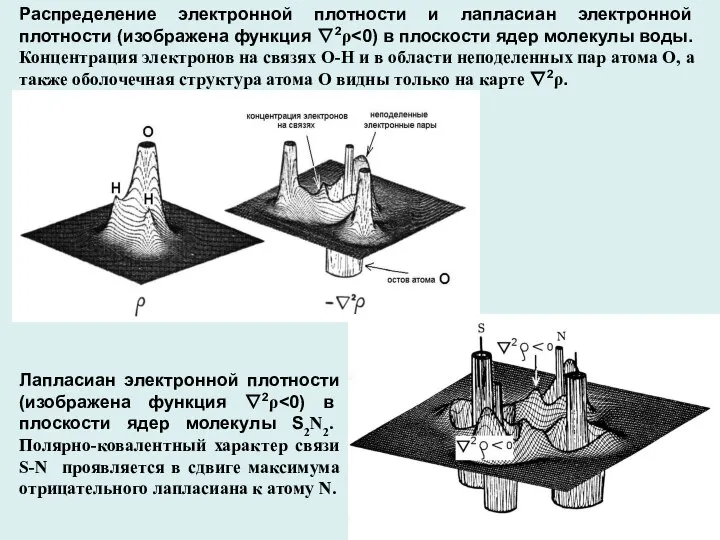
- 13. Распределение электронной плотности и лапласиан электронной плотности (изображена функция ∇2ρ Концентрация электронов на связях О-Н и
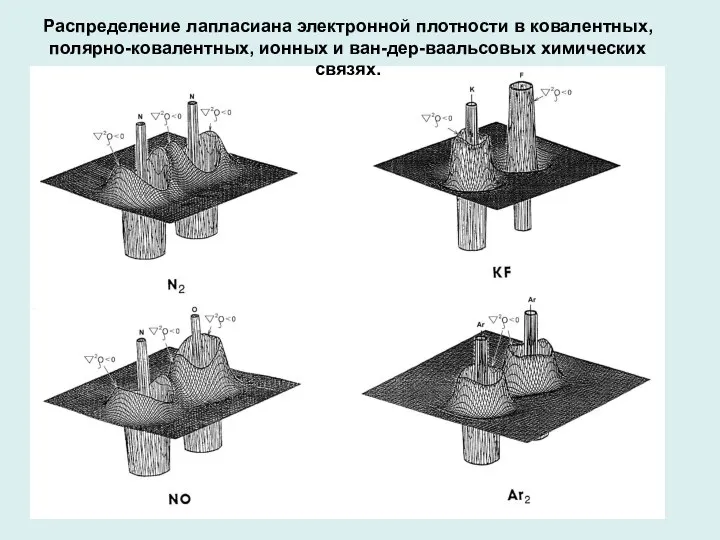
- 14. Распределение лапласиана электронной плотности в ковалентных, полярно-ковалентных, ионных и ван-дер-ваальсовых химических связях.
- 15. 1) Если ∇2ρ 2) Если ∇2ρ > 0 в точке rb, то ЭП смещена к каждому
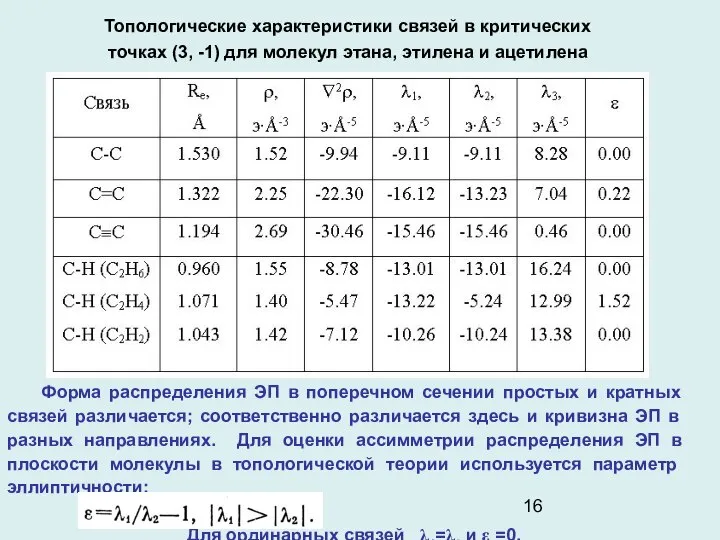
- 16. Топологические характеристики связей в критических точках (3, -1) для молекул этана, этилена и ацетилена Форма распределения
- 17. Признаки наличия ковалентной химической связи между парой атомов. Связь образуется, если: 1) между атомами существует критическая
- 19. Скачать презентацию





 Подшипники скольжения
Подшипники скольжения  Традиционный легкоатлетический пробег «Подснежник»
Традиционный легкоатлетический пробег «Подснежник» Тени. Общие положения. Чертежи пространственных фигур. (Лекция 12)
Тени. Общие положения. Чертежи пространственных фигур. (Лекция 12) Многопоточное программирование (Лекция 2). Сокеты Беркли, IPv4, IPv6, UDS, мультиплексирование
Многопоточное программирование (Лекция 2). Сокеты Беркли, IPv4, IPv6, UDS, мультиплексирование Презентация Возникновение науки
Презентация Возникновение науки или «Как посчитать корреляцию?»
или «Как посчитать корреляцию?» Влияние физического воспитания на умственное развитие дошкольников
Влияние физического воспитания на умственное развитие дошкольников Особенности работы со спортсменами высокой квалификации
Особенности работы со спортсменами высокой квалификации The Royal Family
The Royal Family Нормативные правовые акты (НПА) в сфере наследования в мире и в России
Нормативные правовые акты (НПА) в сфере наследования в мире и в России Поверхности. Сечение поверхности плоскостью. Пересечение поверхностей
Поверхности. Сечение поверхности плоскостью. Пересечение поверхностей Адреса таймера и их назначение
Адреса таймера и их назначение Сучасні тенденції мовної освіти
Сучасні тенденції мовної освіти  Малинина Алена Викторовна Учитель черчения и изобразительного искусства МОУ « СОШ № 12» город Усолье-Сибирс
Малинина Алена Викторовна Учитель черчения и изобразительного искусства МОУ « СОШ № 12» город Усолье-Сибирс Бутик дизайнерской одежды “Salsa”. Бизнес-проект
Бутик дизайнерской одежды “Salsa”. Бизнес-проект Генератор сигналов на основе звуковой платы
Генератор сигналов на основе звуковой платы Теория и технология оздоровительно-рекреационной двигательной активности человека
Теория и технология оздоровительно-рекреационной двигательной активности человека Жаhандану дану тұжырымдамасы мен оның мәселелері
Жаhандану дану тұжырымдамасы мен оның мәселелері Червячные передачи
Червячные передачи Презентация Порядок назначения на должности государственной гражданской службы таможенных органов
Презентация Порядок назначения на должности государственной гражданской службы таможенных органов Что нужно знать при подготовке проблемно-диалогического урока по любому предмету
Что нужно знать при подготовке проблемно-диалогического урока по любому предмету Проф_семинар_14.09.19
Проф_семинар_14.09.19 Добро пожаловать в Мир Глобальных Сетевых Возможностей! - презентация
Добро пожаловать в Мир Глобальных Сетевых Возможностей! - презентация Этикет деловых отношений. Поведение в общественных местах. Этикет деловых приемов
Этикет деловых отношений. Поведение в общественных местах. Этикет деловых приемов Адилбеков
Адилбеков Ангиология головы и шеи
Ангиология головы и шеи Стойкость и защита древесины
Стойкость и защита древесины Горне-Успенский монастырь
Горне-Успенский монастырь