Содержание
- 2. Жирные кислоты в организме человека имеют чётное число атомов углерода, что связано с особенностями их биосинтеза,
- 3. ). В свободном, неэтерифицированном состоянии жирные кислоты в организме содержатся в небольшом количестве, например в крови,
- 4. ). Жирные кислоты, не содержащие двойных связей, называют насыщенными. Основной насыщенной жирной кислотой в липидах человека
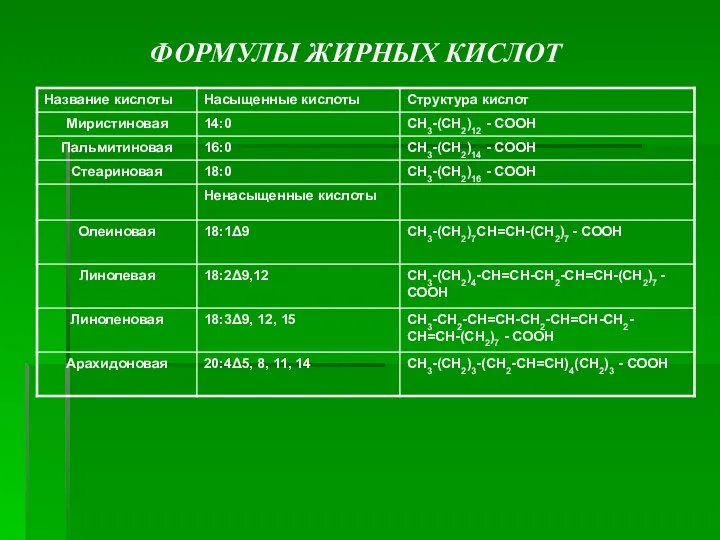
- 5. ФОРМУЛЫ ЖИРНЫХ КИСЛОТ
- 6. Состав жирных кислот и температура плавления пищевых жиров
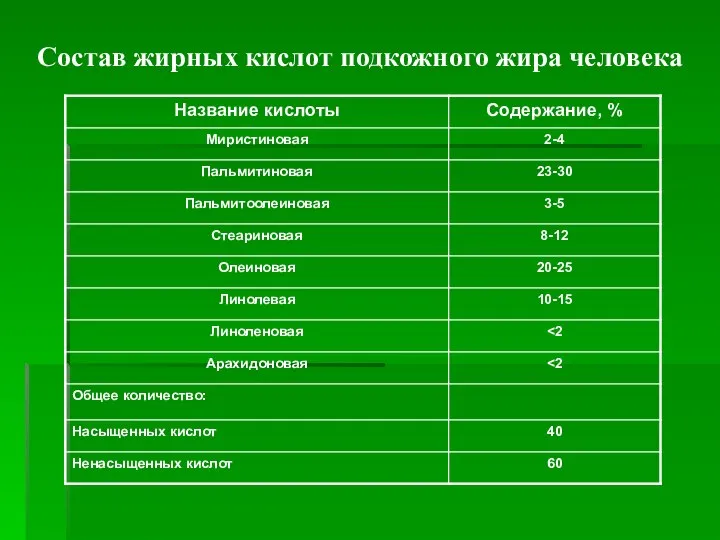
- 7. Состав жирных кислот подкожного жира человека
- 8. ). Двойные связи в жирных кислотах в организме человека имеют цис-конфигурацию. Цис-конфигурация двойной связи делает алифатическую
- 9. Жирные кислоты поступают с пищей или синтезируются в организме (кроме ненасыщенных кислот). Субстраты, необходимые для синтеза
- 10. Хотя путь катаболизма жирных кислот заканчивается образованием ацетил-КоА, служащим исходным субстратом для синтеза жирных кислот, процессы
- 11. Окисление жирных кислот увеличивается в постабсорбтивный период, при голодании и физической работе в печени и мышцах.
- 12. β-Окисление - специфический путь катаболизма жирных кислот, при котором от карбоксильного конца жирной кислоты последовательно отделяется
- 13. Активация жирных кислот Перед тем, как вступить в различные реакции, жирные кислоты должны быть активированы, т.е.
- 14. Ацил-КоА синтетаза находится как в цитозоле, так и в матриксе митохондрий. Этот фермент отличается по специфичности
- 15. Транспорт жирных кислот с длинной углеводородной цепью в митохондриях
- 16. β-Окисление жирных кислот, происходит в матриксе митохондрий, поэтому после активации жирные кислоты должны транспортироваться внутрь митохондрий.
- 17. Карнитин поступает с пищей или синтезируется из аминокислот лизина и метионина. В реакциях синтеза карнитина участвует
- 18. Ацилкарнитин проходит через межмембранное пространство к наружной стороне внутренней мембраны и транспортируется с помощью карнитинацилкарнитинтранслоказы на
- 19. 1. карнитинацилтрансфераза I - регуляторный фермент β-окисления; ингибируется малонил-КоА. 2. * - карнитинацилкарнитинтранслоказа возращает карнитин на
- 20. β-Окисление жирных кислот - специфический путь катаболизма жирных кислот, протекающий в матриксе митохондрий только в аэробных
- 21. β-Окисление начинается с дегидрирования ацил-КоА FAD-зависимой ацил-КоА дегидрогеназой с образованием двойной связи между α- и β-атомами
- 22. В следующей реакции β-окисления по месту двойной связи присоединяется молекула воды таким образом, что ОН-группа находится
- 23. Затем β-гидроксиацил-КоА окисляется NАD+-зависимой дегидрогеназой. Восстановленный NADH, окисляясь в ЦПЭ, обеспечивает энергией синтез 3 молекул АТФ.
- 24. В результате этой последовательности из 4 реакций от ацил-КоА отделяется двухуглеродный остаток - ацетил-КоА. Жирная кислота,
- 26. Продуктами каждого цикла β-окисления являются FADH2, NADH и ацетил-КоА. Хотя реакции в каждом "цикле" одни и
- 27. Если рассчитывать выход АТФ при окислении пальмитиновой кислоты, то из общей суммы молекул АТФ необходимо вычесть
- 28. Во многих тканях окисление жирных кислот - важный источник энергии. Это ткани с высокой активностью ферментов
- 29. Синтез АТФ при полном окислении пальмитиновой кислоты
- 30. Регуляция скорости β-окисления β-Окисление - метаболический путь, прочно связанный с работой ЦПЭ и общего пути катаболизма.
- 31. Скорость β-окисления в тканях зависит от доступности субстрата, т.е. от количества жирных кислот, поступающих в митохондрии.
- 32. В этих условиях жирные кислоты становятся преимущественным источником энергии для мышц и печени, так как в
- 33. Также накапливаются промежуточный метаболит гликолиза, глюкозо-6-фосфат. Глюкозо-6-фосфат ингибирует гексокиназу и препятствует использованию глюкозы в процессе гликолиза.
- 34. Скорость β-окисления зависит также от активности фермента карнитинацилтрансферазы I. В печени этот фермент ингибируется малонил-КоА. В
- 35. α-Окисление жирных кислот
- 36. В липидах мозга и нервной ткани преобладают жирные кислоты с очень длинной цепью - более 20
- 37. ОБМЕН КЕТОНОВЫХ ТЕЛ
- 38. В отличие от других тканей мозг и нервная ткань практически не используют жирные кислоты в качестве
- 39. К кетоновым телам относят β-гидроксибутират, ацетоацетат и ацетон. Первые две молекулы могут окисляться в тканях, обеспечивая
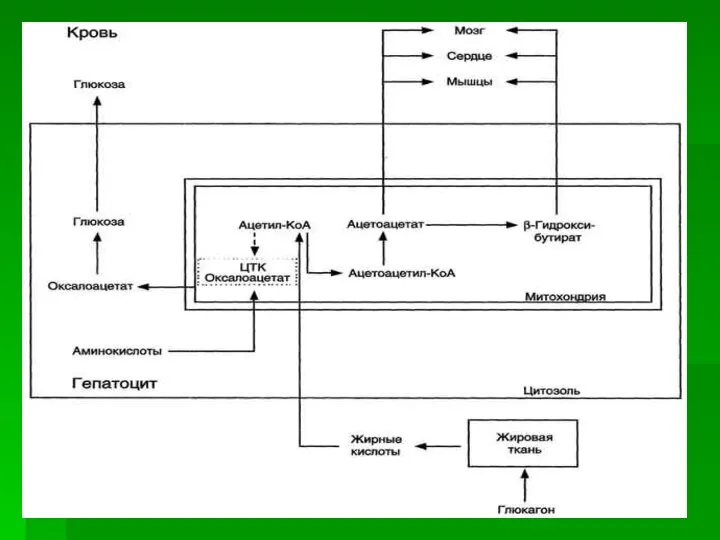
- 40. При низком соотношении инсулин/глюкагон в крови в жировой ткани активируется распад жиров. Жирные кислоты поступают в
- 41. Синтез кетоновых тел начинается с взаимодействия двух молекул ацетил-КоА, которые под действием фермента тиолазы образуют ацетоацетил-КоА.
- 42. В клетках печени при активном β-окислении создаётся высокая концентрация NADH. Это способствует превращению большей части ацетоацетата
- 43. При высокой концентрации ацетоацетата часть его декарбоксилируется, превращаясь в ацетон. Ацетон не утилизируется тканями, но выделяется
- 44. При голодании в результате действия глюкагона активируется липолиз в жировой ткани и в печени. Количество оксалоацетата
- 46. Регуляция синтеза кетоновых тел
- 47. Регуляторный фермент синтеза кетоновых тел - ГМГ-КоА синтаза (3-гидрокси-3-метилглутарил-КоА) Синтез ГМГ-КоА-синтазы увеличивается при повышении концентрации жирных
- 48. Когда поступление жирных кислот в клетки печени увеличивается, КоА связывается с ними, концентрация свободного КоА снижается,
- 49. При длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца и почек. !!!
- 51. Скачать презентацию













































 Информационные технологии
Информационные технологии Основы исламской культуры(основы мировых религиозных культур)
Основы исламской культуры(основы мировых религиозных культур) Словарная работа. Декабрь, январь, февраль.
Словарная работа. Декабрь, январь, февраль. Тебя, Господь, возвышаю я
Тебя, Господь, возвышаю я Личность и социальная среда Домашняя работа: Параграф 5 Проблему письменно Понятия выучить
Личность и социальная среда Домашняя работа: Параграф 5 Проблему письменно Понятия выучить Успенский собор во Владимире. Художественная культура средневековья
Успенский собор во Владимире. Художественная культура средневековья Управление процессом планирования
Управление процессом планирования Эмболия-2
Эмболия-2 Морской торговый регламент Выполнил студент группы Ю-104 Кравцов Дмитрий
Морской торговый регламент Выполнил студент группы Ю-104 Кравцов Дмитрий Презентация Невиновное причинение вреда – законодательная регламентация и проблемы практического определения
Презентация Невиновное причинение вреда – законодательная регламентация и проблемы практического определения ПРЕДМЕТ АКУШЕРСТВА. ИСТОРИЯ
ПРЕДМЕТ АКУШЕРСТВА. ИСТОРИЯ Курсовой проект «Проектирование процессора ЭВМ»
Курсовой проект «Проектирование процессора ЭВМ» Международная защита прав человека
Международная защита прав человека Проектирование программного обеспечения при объектном подходе
Проектирование программного обеспечения при объектном подходе Универсальные Котлы
Универсальные Котлы Постоянство скорости света
Постоянство скорости света ИГРАЕМ В КУКЛЫ Тихонова Юлия ученица 4 Б класса Руководитель: Л.И.Мельникова учитель начальных классов
ИГРАЕМ В КУКЛЫ Тихонова Юлия ученица 4 Б класса Руководитель: Л.И.Мельникова учитель начальных классов Учет готовой продукции и ее реализации предприятием
Учет готовой продукции и ее реализации предприятием Презентация "Генитивная метафора как средство усиления экспрессивности поэтического языка Тимофея Белозёрова" - скачать пре
Презентация "Генитивная метафора как средство усиления экспрессивности поэтического языка Тимофея Белозёрова" - скачать пре Открытая экономика
Открытая экономика Конструкция автомобиля. Трансмиссия
Конструкция автомобиля. Трансмиссия Реле напряжения Easy 9
Реле напряжения Easy 9 Урок на тему «Интегрированная среда разработки приложений Lazarus»
Урок на тему «Интегрированная среда разработки приложений Lazarus» Па́бло Пикассо
Па́бло Пикассо Туристическая фирма
Туристическая фирма Полный привод Audi quattro
Полный привод Audi quattro Особенности ухода за больными в послеоперационный период
Особенности ухода за больными в послеоперационный период Артамонова Нина Андреевна учитель изобразительного искусства МОУ Петропавловской СОШ
Артамонова Нина Андреевна учитель изобразительного искусства МОУ Петропавловской СОШ