Содержание
- 2. Рекомендуемая литература 1. Травень, В.Ф. Органическая химия: Учебник для вузов в 2-х томах. – М.: Академкнига,
- 3. Перечень пособий, методических указаний к проведению учебных занятий и самостоятельной работы студентов Углеводороды. Галогенпроизводные углеводородов. Учебное
- 4. Дополнительная литература Органикум (практикум по органической химии) т.1 и т.2 "Мир",1980 г. А.А.Терней, Современная органическая химия,
- 5. СТРУКТУРА КУРСА 2 семестр Лекции 26 ч Лабораторные занятия 58 ч Самостоятельная работа 96 Контрольная работа
- 6. Цель курса На основе знаний о состоянии и достижений современной органической химии научить обучающегося: 1. Применять
- 7. ОРГАНИЧЕСКАЯ ХИМИЯ Термин «органический» сохранился с давних пор, когда вещества делили на неорганические (полученные из минералов)
- 8. Органическая химия – это химия соединений углерода Особая роль углерода в нашем мире обусловлена уникальной способностью
- 9. Основные этапы развития химии 1. Предалхимический период: до III в. н.э. 2. Алхимический период: III –
- 10. ОСНОВЫ ТЕОРИИ СТРОЕНИЯ Основой современной органической химии является ТЕОРИЯ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, созданная на базе теории
- 11. Бутлеров Александр Михайлович (1828-1886)
- 12. Структурная теория А.М.Бутлерова Сущность этой теории можно сформулировать в виде следующих положений: 1. Атомы, входящие в
- 13. Структурная теория А.М.Бутлерова 4. Химические свойства атомов и атомных группировок неявляются постоянными, а зависят от других
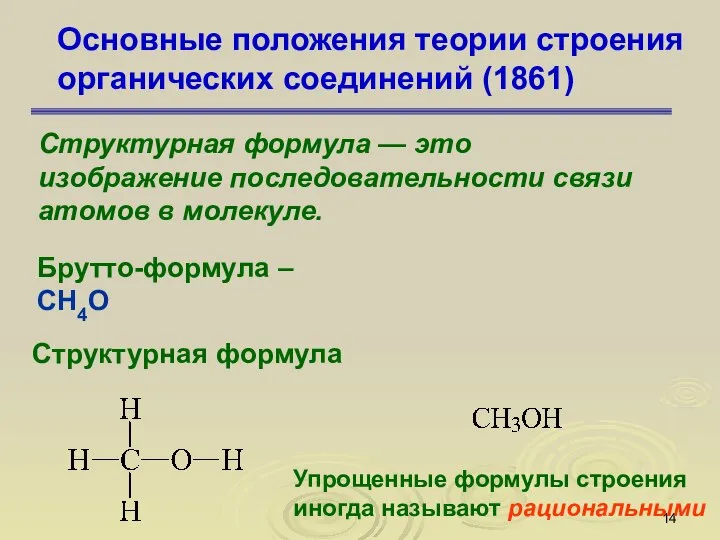
- 14. Основные положения теории строения органических соединений (1861) Структурная формула — это изображение последовательности связи атомов в
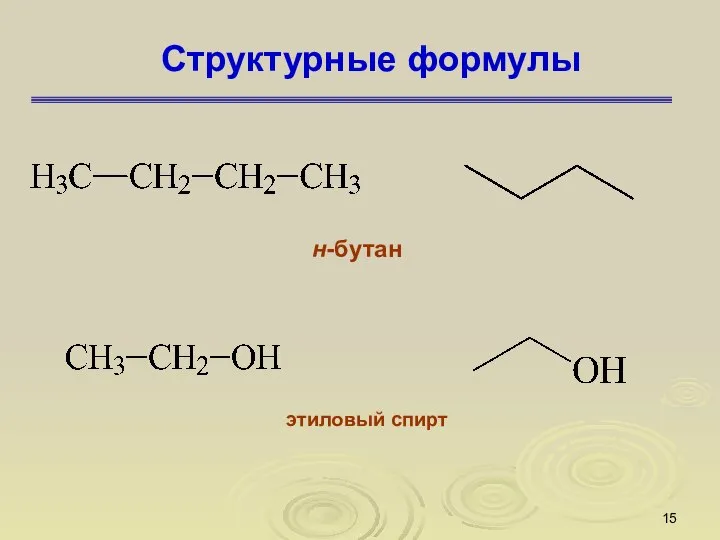
- 15. Структурные формулы н-бутан этиловый спирт
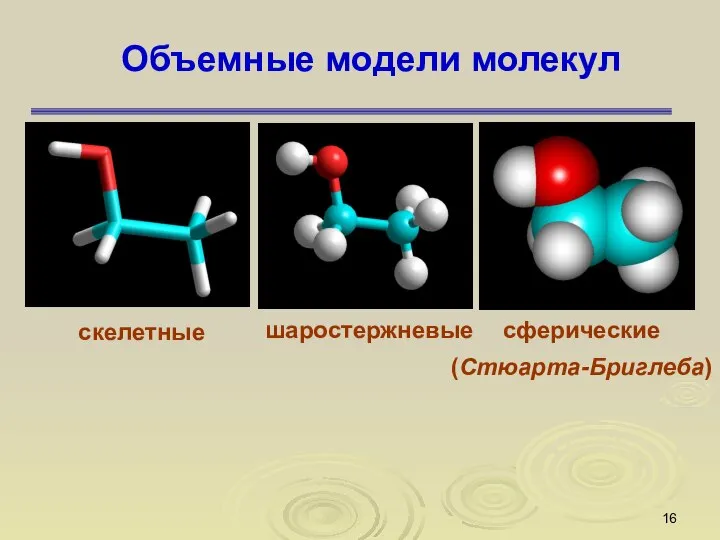
- 16. Объемные модели молекул скелетные шаростержневые сферические (Стюарта-Бриглеба)
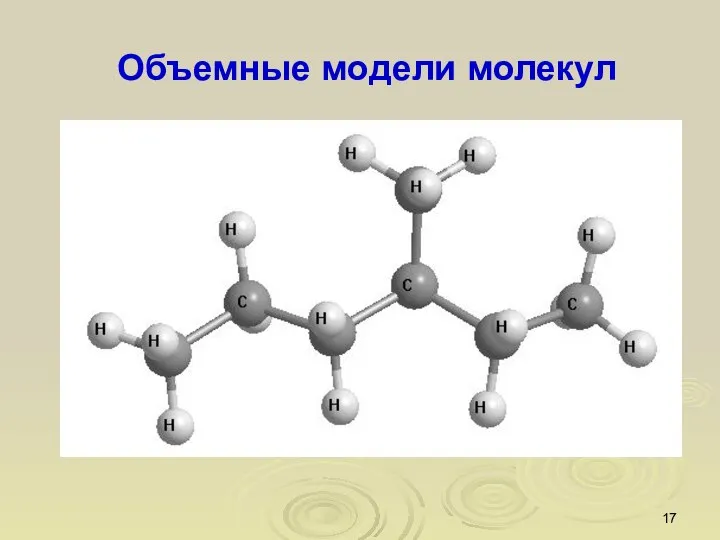
- 17. Объемные модели молекул
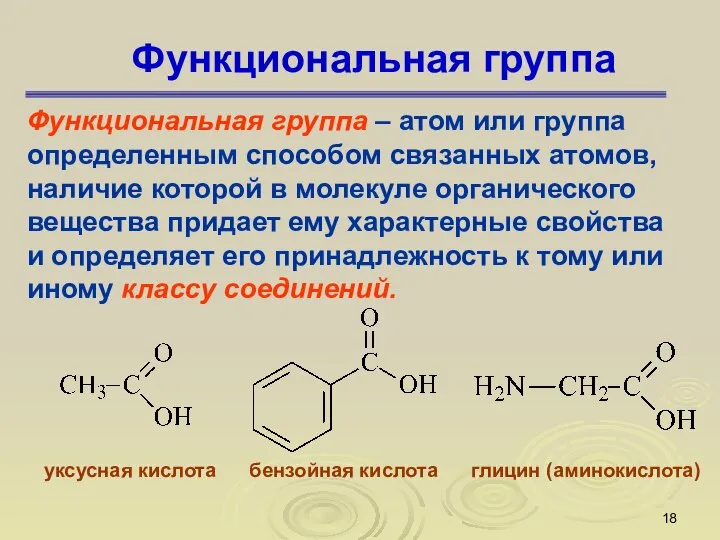
- 18. Функциональная группа Функциональная группа – атом или группа определенным способом связанных атомов, наличие которой в молекуле
- 19. Формулы для описания органических веществ В молекулах предельных углеводородов, каждый атом углерода может быть связан с
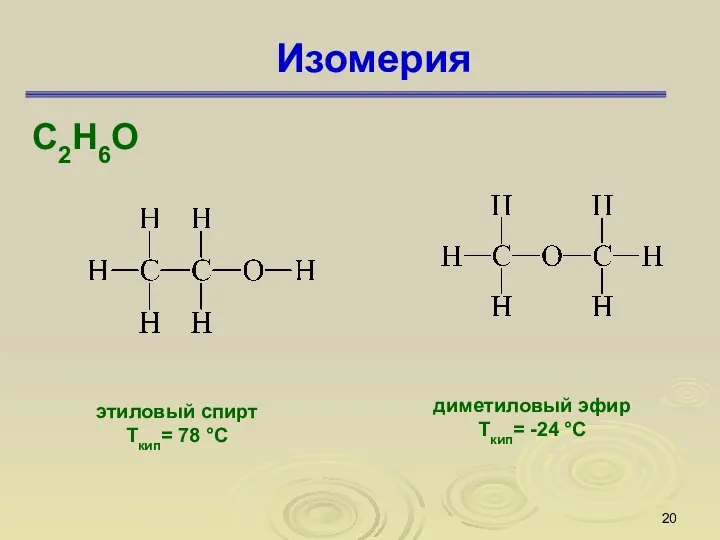
- 20. Изомерия С2Н6О этиловый спирт Ткип= 78 °С диметиловый эфир Ткип= -24 °С
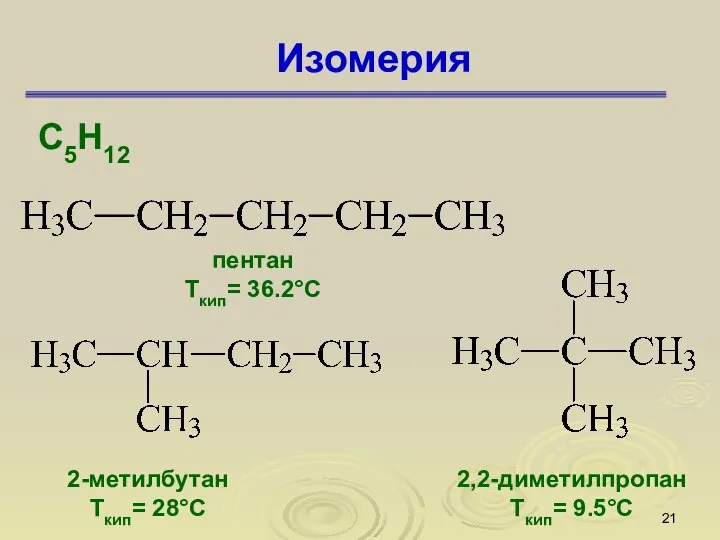
- 21. Изомерия С5Н12 пентан Ткип= 36.2°С 2-метилбутан Ткип= 28°С 2,2-диметилпропан Ткип= 9.5°С
- 22. Изомерия Изомеры — это вещества, которые имеют одинаковую молекулярную формулу, но различное химическое строение, а поэтому
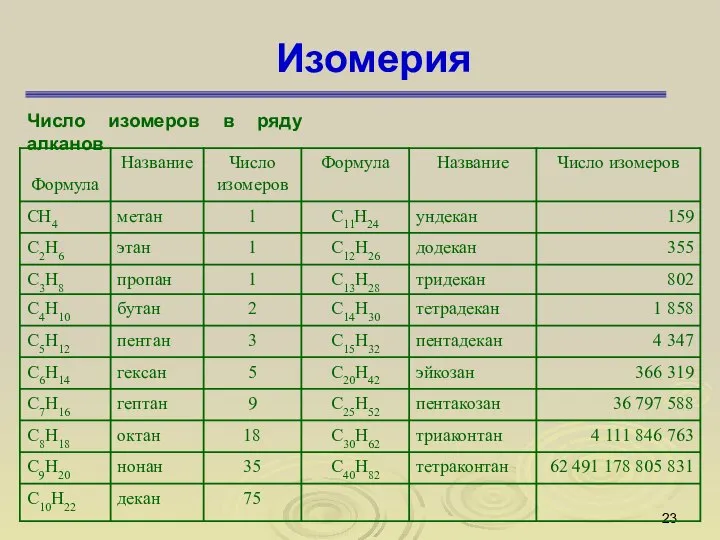
- 23. Изомерия Число изомеров в ряду алканов
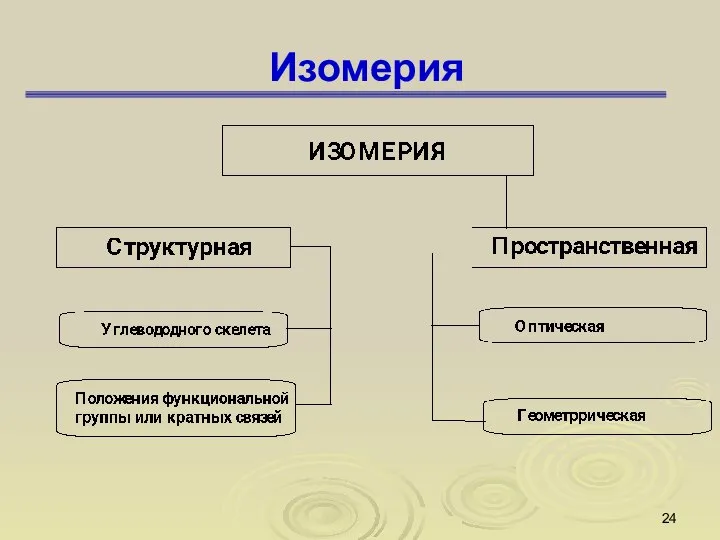
- 24. Изомерия
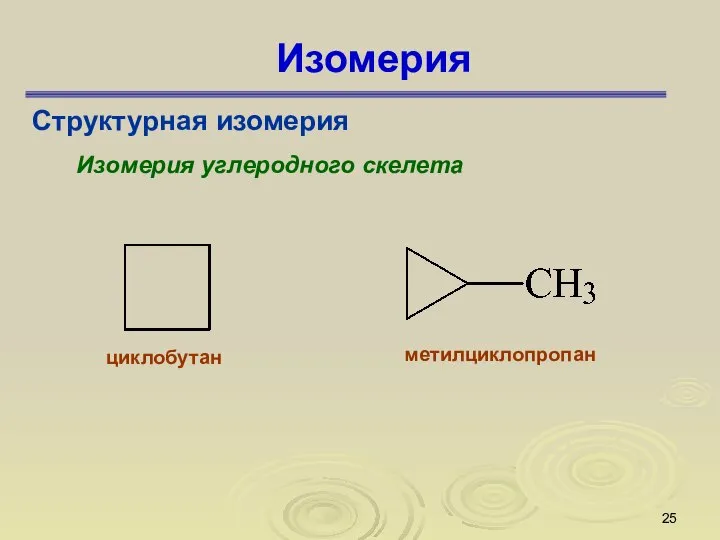
- 25. Изомерия Структурная изомерия Изомерия углеродного скелета циклобутан метилциклопропан
- 26. Изомерия Структурная изомерия Изомерия положения функциональной группы бутанол-1 бутанол-2 бутен-1 бутен-2
- 27. Изомерия Структурная изомерия Изомерия положения функциональной группы α-аминопропионовая кислота β-аминопропионовая кислота
- 28. Пространственная изомерия 1) геометрическая изомерия; 2) оптическая изомерия.
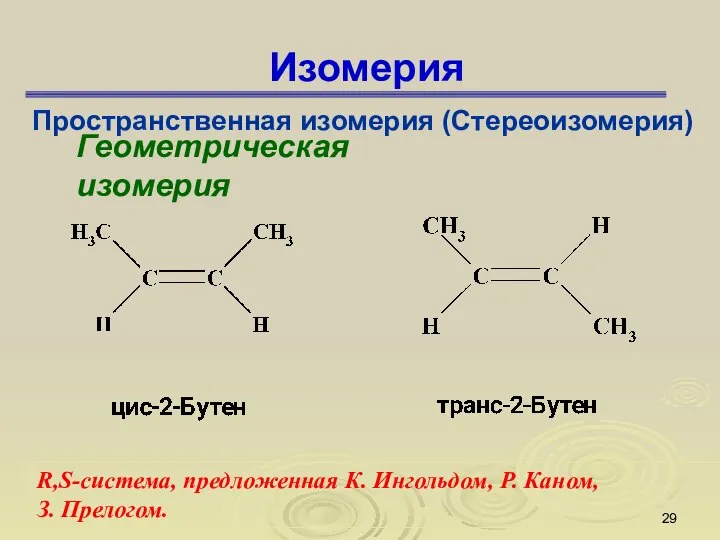
- 29. Изомерия Пространственная изомерия (Стереоизомерия) Геометрическая изомерия R,S-система, предложенная К. Ингольдом, Р. Каном, З. Прелогом.
- 30. Геометрическая изомерия Геометрическая изомерия свойственна соединениям, содержащим двойные связи (С=С , С=N, N=N). В таких соединениях
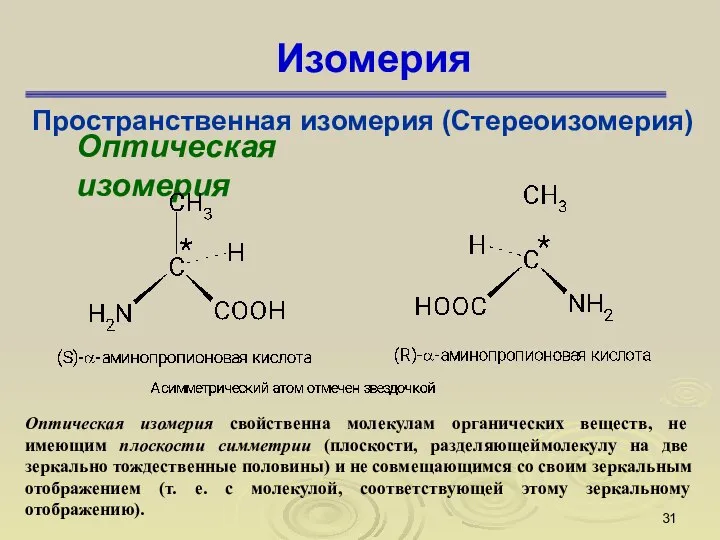
- 31. Изомерия Пространственная изомерия (Стереоизомерия) Оптическая изомерия Оптическая изомерия свойственна молекулам органических веществ, не имеющим плоскости симметрии
- 32. Изомерия Пространственная изомерия (Стереоизомерия) Оптическая изомерия S-α-аминопропионовая кислота R-α-аминопропионовая кислота Изомерия — одно из наиболее своеобразных
- 33. Изомерия . Оптические изомеры – пространственные изомеры, имеющие одинаковый количественный и качественный состав, одинаковое химическое строение,
- 34. Изомерия . Молекула, в которой при атоме углерода находятся две или более одинаковых групп, имеет плоскость
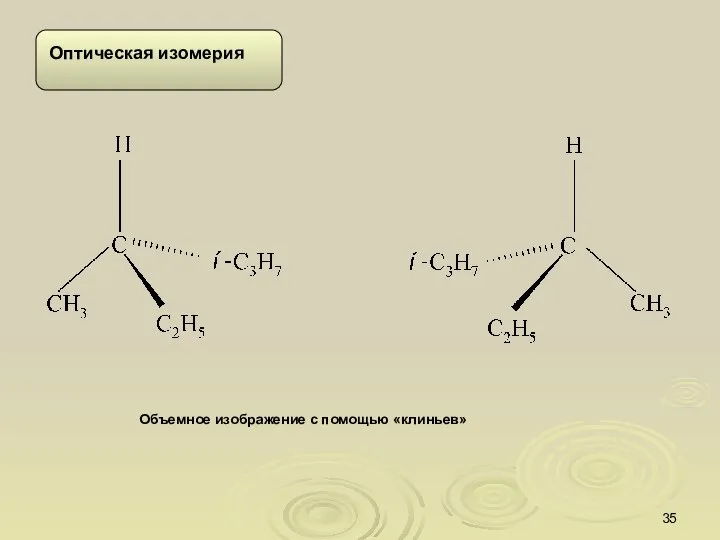
- 35. Объемное изображение с помощью «клиньев»
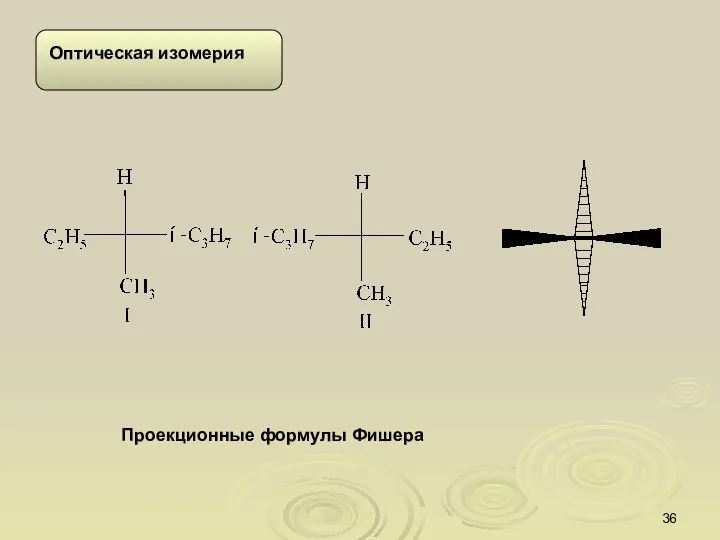
- 36. Проекционные формулы Фишера
- 37. Отличить один энантиомер от другого можно по знаку вращения плоскополяризованного света. Энантиомеры вращают плоскость поляризованного света
- 38. Гомология Группы органических соединений однотипной структуры с одинаковой функциональными группами, отличающиеся друг от друга по количеству
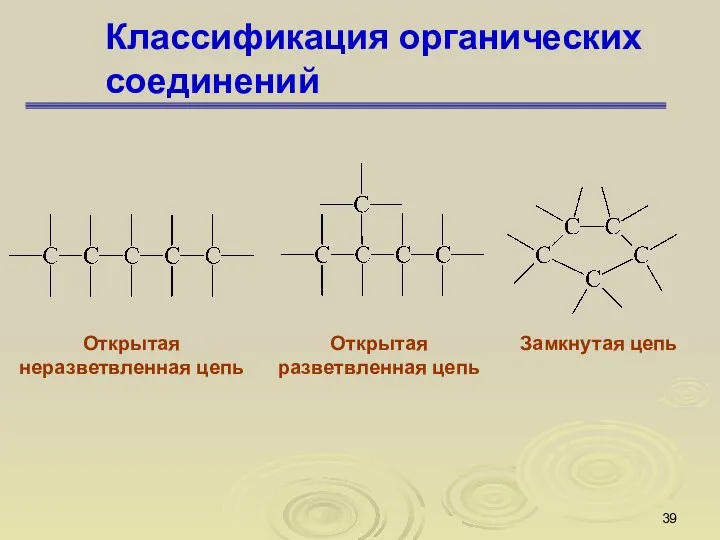
- 39. Классификация органических соединений Открытая неразветвленная цепь Открытая разветвленная цепь Замкнутая цепь
- 40. Классификация органических соединений
- 41. По расположению атомов углерода в молекуле органические соединения делятся на: ациклические соединения - соединения с открытой
- 42. Классификация органических соединений В большинстве органических молекул, помимо углерода и водорода, содержатся атомы других элементов. Именно
- 43. Классификация органических соединений Функциональные группы и классы органических соединений
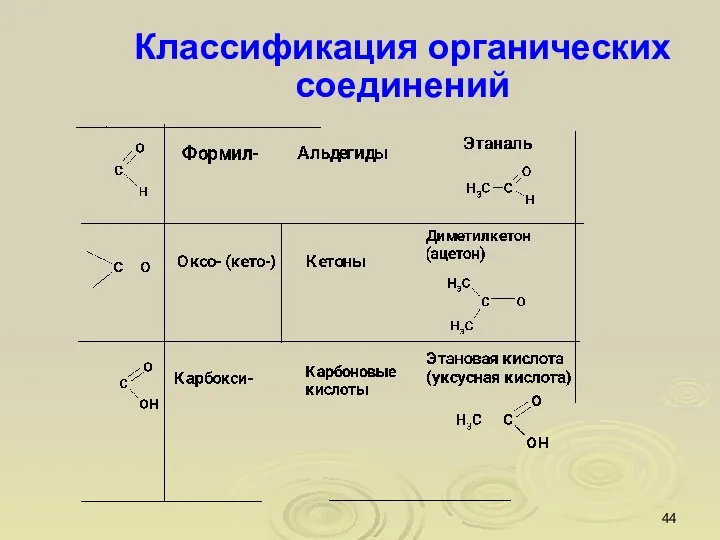
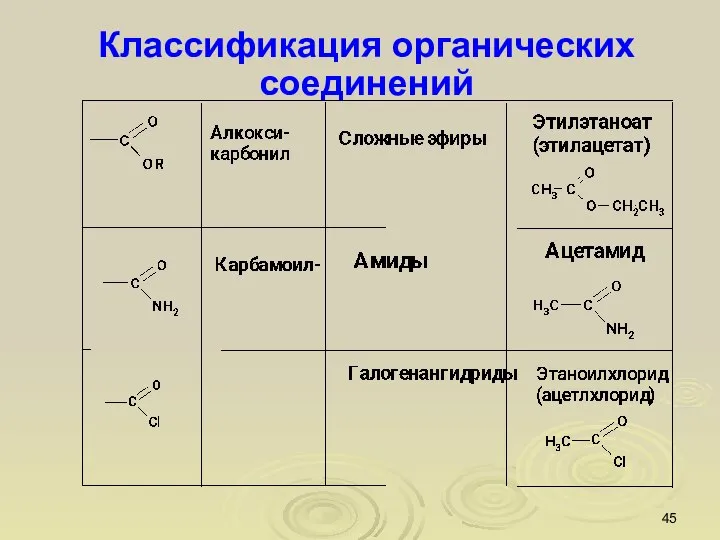
- 44. Классификация органических соединений
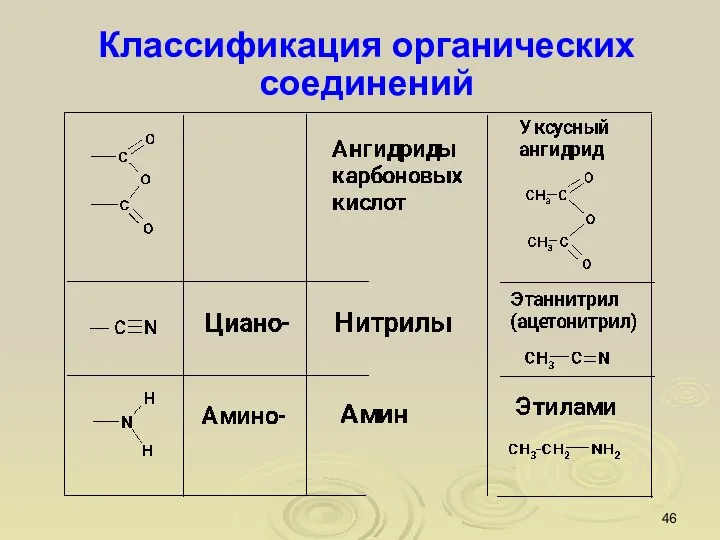
- 45. Классификация органических соединений
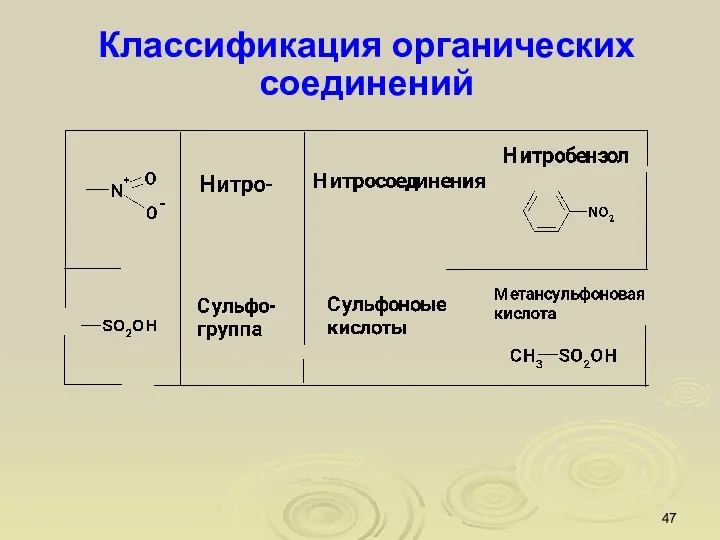
- 46. Классификация органических соединений
- 47. Классификация органических соединений
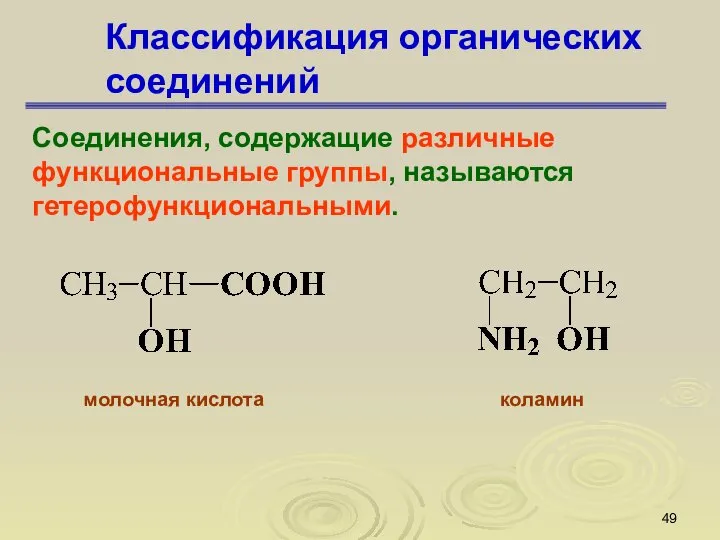
- 48. Классификация органических соединений Соединения могут содержать не одну, а несколько функциональных групп. Если эти группы одинаковые,
- 49. Классификация органических соединений Соединения, содержащие различные функциональные группы, называются гетерофункциональными. молочная кислота коламин
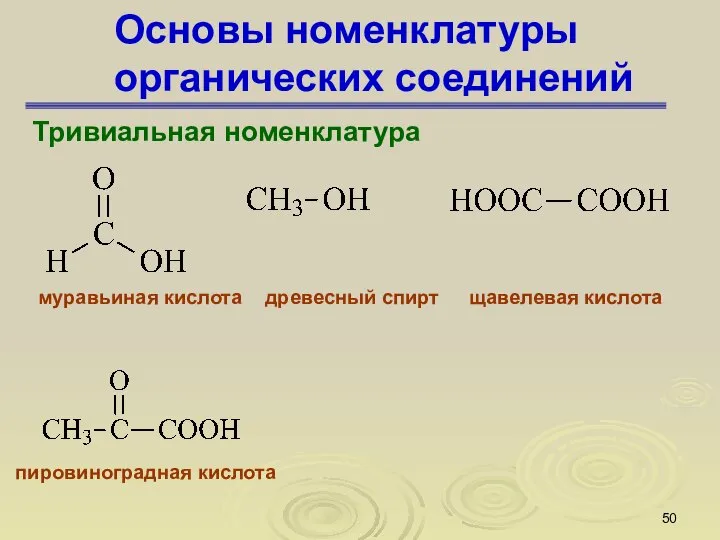
- 50. Основы номенклатуры органических соединений Тривиальная номенклатура муравьиная кислота древесный спирт щавелевая кислота пировиноградная кислота
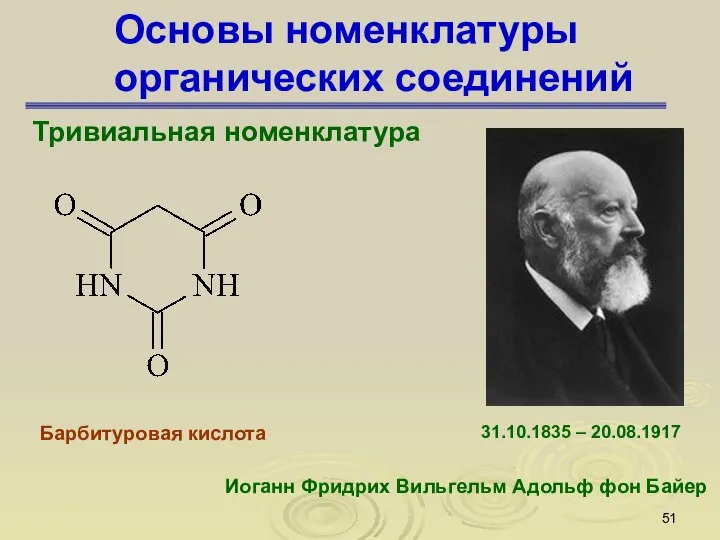
- 51. Основы номенклатуры органических соединений Тривиальная номенклатура Барбитуровая кислота Иоганн Фридрих Вильгельм Адольф фон Байер 31.10.1835 –
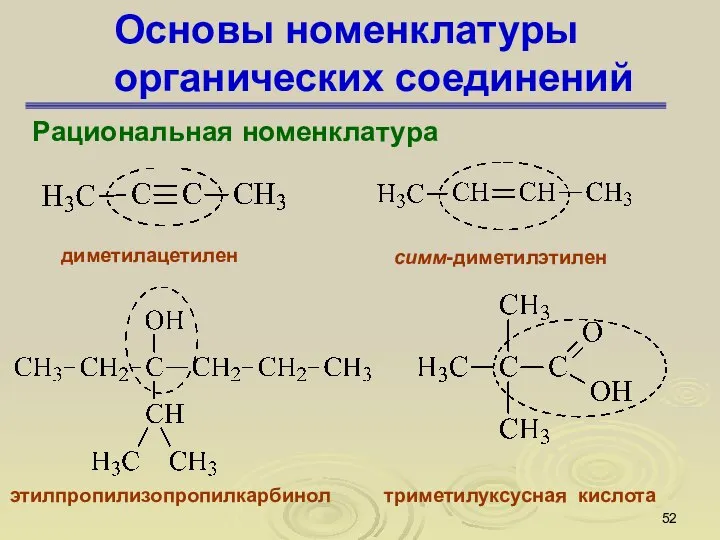
- 52. Основы номенклатуры органических соединений Рациональная номенклатура диметилацетилен симм-диметилэтилен этилпропилизопропилкарбинол триметилуксусная кислота
- 53. Основы номенклатуры органических соединений Систематическая номенклатура ИЮПАК ИЮПАК [от английского названия Международного союза чистой и прикладной
- 54. Основы номенклатуры органических соединений Систематическая номенклатура ИЮПАК
- 55. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
- 56. Электронная структура атома углерода в органических соединениях
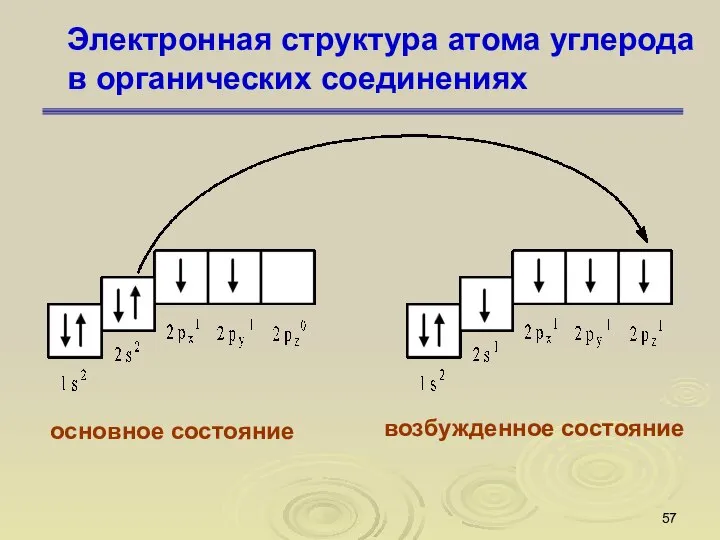
- 57. Электронная структура атома углерода в органических соединениях основное состояние возбужденное состояние
- 58. Гибридизация атомных орбиталей Из четырех неэквивалентных атомных орбиталей (одной S и трех Р) «образуется» ЧЕТЫРЕ эквивалентные
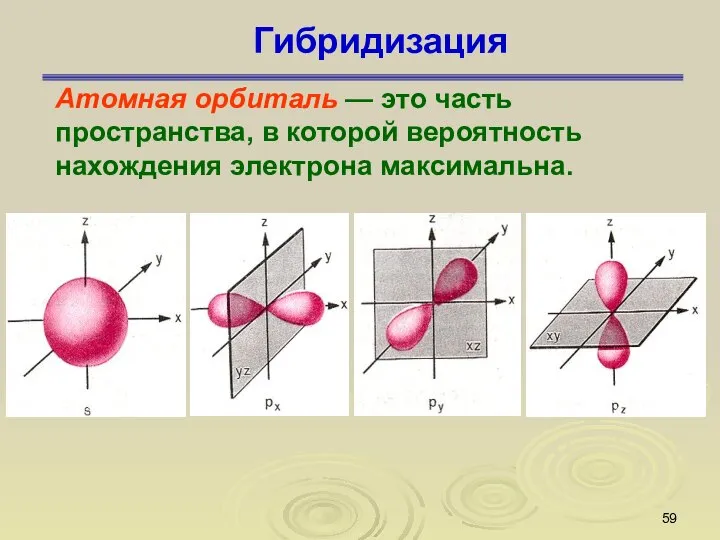
- 59. Гибридизация Атомная орбиталь — это часть пространства, в которой вероятность нахождения электрона максимальна.
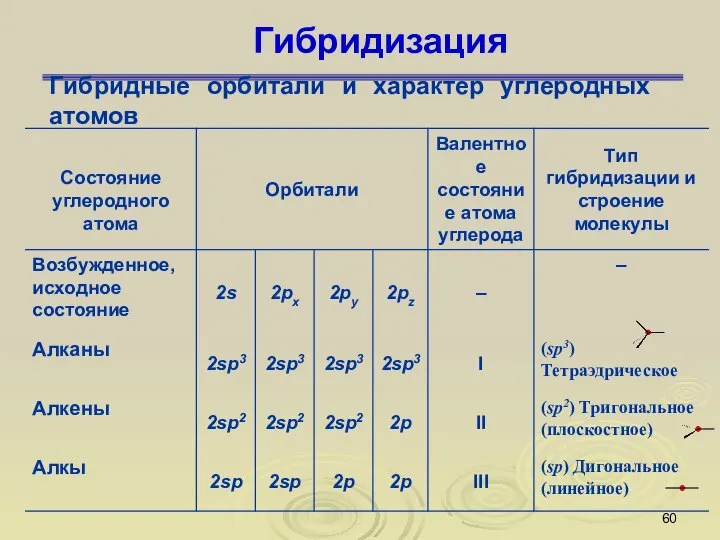
- 60. Гибридизация Гибридные орбитали и характер углеродных атомов
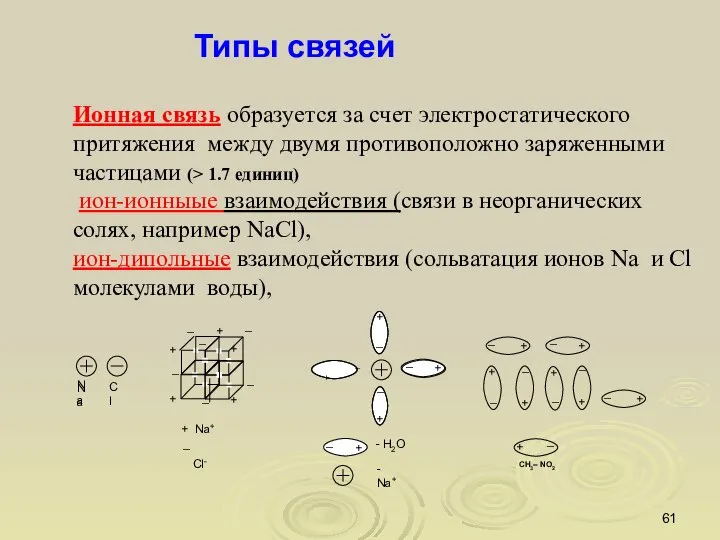
- 61. Типы связей Ионная связь образуется за счет электростатического притяжения между двумя противоположно заряженными частицами (> 1.7
- 62. Необходимое условие образования связи - наличие двух электронов (по одному от каждого атома или два от
- 63. Ковалентная связь В рамках классической теории химического строения ковалентная связь объясняется как образование электронных пар, общих
- 64. Ковалентная связь образуется за счет обобществления двумя атомами двух электронов. (И,Лэнгмюр, 1919 г.) Принцип дублета-октета: устойчивым
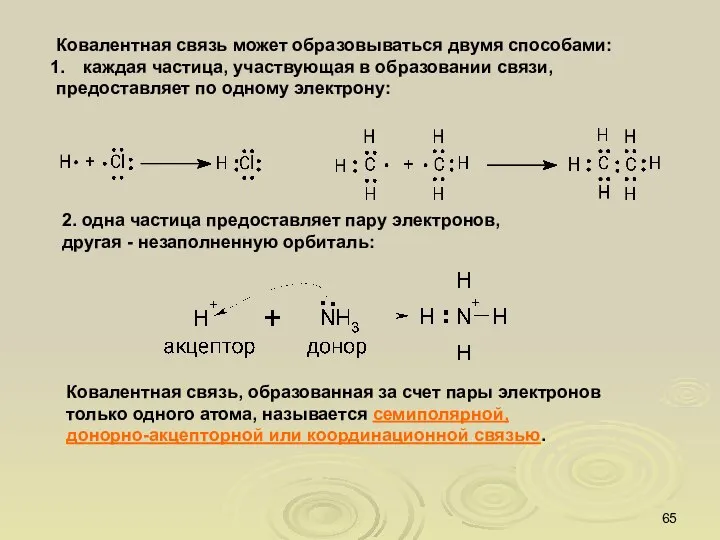
- 65. Ковалентная связь может образовываться двумя способами: каждая частица, участвующая в образовании связи, предоставляет по одному электрону:
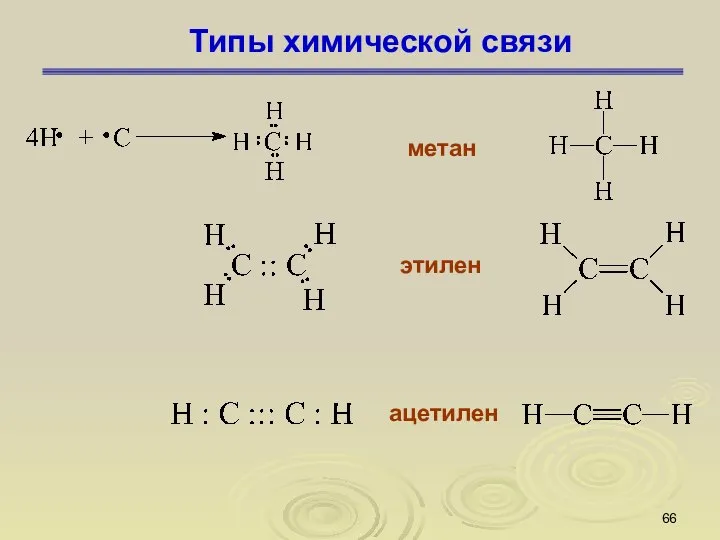
- 66. Типы химической связи метан этилен ацетилен
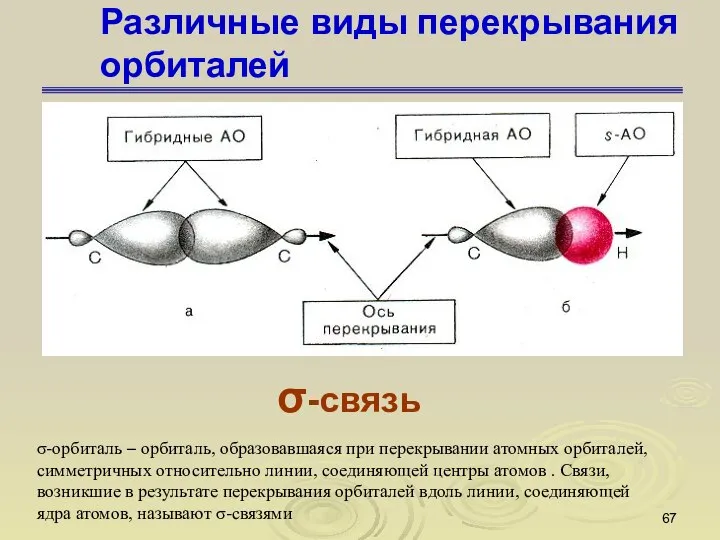
- 67. Различные виды перекрывания орбиталей σ-связь σ-орбиталь – орбиталь, образовавшаяся при перекрывании атомных орбиталей, симметричных относительно линии,
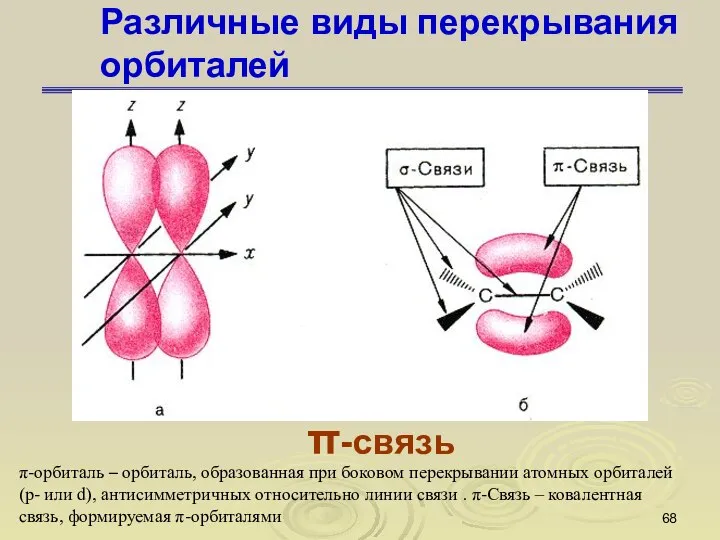
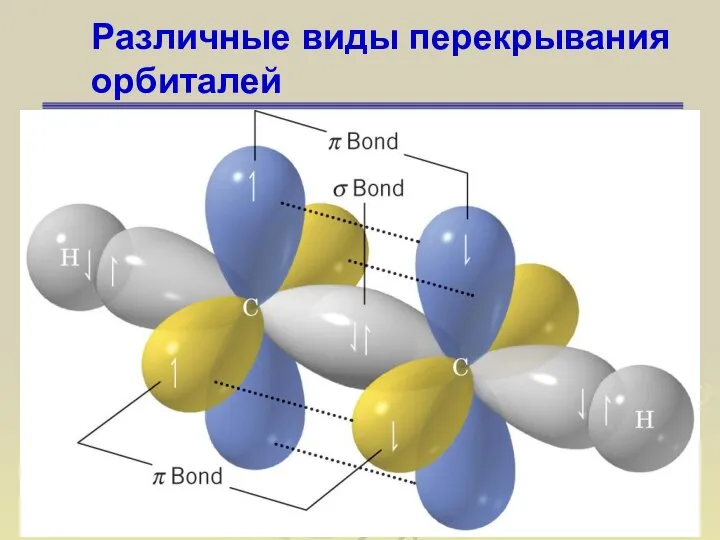
- 68. Различные виды перекрывания орбиталей π-связь π-орбиталь – орбиталь, образованная при боковом перекрывании атомных орбиталей (р- или
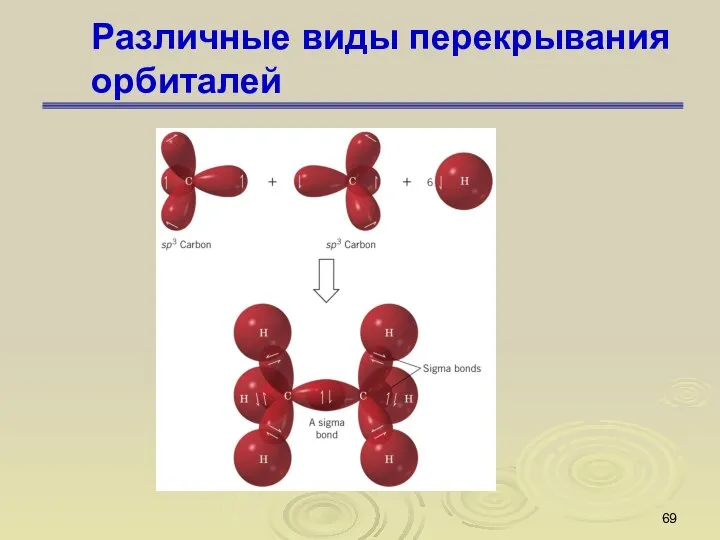
- 69. Различные виды перекрывания орбиталей
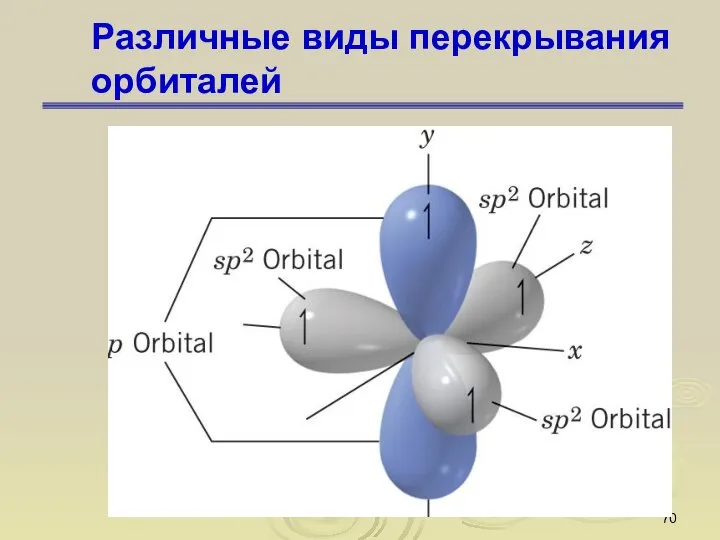
- 70. Различные виды перекрывания орбиталей
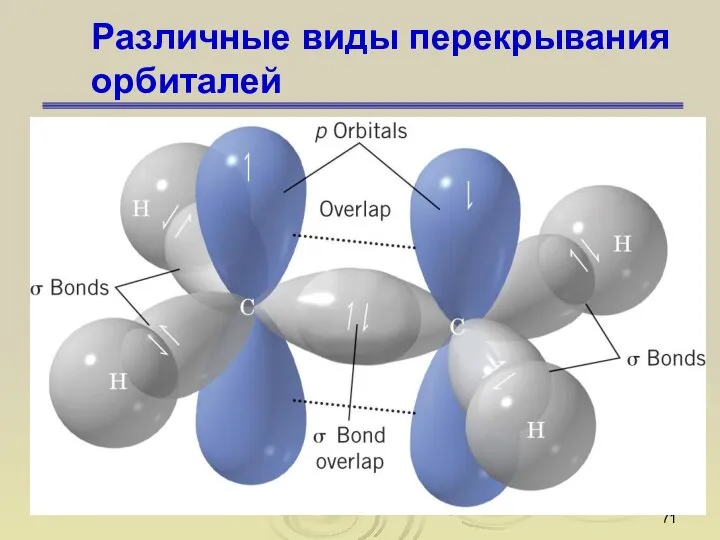
- 71. Различные виды перекрывания орбиталей
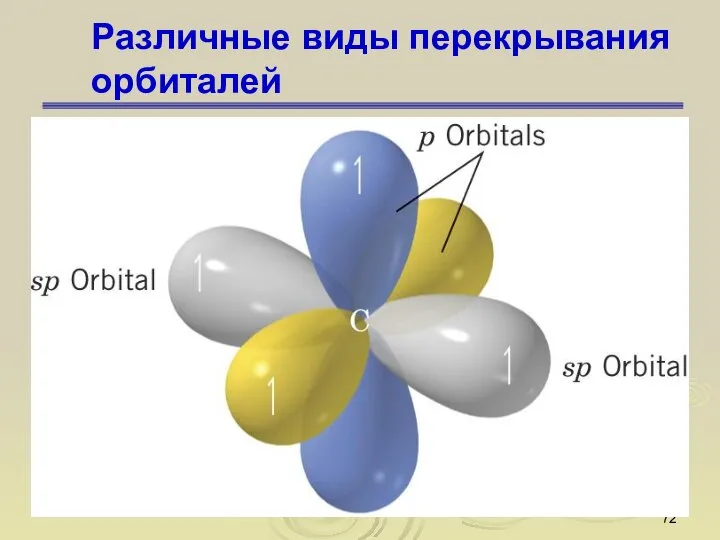
- 72. Различные виды перекрывания орбиталей
- 73. Различные виды перекрывания орбиталей
- 74. Свойства ковалентных связей Энергия (прочность) Длина Полярность Валентный угол Поляризуемость
- 75. Энергия связи – средняя энергия, которая необходима для гомолитического разрыва связи (энергия диссоциации). Гомолитический разрыв связи
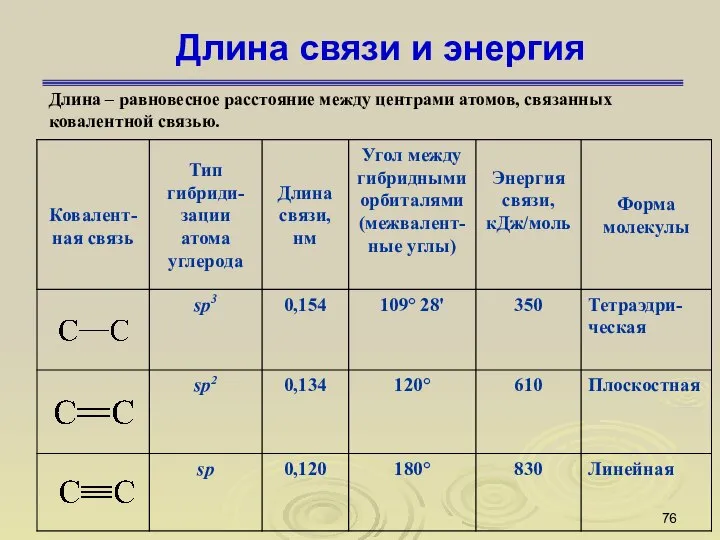
- 76. Длина связи и энергия Длина – равновесное расстояние между центрами атомов, связанных ковалентной связью.
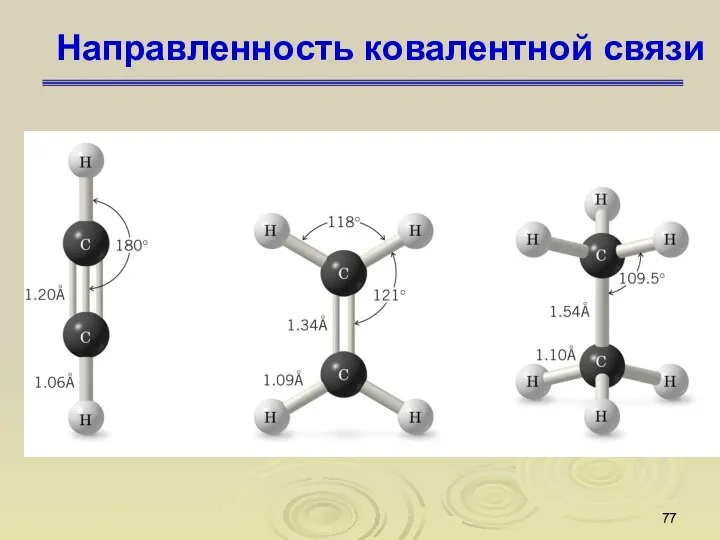
- 77. Направленность ковалентной связи
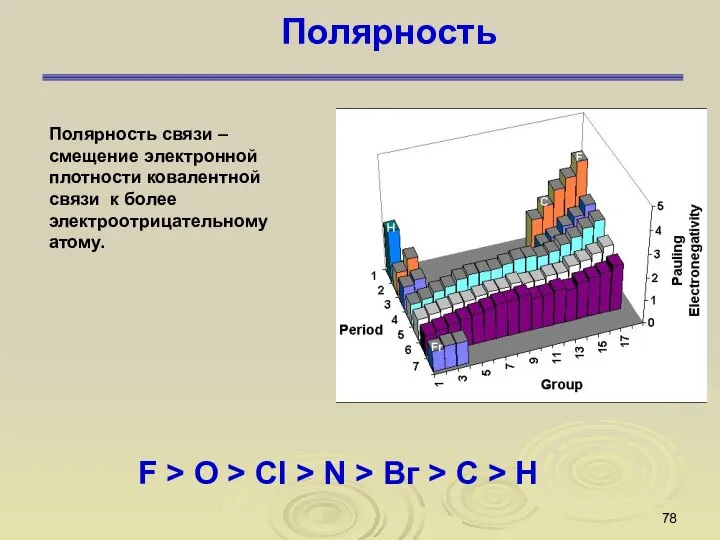
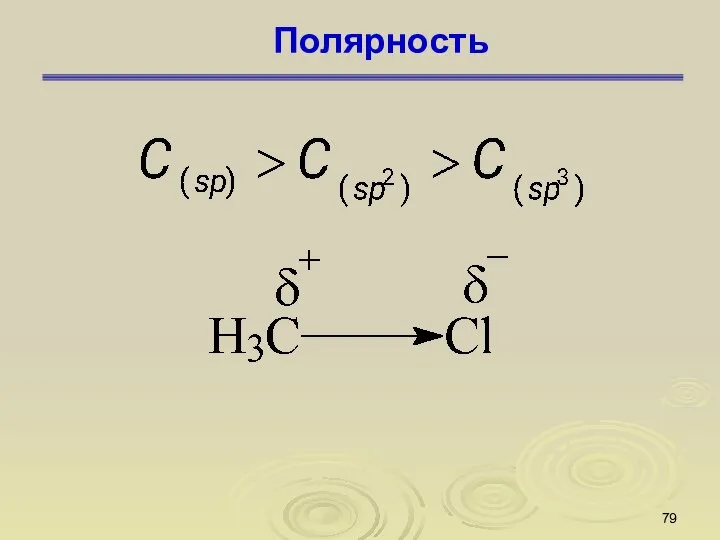
- 78. Полярность F > O > Сl > N > Вг > С > Н Полярность связи
- 79. Полярность
- 80. Поляризуемость Ковалентная связь обладает поляризуемостью — способностью изменять свою полярность, например, под влиянием внешнего воздействия. π-связи
- 81. Реакционная способность органических соединений Элементарный акт реакции это процесс, в котором происходит разрыв одной и образование
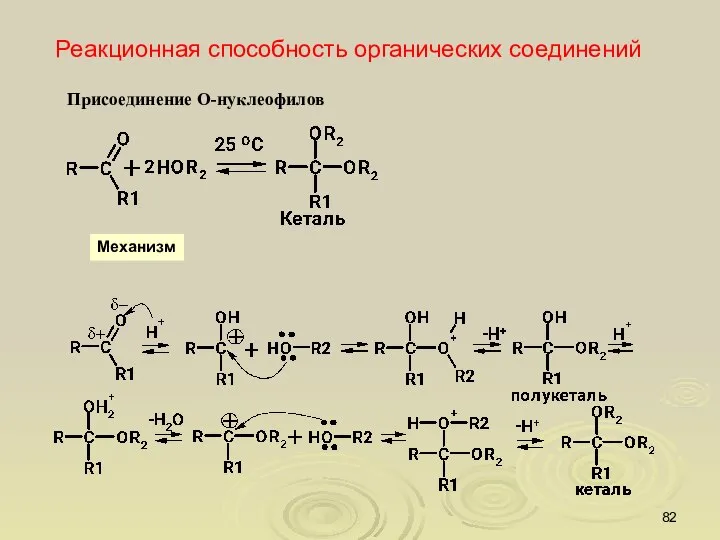
- 82. Реакционная способность органических соединений Присоединение О-нуклеофилов Механизм
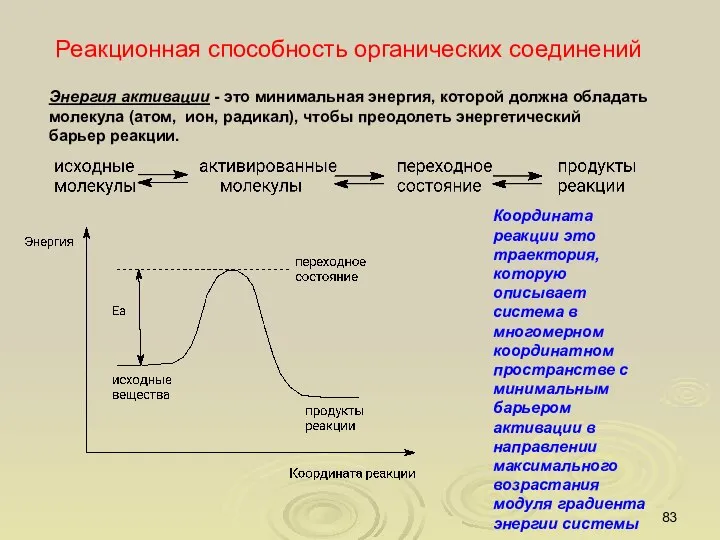
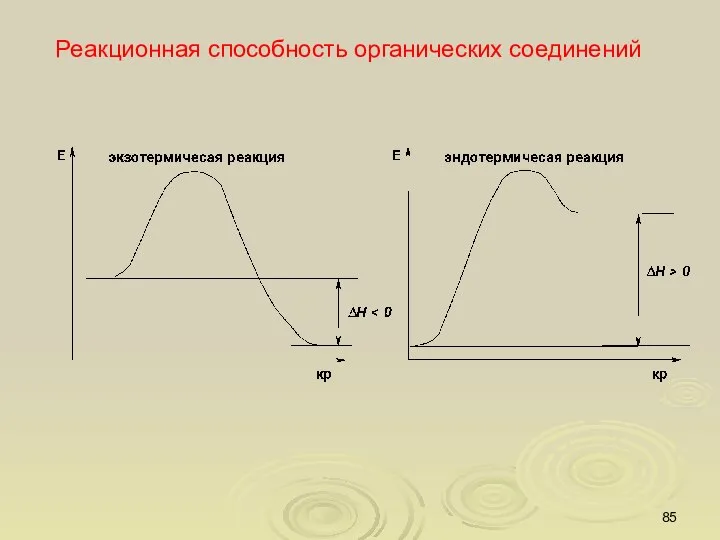
- 83. Реакционная способность органических соединений Энергия активации - это минимальная энергия, которой должна обладать молекула (атом, ион,
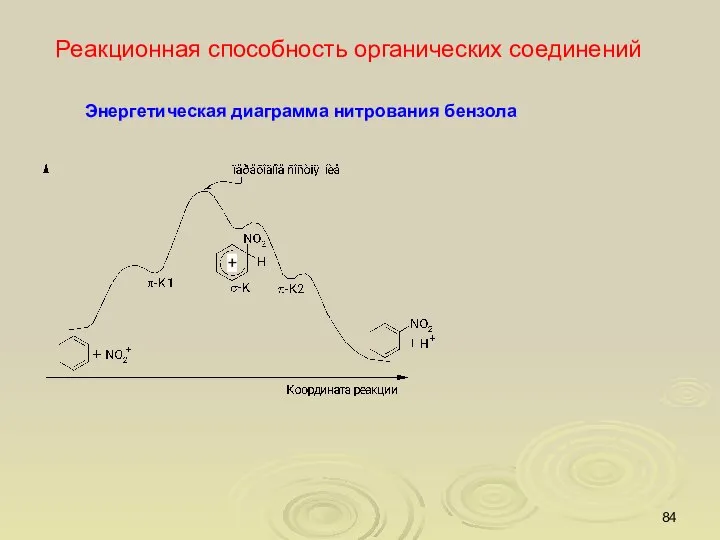
- 84. Реакционная способность органических соединений Энергетическая диаграмма нитрования бензола
- 85. Реакционная способность органических соединений
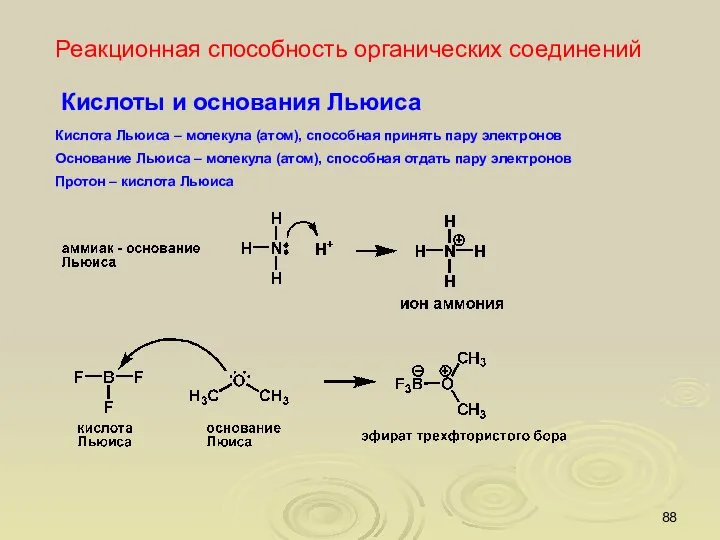
- 86. Реакционная способность органических соединений Протолитическая концепция кислот и оснований (Бренстед, Лоури,1923г.) Кислоты это соединения, способные отщеплять
- 87. Реакционная способность органических соединений Протолитическая концепция кислот и оснований (Бренстед, Лоури,1923г.) Процесс ионизации основания в растворителе
- 88. Реакционная способность органических соединений
- 89. Классификация органических реакций Субстратом называют основное органическое вещество, участвующее в реакции, реагентом – вещество, с которым
- 90. Классификация органических реакций За основу классификации принимают способ разрыва старых химических связей и образования новых. В
- 91. Классификация органических реакций I. По характеру химических превращений органические реакции делят на следующие типы: 1. Реакции
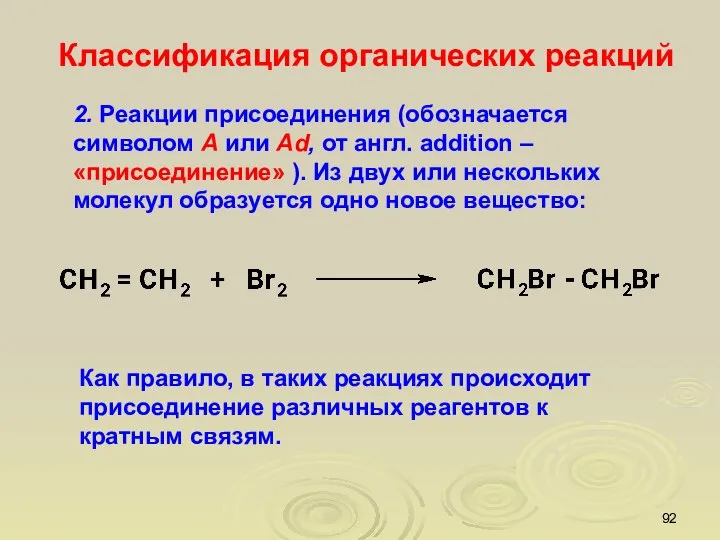
- 92. 2. Реакции присоединения (обозначается символом А или Ad, от англ. аddition – «присоединение» ). Из двух
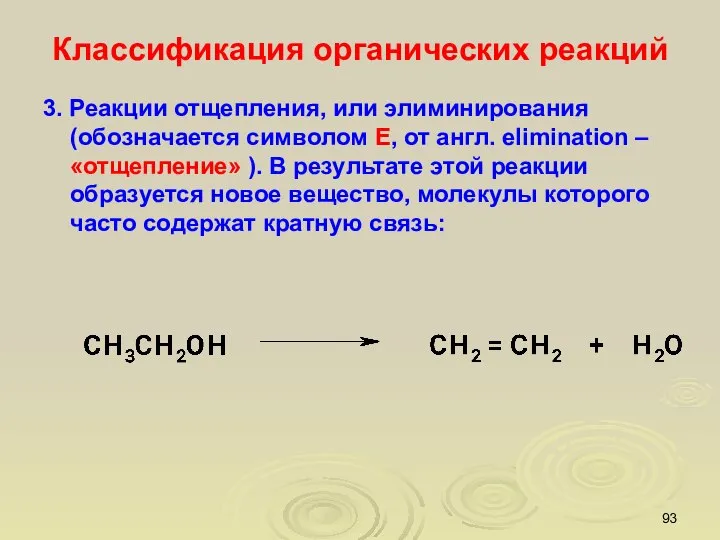
- 93. Классификация органических реакций 3. Реакции отщепления, или элиминирования (обозначается символом Е, от англ. еlimination – «отщепление»
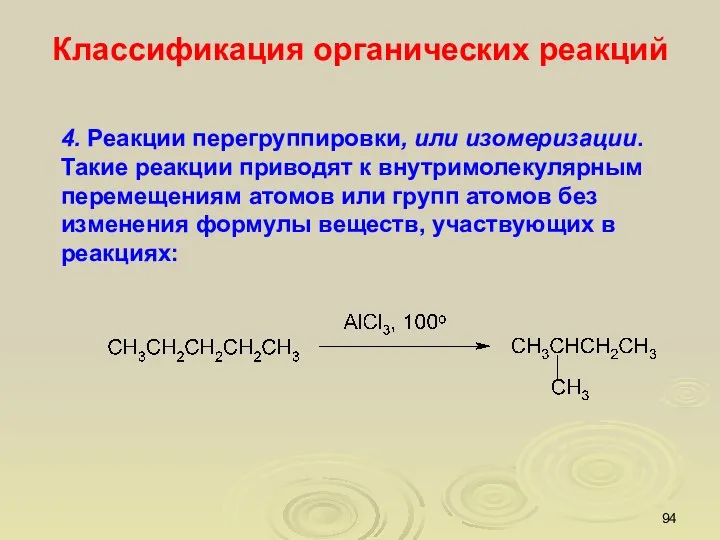
- 94. 4. Реакции перегруппировки, или изомеризации. Такие реакции приводят к внутримолекулярным перемещениям атомов или групп атомов без
- 95. 5. Реакции окисления и обратные им реакции восстановления. В результате этих реакций меняется степень окисления атома
- 96. Классификация органических реакций 1. Гомолитические, или радикальные, реакции идут с участием свободных радикалов – частиц с
- 97. Классификация органических реакций 2. Гетеролитические, или ионные, реакции идут с участием ионов, а также частиц с
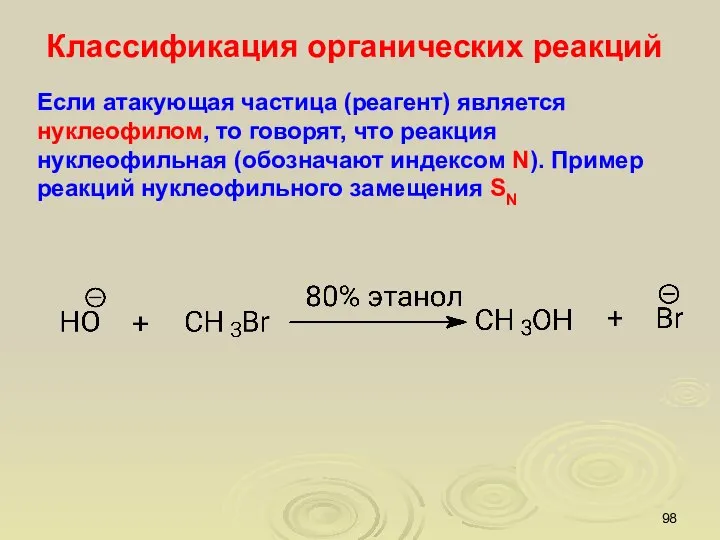
- 98. Классификация органических реакций Если атакующая частица (реагент) является нуклеофилом, то говорят, что реакция нуклеофильная (обозначают индексом
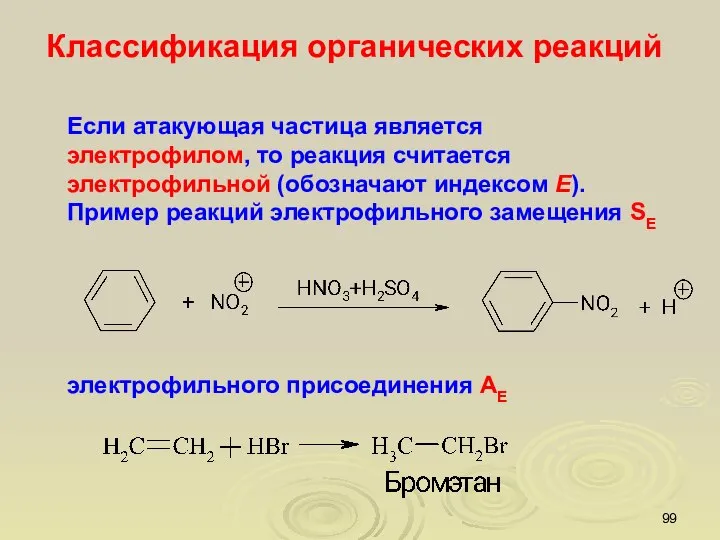
- 99. Если атакующая частица является электрофилом, то реакция считается электрофильной (обозначают индексом E). Пример реакций электрофильного замещения
- 100. Реагирующие органические частицы Нуклеофил – химическое соединение, способное быть донором электронной пары (дословно – «любящий, стремящийся
- 101. Электрофил – химическое соединение, способное принимать на себя электронные пары (дословно – «любящий, стремящийся к электрону»,
- 102. Радикал – нейтральная частица, содержащая один или несколько неспаренных электронов Реагирующие органические частицы
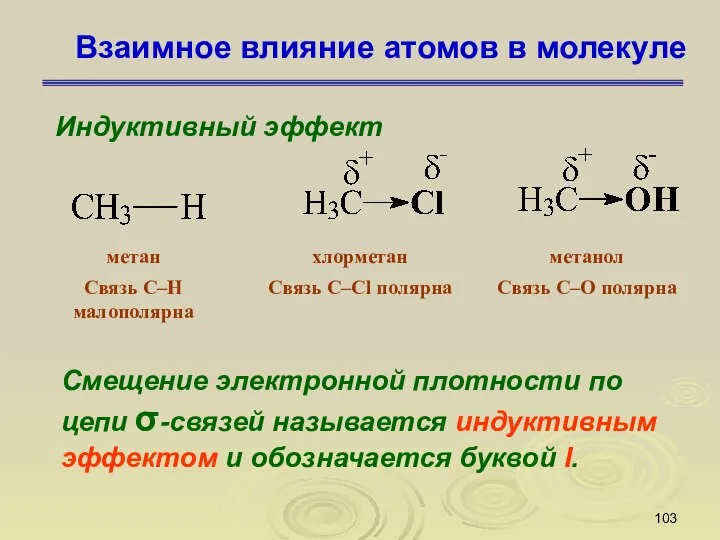
- 103. Взаимное влияние атомов в молекуле Индуктивный эффект Смещение электронной плотности по цепи σ-связей называется индуктивным эффектом
- 104. Взаимное влияние атомов в молекуле Индуктивный эффект Электроноакцепторные заместители, т.е. атом или группа атомов, смещающие электронную
- 105. Взаимное влияние атомов в молекуле Индуктивный эффект +I-Эффект проявляют алифатические углеводородные радикалы, т.е. алкильные радикалы (–CH3,
- 106. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения) Мезомерный эффект (эффект сопряжения, резонансный эффект) является
- 107. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения) Мезомерный эффект (±M) – это электронные смещения
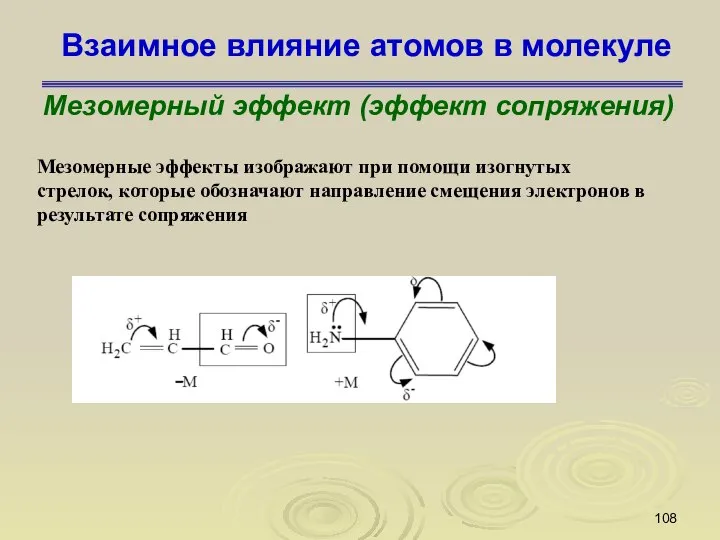
- 108. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения) Мезомерные эффекты изображают при помощи изогнутых стрелок,
- 109. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения) Вследствие сопряжения π - орбитали двойной связи
- 110. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения) Таким образом, альтернативными способами изображения мезомерного эффекта
- 111. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения) Положительным мезомерным эффектом (+ М) обладают электронодонорные
- 112. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения) Электроноакцепторные группы, поляризующие сопряженную систему в противоположном
- 113. Взаимное влияние атомов в молекуле Мезомерный эффект (эффект сопряжения) Функциональные заместители, вызывающие мезомерный эффект
- 115. Скачать презентацию



























































 Трехэлектродная лампа (триод)
Трехэлектродная лампа (триод) Художественная культура античности. Древний Рим
Художественная культура античности. Древний Рим Концепция производственной демократии
Концепция производственной демократии  Презентация "Средневековое искусство. Время соборов" - скачать презентации по МХК
Презентация "Средневековое искусство. Время соборов" - скачать презентации по МХК Кустарниковый пожар, ситуация - выживание
Кустарниковый пожар, ситуация - выживание Обработка исключений
Обработка исключений Основы проектирования схем автоматики
Основы проектирования схем автоматики УРОВНИ АЛГОРИТМОВ ЛУЧЕВОГО ИССЛЕДОВАНИЯ Уровень 1: Стандартная рентгенография УЗИ общего назначения Линейная томография
УРОВНИ АЛГОРИТМОВ ЛУЧЕВОГО ИССЛЕДОВАНИЯ Уровень 1: Стандартная рентгенография УЗИ общего назначения Линейная томография  Презентация Основные направления деятельности ФТС на 2011-2013 годы
Презентация Основные направления деятельности ФТС на 2011-2013 годы Месторождение Ахваз
Месторождение Ахваз Инновации и инновационная деятельность, как объект управления. (Тема 3, вопросы 4-10)
Инновации и инновационная деятельность, как объект управления. (Тема 3, вопросы 4-10) Харганатская средняя общеобразовательная школа Сюрреализм Выполнила: Будаева Э.А, учитель русского языка и литературы
Харганатская средняя общеобразовательная школа Сюрреализм Выполнила: Будаева Э.А, учитель русского языка и литературы  Прямая адресация памяти
Прямая адресация памяти Аудитория Уанета Январь 2011 г. gemiusAudience
Аудитория Уанета Январь 2011 г. gemiusAudience Представления о технических и программных средствах телекоммуникационных технологий. Лекция 33. Тема 5.1
Представления о технических и программных средствах телекоммуникационных технологий. Лекция 33. Тема 5.1 Структура мікропроцесорного пристрою. Архітектурні особливості мікропроцесорів. Поняття про систему команд. (Тема 4)
Структура мікропроцесорного пристрою. Архітектурні особливості мікропроцесорів. Поняття про систему команд. (Тема 4) ВИЧ – инфекция и нейросифилис
ВИЧ – инфекция и нейросифилис Студенческий хоккей в США
Студенческий хоккей в США Анималотерапия Лекарственные свойства животных «ВРАЧ ЛЕЧИТ - ПРИРОДА ИСЦЕЛЯЕТ!» Гиппократ.
Анималотерапия Лекарственные свойства животных «ВРАЧ ЛЕЧИТ - ПРИРОДА ИСЦЕЛЯЕТ!» Гиппократ. Методический семинар. Движение в радость
Методический семинар. Движение в радость Значение слова пассия
Значение слова пассия Модели деловой карьеры
Модели деловой карьеры Проектно - исследовательская работа Мой прадед Выполнила: Ученица 2а класса Школы 7 Гайдышева Екатерина Руководитель проекта: Л.В. Л
Проектно - исследовательская работа Мой прадед Выполнила: Ученица 2а класса Школы 7 Гайдышева Екатерина Руководитель проекта: Л.В. Л Семинар ГТО
Семинар ГТО Хранение информации в файлах. На примере c#
Хранение информации в файлах. На примере c# Рыхлая соединительная ткань. Соединительные ткани со специальными свойствами
Рыхлая соединительная ткань. Соединительные ткани со специальными свойствами Как будет проходить обучение
Как будет проходить обучение Иосиф Бродский
Иосиф Бродский