Содержание
- 2. Ортомиксовирусы Ортомиксовирусы (Orthomyxoviridae) – семейство РНК-содержащих вирусов. Диам. вирусных частиц 80—120 нм. Нуклеокапсид спиральный, заключён в
- 3. Вирусы гриппа Вирусы гриппа человека включены в состав родов Influenzavims А, В и Influenzavims С семейства
- 4. Вирусы гриппа Грипп [от фр. gripper, хватать], или инфлюэнца [от итал. influenza di freddo, влияние холода],
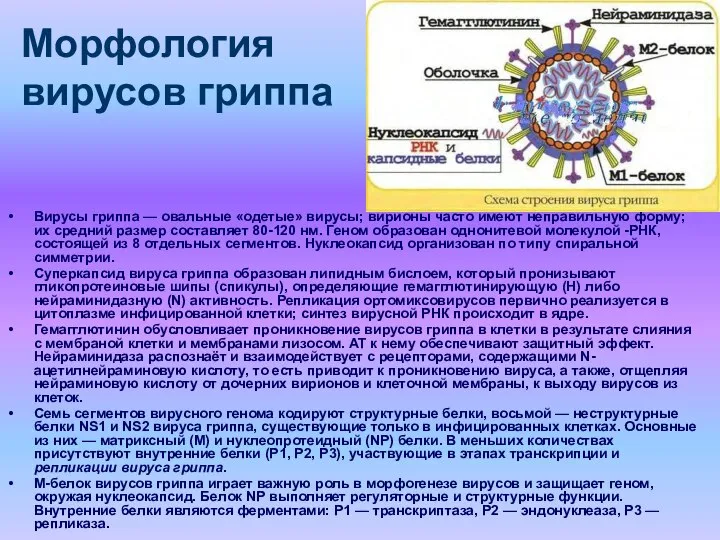
- 5. Морфология вирусов гриппа Вирусы гриппа — овальные «одетые» вирусы; вирионы часто имеют неправильную форму; их средний
- 6. Антигенная структура вируса гриппа Типовые антигены вирусов гриппа типа А — гемагглютинин и нейраминидаза; на сочетании
- 7. Изменения антигенной структуры вируса гриппа могут происходить двумя путями: Антигенный шифт вируса гриппа. Вызывает появление нового
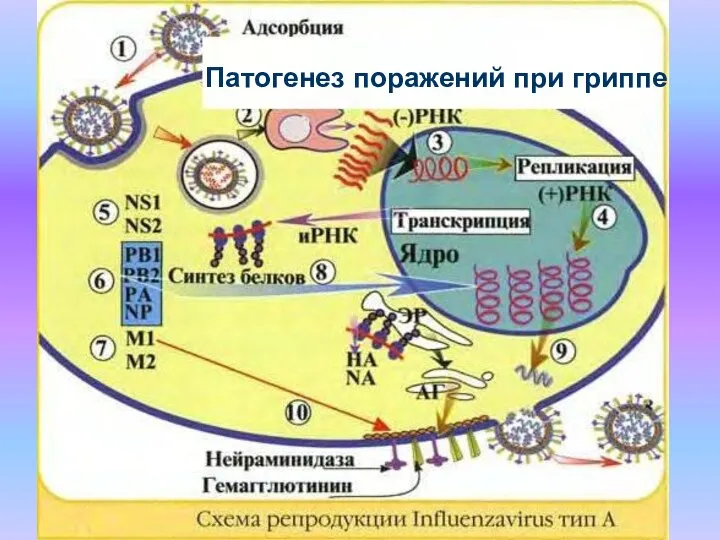
- 8. Патогенез поражений при гриппе
- 9. Патогенез поражений при гриппе Первоначально вирус гриппа размножается в эпителии верхних отделов дыхательных путей, вызывая гибель
- 10. Клинические проявления гриппа Продолжительность инкубационного периода гриппа составляет 1-3 дня, после чего наступает продромальный период, проявляющийся
- 11. Диагностика гриппа Материалы для исследования при гриппе — смывы и мазки из носоглотки, мазки-отпечатки из носовой
- 13. Лечение гриппа Препараты выбора при лечении гриппа —- амантадин или ремантадин, ИФН и его индукторы, противогриппозный
- 14. Профилактика гриппа Разработаны методы активной и пассивной иммунопрофилактики гриппа. Для пассивной иммунизации применяют противогриппозный иммуноглобулин человека,
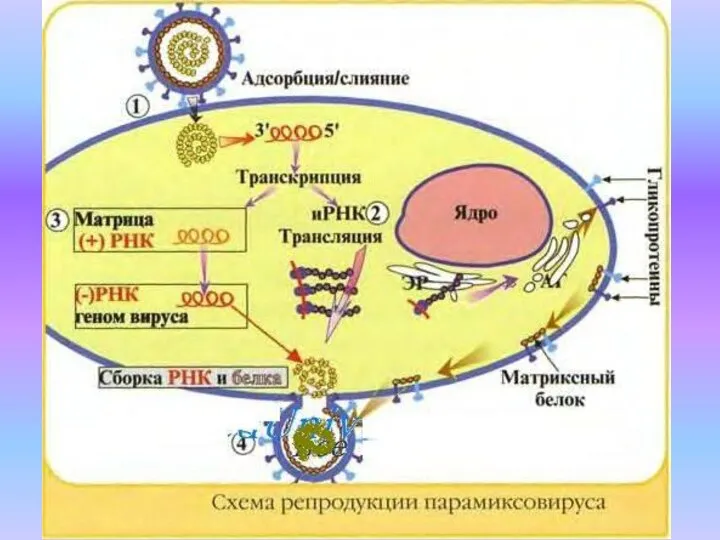
- 15. Парамиксовирусы Все четыре рода семейства Paramyxoviridae включают возбудителей инфекций у человека: род Paramyxovirus— вирусы парагриппа 1-го
- 17. Вирус кори Корь (лат. morbilli) — острое вирусное заболевание преимущественно детского возраста, характеризующееся общей интоксикацией, повышением
- 18. Вирус кори Лабораторные животные к вирусу кори маловосприимчивы. Только у обезьян вирус вызывает болезнь с характерными
- 19. Резистентность Вирус нестоек, быстро инактивируется в кислой среде, снижает свою активность при температуре 37 "С, при
- 20. Патогенез Источником инфекции является только больной человек. Он становится заразным с последнего дня инкубационного периода и
- 21. Патогенез Наиболее частое осложнение — пневмония, а в раннем периоде заболевания — отек гортани, круп. Очень
- 22. Иммунитет Постинфекционный иммунитет прочный, пожизненный, обусловлен вируснейтрализующими антителами, Т-цитотоксическими лимфоцитами и клетками иммунной памяти.
- 23. Микробиологическая диагностика Предложена тест-система для идентификации генома вируса кори на основе однопробирочного варианта реакции обратной транскрипции
- 24. Лечение Специфическое лечение отсутствует, поэтому проводится симптоматическая терапия. Больного необходимо изолировать от окружающих (в особенности от
- 25. Специфическая профилактика кори Исследования по разработке противокоревой вакцины начались в 1954, когда вирус кори (штамм Edmonston)
- 26. Подострый склерозирующий панэнцефалит Вирус кори вызывает не только острую продуктивную инфекцию, каковой является корь, но и,
- 27. Подострый склерозирующий панэнцефалит Болезнь развивается в тех случаях, когда вирус кори заносится в клетки ЦНС. Размножение
- 28. Подострый склерозирующий панэнцефалит Лечение. К патогенетическим методам терапии относится применение глюкокортикоидов, однако довольно часто это лечение
- 29. Вирус эпидемического паротита Эпидемический паротит, или «свинка», — острая инфекция с преимущественным поражением околоушных слюнных желёз,
- 30. Вирус эпидемического паротита Основной резервуар вируса эпидемического паротита — больной человек, также известны случаи заболевания собак,
- 31. Антигены возбудителя эпидемического паротита Иммуногенные свойства эпидемического паротита проявляют белок NP (цитоплазматический S-Ar) и поверхностные NH-
- 32. Патогенез поражений Первоначально возбудитель эпидемического паротита размножается в эпителии носоглотки, затем проникает в кровоток и в
- 33. Клинические проявления эпидемического паротита Инкубационный период эпидемического паротита составляет 14-21 сут; типичная форма заболевания проявляется как
- 34. Диагностика эпидемического паротита Применяют вирусологические и серологические методы диагностики эпидемического паротита. Материалы для исследований эпидемического паротита
- 35. Лечение и профилактика эпидемического паротита Средства специфической химиотерапии эпидемического паротита отсутствуют. Симптоматическое лечение эпидемического паротита оказывает
- 36. Список литературы Коротяев А.И., Бабичев С.А. Медицинская микробиология, иммунология и вирусология. Санкт-Петербург. 2008. Медицинская микробиология, вирусология
- 38. Скачать презентацию


![Вирусы гриппа Грипп [от фр. gripper, хватать], или инфлюэнца [от итал.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1303057/slide-3.jpg)





























 Что такое мехатроника
Что такое мехатроника Персона-модель №1
Персона-модель №1 Культура. Основные понятия курса
Культура. Основные понятия курса Systems-Architecture-Von Neuman alu
Systems-Architecture-Von Neuman alu лекция 8 МЕТАМОРФИЗМ
лекция 8 МЕТАМОРФИЗМ Методика составления и проведения самостоятельных занятий физическими упражнениями гигиенической и тренировочной направленнос
Методика составления и проведения самостоятельных занятий физическими упражнениями гигиенической и тренировочной направленнос Монтаж кабельных линий
Монтаж кабельных линий FERRY LINE IZMAYL - TULCEA ODESSA REGIONAL STATE ADMINISTRATION. - презентация
FERRY LINE IZMAYL - TULCEA ODESSA REGIONAL STATE ADMINISTRATION. - презентация Лыжная подготовка
Лыжная подготовка Народні символи України
Народні символи України Презентация по отечественной истории на тему: «Каспийский поход Петра I» Выполнила сту
Презентация по отечественной истории на тему: «Каспийский поход Петра I» Выполнила сту Заключение эксперта
Заключение эксперта Готов ли ребёнок к школе? Рекомендуемый тест
Готов ли ребёнок к школе? Рекомендуемый тест HTML құжатында кестелерді қалыптастыру. Кесте параметрлерін тағайындау тегтері
HTML құжатында кестелерді қалыптастыру. Кесте параметрлерін тағайындау тегтері Презентация Принципы Э.Деминга в таможенных органах
Презентация Принципы Э.Деминга в таможенных органах Тема 2.Собственность и предпринимательство
Тема 2.Собственность и предпринимательство  «О государственно–частном партнерстве в системе дошкольного воспитания и образования» Леонид Ким, генеральный директор дош
«О государственно–частном партнерстве в системе дошкольного воспитания и образования» Леонид Ким, генеральный директор дош Спортивная тренировка - цель, задачи, средства, общие и специальные принципы
Спортивная тренировка - цель, задачи, средства, общие и специальные принципы Оздоровительный бег
Оздоровительный бег Climax (gradation)
Climax (gradation) Мультфильмы в жизни школьников - презентация для начальной школы_
Мультфильмы в жизни школьников - презентация для начальной школы_ Конструктивные решения производственных зданий. Основные конструктивные элементы производственных зданий. Фонари
Конструктивные решения производственных зданий. Основные конструктивные элементы производственных зданий. Фонари План: 1. Проблема сознания в философии. 2. Сущность и происхождение сознания. 3. Теория отражения. 4. Структура сознания: а)
План: 1. Проблема сознания в философии. 2. Сущность и происхождение сознания. 3. Теория отражения. 4. Структура сознания: а)  Суддівство в картате ВКФ, та українське суддівство
Суддівство в картате ВКФ, та українське суддівство SMM, основы продвижения в соцсетях
SMM, основы продвижения в соцсетях Кроссворд по экономическому потенциалу таможенной территории России Выполнила студентка первого курса Группы Т-116 Хропина Ольг
Кроссворд по экономическому потенциалу таможенной территории России Выполнила студентка первого курса Группы Т-116 Хропина Ольг #Lviv – це #Twitter. Не вірите? Ось докази.)))
#Lviv – це #Twitter. Не вірите? Ось докази.))) Понятие художественной культуры
Понятие художественной культуры