Содержание
- 2. Основы физики атома Модель атома Томсона Опыты Резерфорда. Ядерная модель атома Линейчатые спектры атомов. Формула Бальмера.
- 3. Сэр Джозеф Джон Томсон (1856 —1940) — английский физик, открывший электрон, лауреат Нобелевской премии по физике
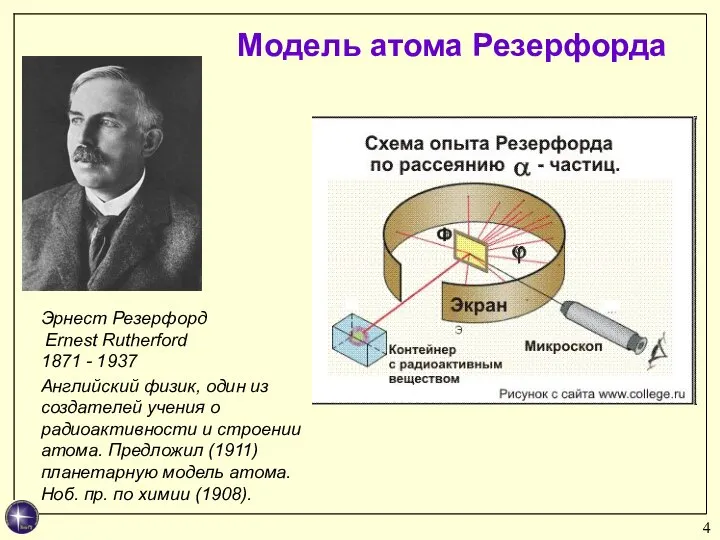
- 4. Модель атома Резерфорда Эрнест Резерфорд Ernest Rutherford 1871 - 1937 Английский физик, один из создателей учения
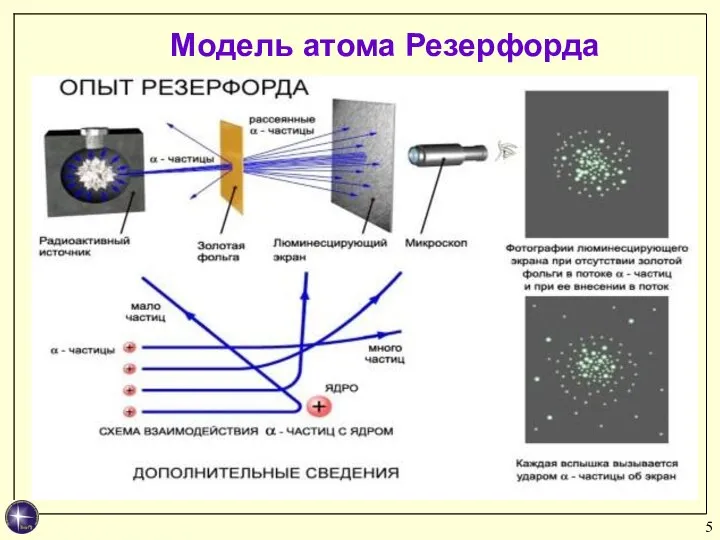
- 5. Модель атома Резерфорда
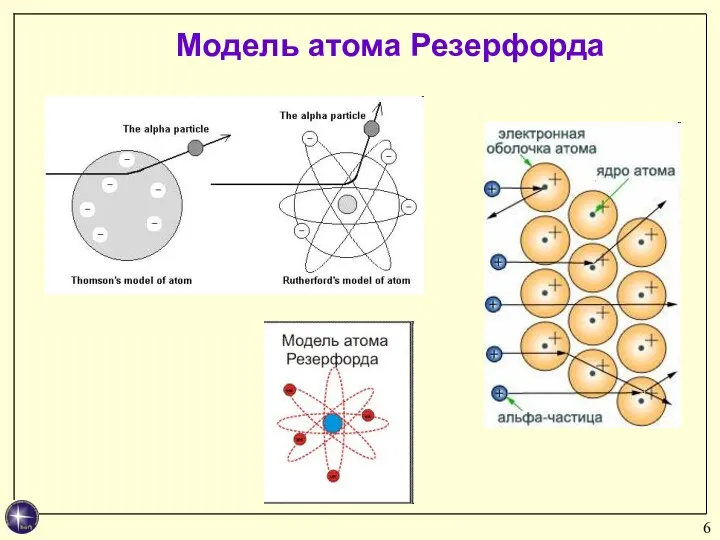
- 6. Модель атома Резерфорда
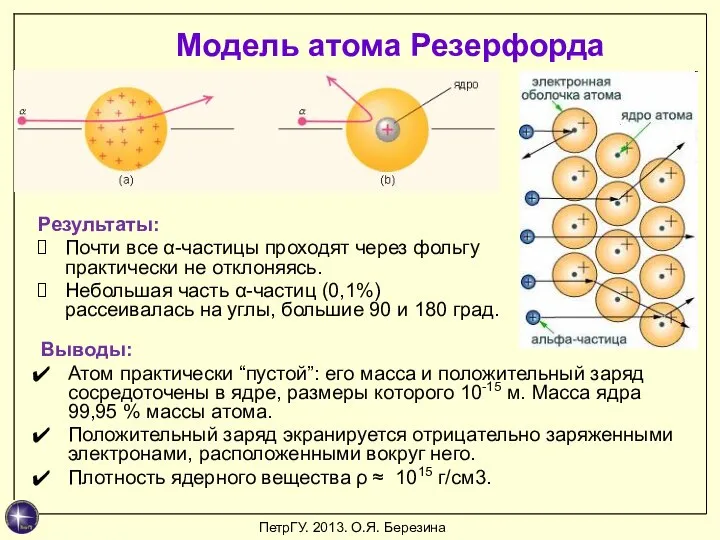
- 7. Выводы: Атом практически “пустой”: его масса и положительный заряд сосредоточены в ядре, размеры которого 10-15 м.
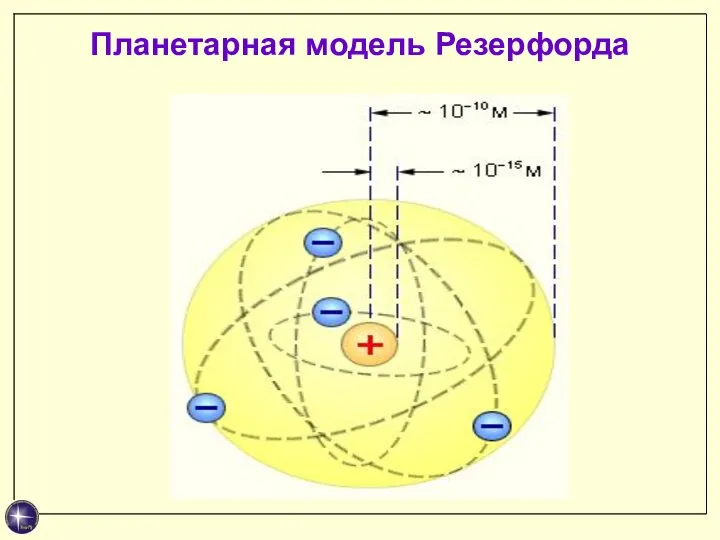
- 8. Планетарная модель Резерфорда
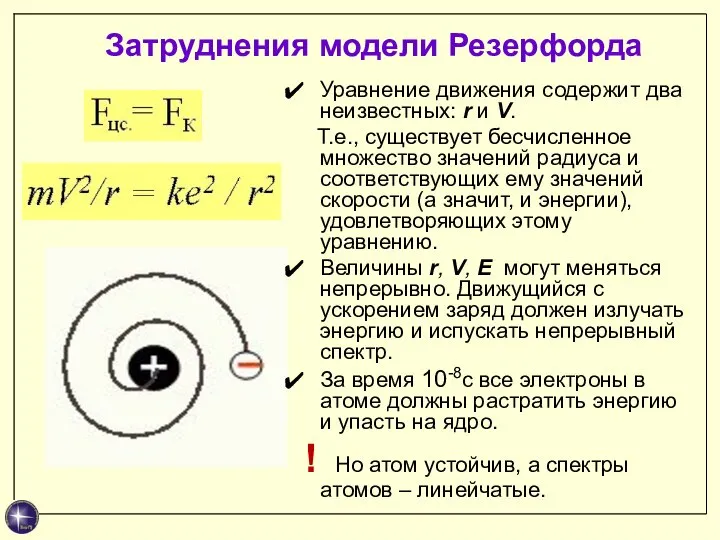
- 9. Затруднения модели Резерфорда Уравнение движения содержит два неизвестных: r и V. Т.е., существует бесчисленное множество значений
- 10. Линейчатые спектры атомов. Формула Бальмера частот спектральных линий: Длинноволновая граница серии: n = m+1 Коротковолновая граница
- 11. R = 3,29·1015 Гц – постоянная Ридберга. Для ультрафиолетовой серии (серия Лаймана) m = 1, n
- 12. Комбинационный принцип Ритца Согласно экспериментальным данным, полученным к концу XIX века, частоты спектральных линий данного атома
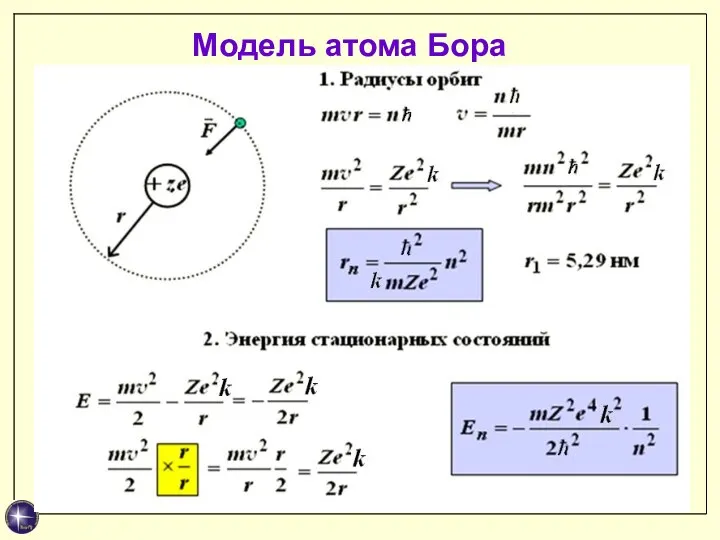
- 13. Модель атома Бора. 1913 г. Нильс Бор (1885-1962) — датский физик, один из создателей современной физики.
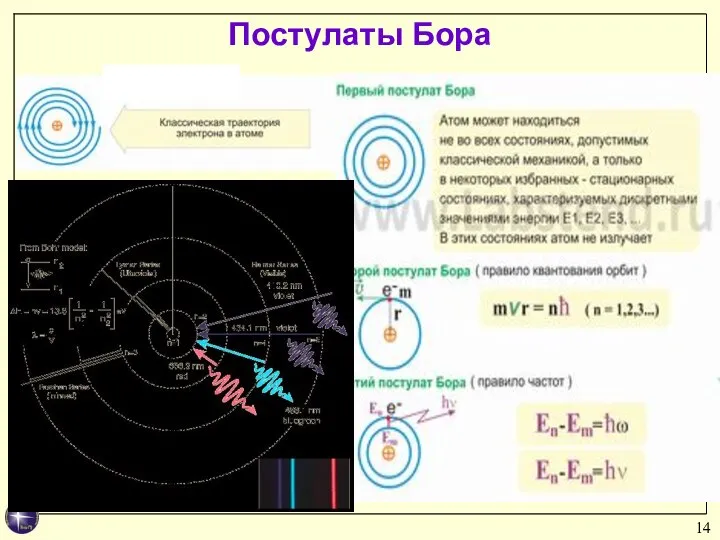
- 14. Постулаты Бора
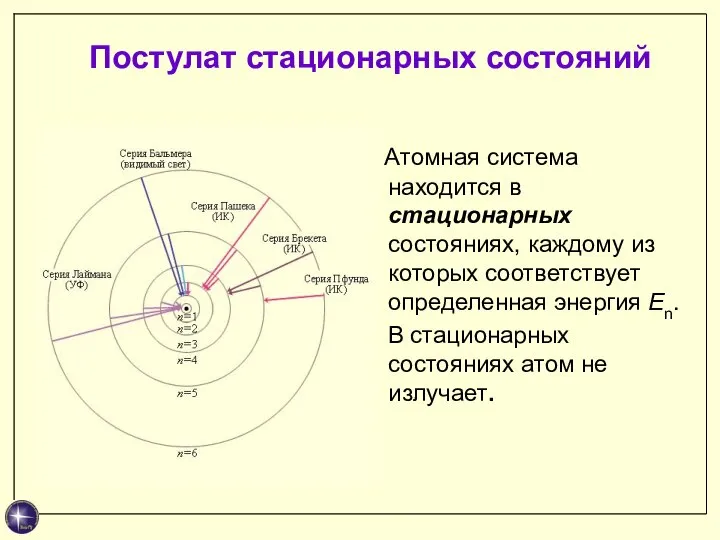
- 15. Постулат стационарных состояний Атомная система находится в стационарных состояниях, каждому из которых соответствует определенная энергия En.
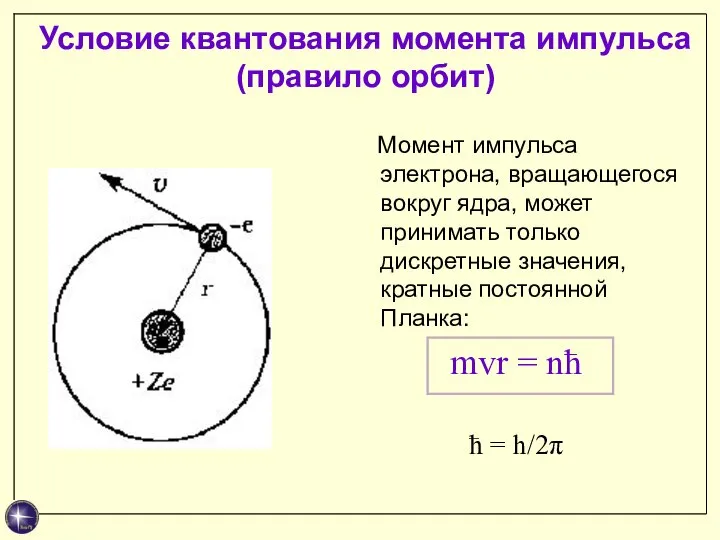
- 16. Условие квантования момента импульса (правило орбит) Момент импульса электрона, вращающегося вокруг ядра, может принимать только дискретные
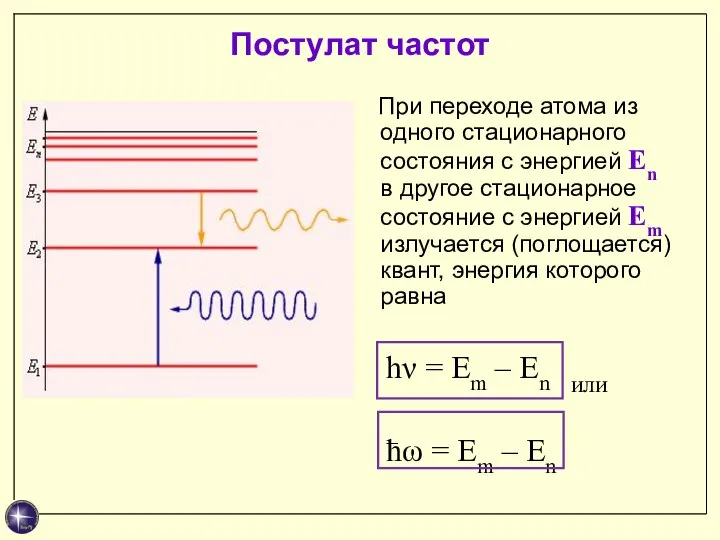
- 17. Постулат частот При переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние
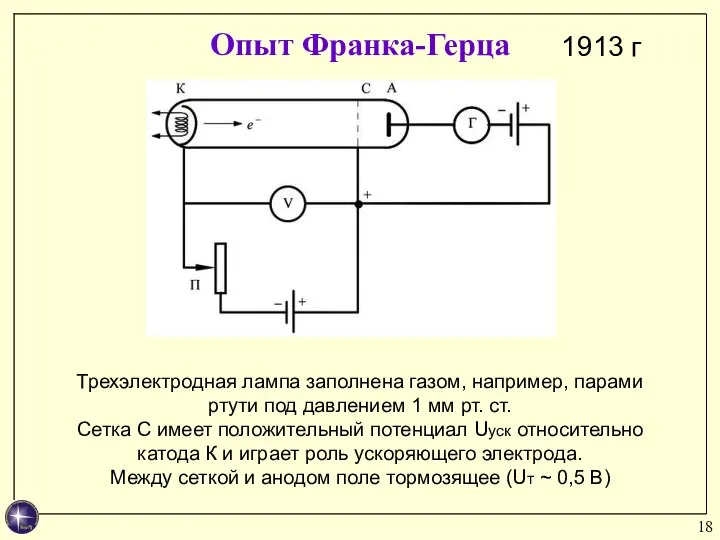
- 18. Опыт Франка-Герца 1913 г Трехэлектродная лампа заполнена газом, например, парами ртути под давлением 1 мм рт.
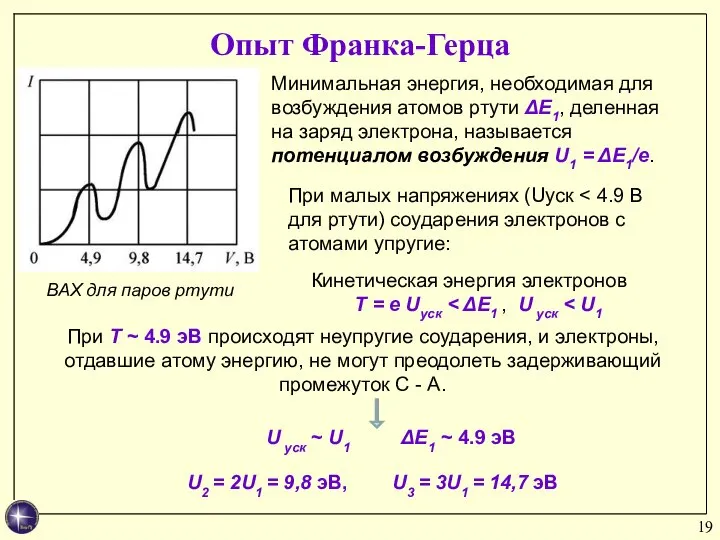
- 19. Опыт Франка-Герца При T ~ 4.9 эВ происходят неупругие соударения, и электроны, отдавшие атому энергию, не
- 20. Опыт Франка-Герца Лампа испускает ультрафиолетовый свет. Излучение начинается, как только разность потенциалов между катодом и сеткой
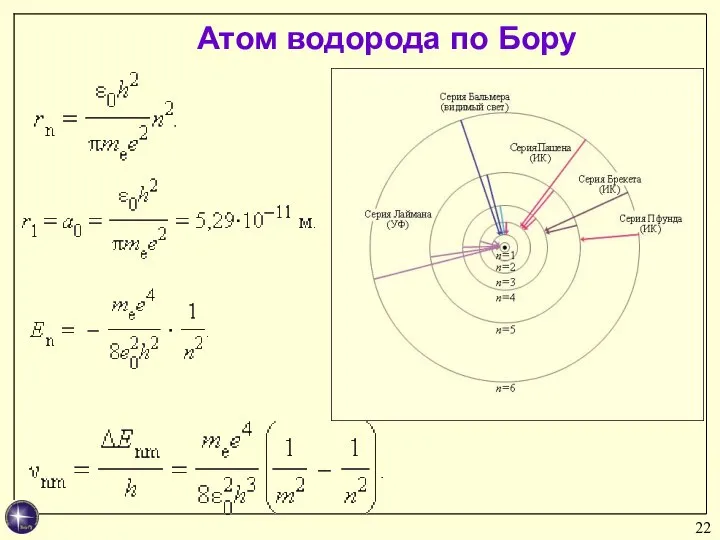
- 21. Модель атома Бора
- 22. Атом водорода по Бору
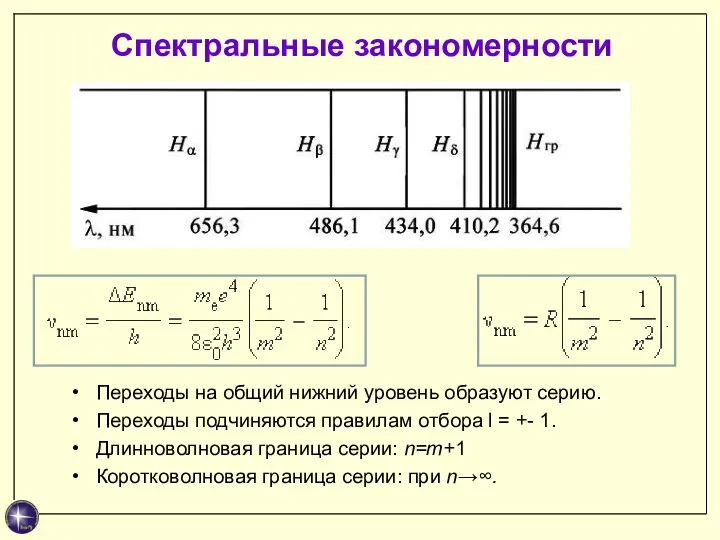
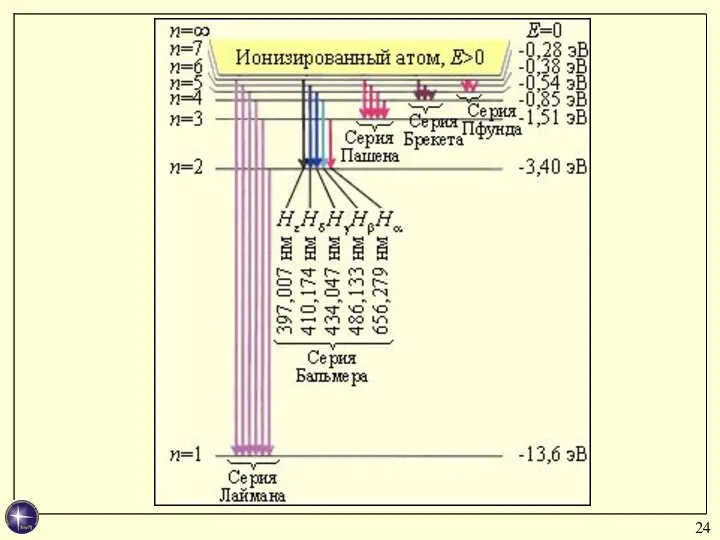
- 23. Спектральные закономерности Переходы на общий нижний уровень образуют серию. Переходы подчиняются правилам отбора l = +-
- 25. Выводы В связанных состояниях скорость вращения, радиус орбиты и энергия электрона принимают дискретный ряд значений и
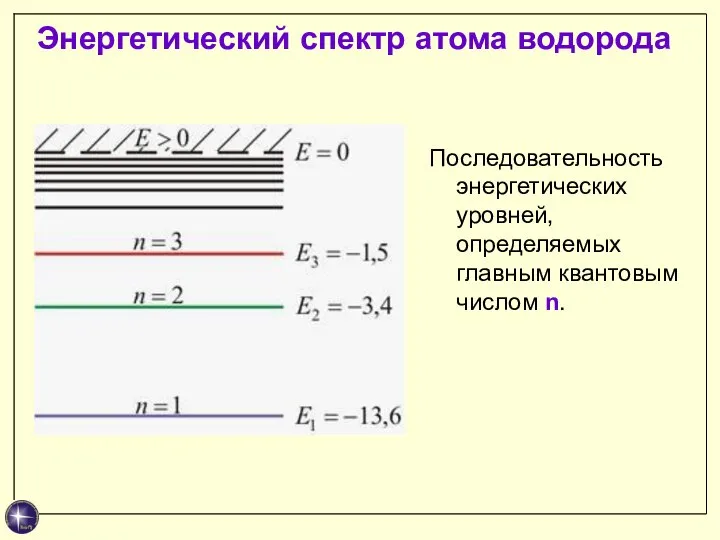
- 26. Энергетический спектр атома водорода Последовательность энергетических уровней, определяемых главным квантовым числом n.
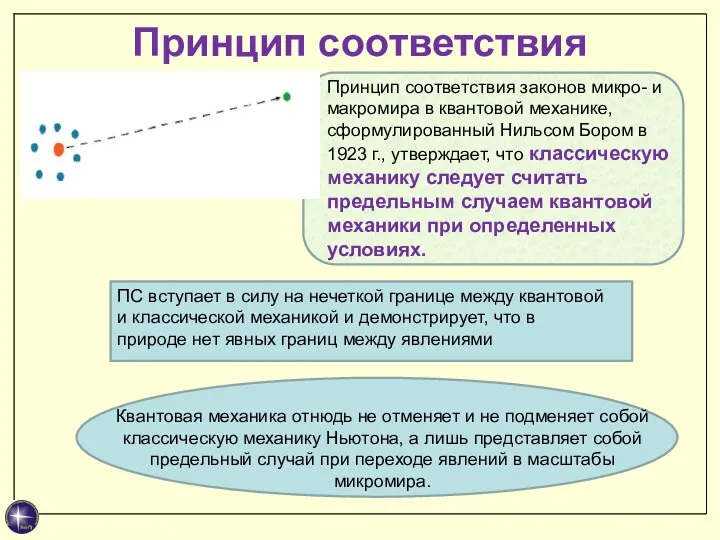
- 27. Принцип соответствия Принцип соответствия законов микро- и макромира в квантовой механике, сформулированный Нильсом Бором в 1923
- 28. Состояния атома, в котором один из электронов находится на высоком энергетическом уровне, называют высоковозбуждёнными, или ридберговскими.
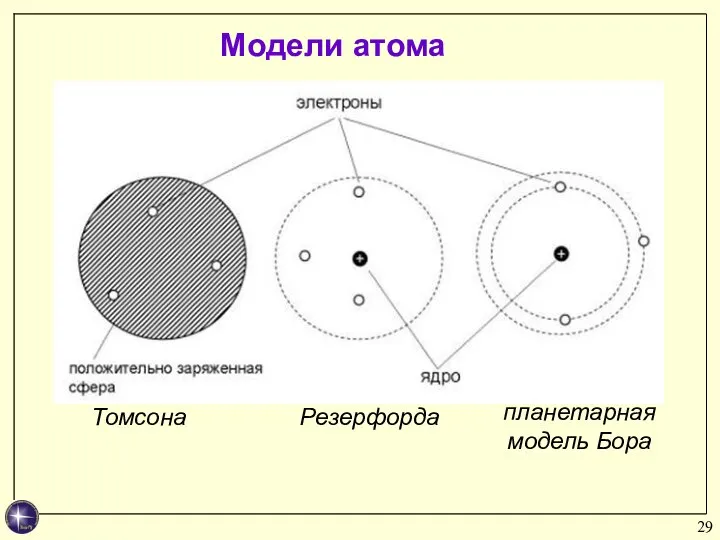
- 29. планетарная модель Бора Модели атома Томсона Резерфорда
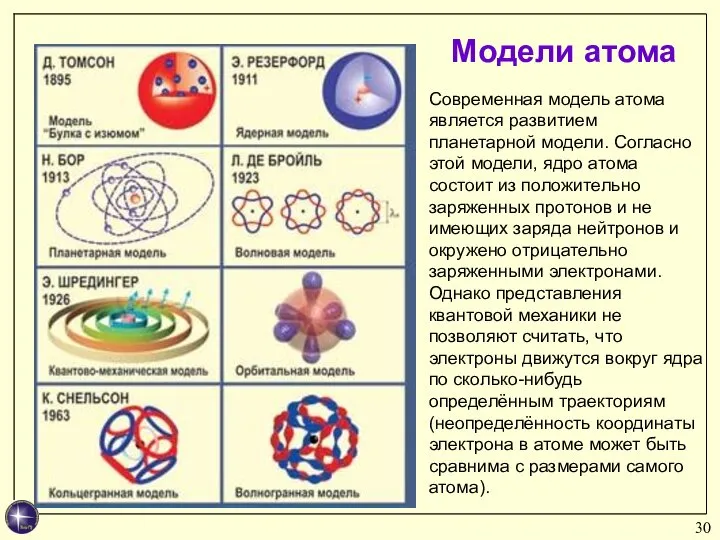
- 30. Модели атома Современная модель атома является развитием планетарной модели. Согласно этой модели, ядро атома состоит из
- 31. Выводы Теория Бора имеет историческое значение: пользуется классическими представлениями, но основывается на квантовых постулатах. Она показала
- 32. Квантово-механическое описание атомов Стационарное уравнение Шредингера для атома водорода Волновые функции и квантовые числа Эффект Зеемана
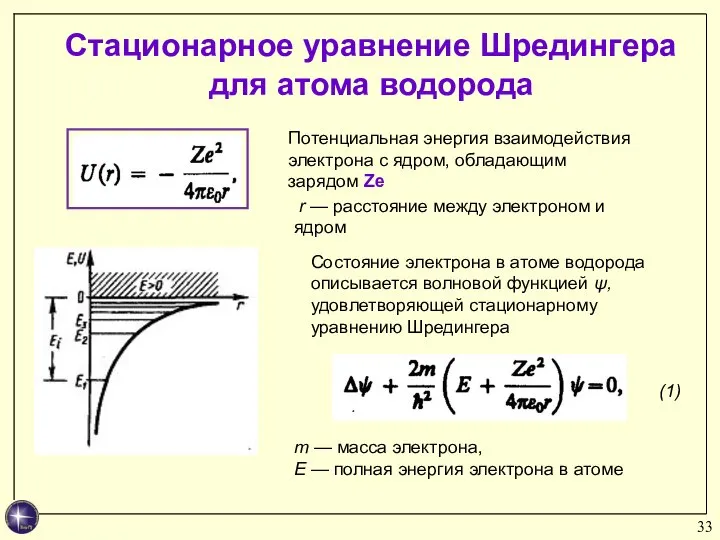
- 33. Стационарное уравнение Шредингера для атома водорода Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Ze r
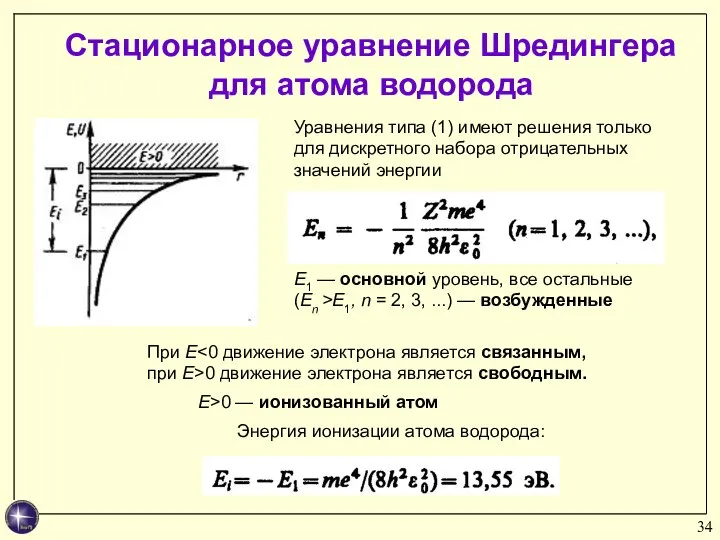
- 34. Стационарное уравнение Шредингера для атома водорода Энергия ионизации атома водорода: Уравнения типа (1) имеют решения только
- 35. Волновые функции и квантовые числа удовлетворяют собственные функции ψnlm(r, θ, φ), определяемые тремя квантовыми числами: главным
- 36. Волновые функции и квантовые числа Орбитальное квантовое число l определяет момент импульса (механический орбитальный момент) электрона
- 37. Волновые функции и квантовые числа Магнитное квантовое число ml определяет проекцию момента импульса электрона на заданное
- 38. Эффект Зеемана Расщепление уровней энергии во внешнем электрическом поле, тоже доказанное экспериментально, называется эффектом Штарка. Обнаружено
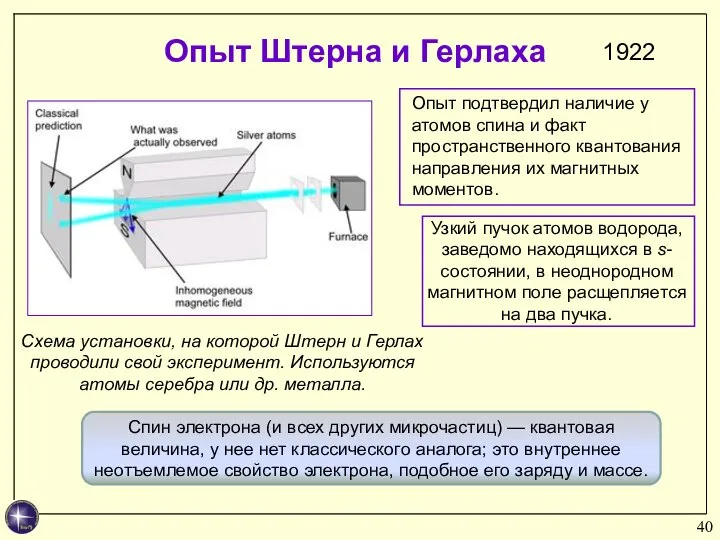
- 39. Квантовые числа Спиновое квантовое число s описывает собственный угловой момент электрона, который называется спином. Спин электрона
- 40. Схема установки, на которой Штерн и Герлах проводили свой эксперимент. Используются атомы серебра или др. металла.
- 41. Выводы Состояние электрона в атоме однозначно определяется набором четырех квантовых чисел: Принцип Паули: в одном и
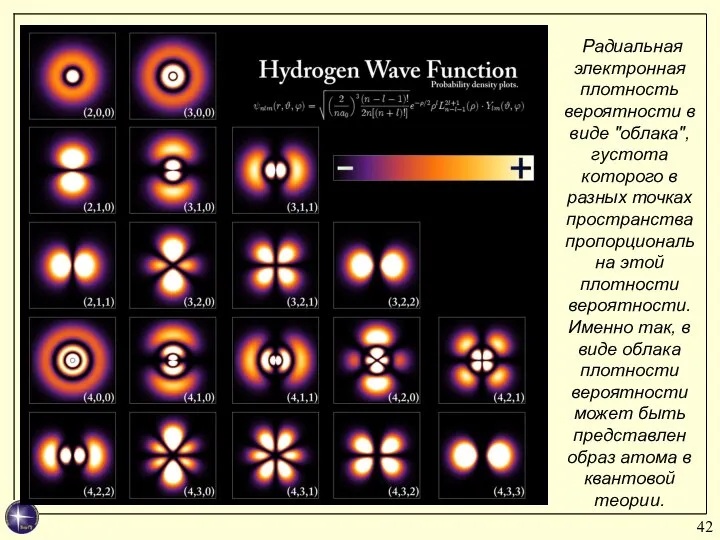
- 42. Радиальная электронная плотность вероятности в виде "облака", густота которого в разных точках пространства пропорциональна этой плотности
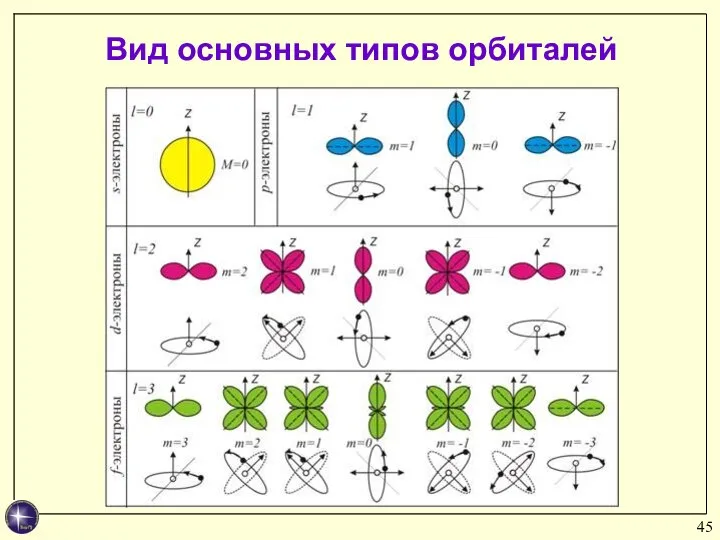
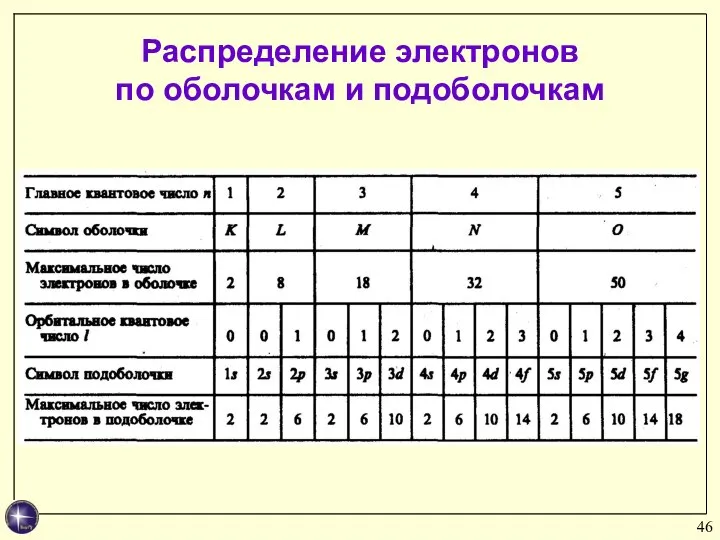
- 43. Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число n, называется электронной
- 44. Состояние электрона, характеризующееся квантовыми числами l = 0, называют s-состоянием (электрон в этом состоянии называют s-электроном),
- 45. Вид основных типов орбиталей
- 46. Распределение электронов по оболочкам и подоболочкам
- 48. Физический смысл порядкового номера Z элемента периодической системы Менделеева был выяснен в ядерной модели атома Резерфорда.
- 49. Объяснение строения периодической системы элементов, теоретическое истолкование периодической системы Менделеева было дано в квантовой теории Бором
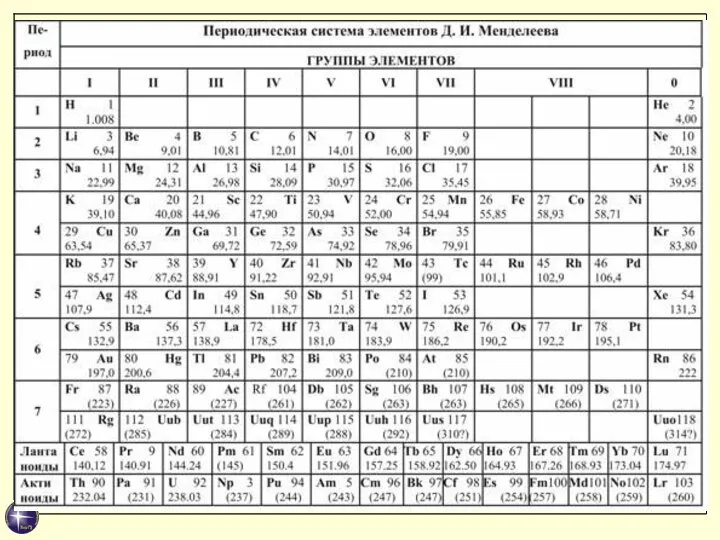
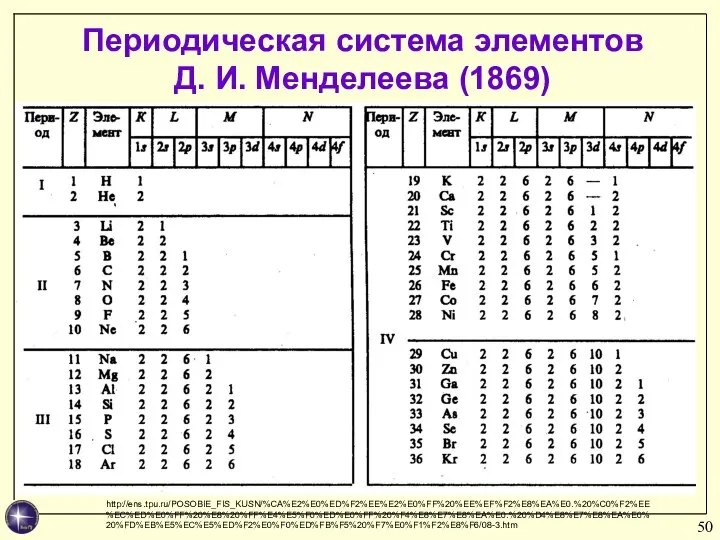
- 50. Периодическая система элементов Д. И. Менделеева (1869) http://ens.tpu.ru/POSOBIE_FIS_KUSN/%CA%E2%E0%ED%F2%EE%E2%E0%FF%20%EE%EF%F2%E8%EA%E0.%20%C0%F2%EE%EC%ED%E0%FF%20%E8%20%FF%E4%E5%F0%ED%E0%FF%20%F4%E8%E7%E8%EA%E0.%20%D4%E8%E7%E8%EA%E0%20%FD%EB%E5%EC%E5%ED%F2%E0%F0%ED%FB%F5%20%F7%E0%F1%F2%E8%F6/08-3.htm
- 51. Правила отбора ограничивают число возможных переходов электронов в атоме, связанных с испусканием и поглощением света. 1)
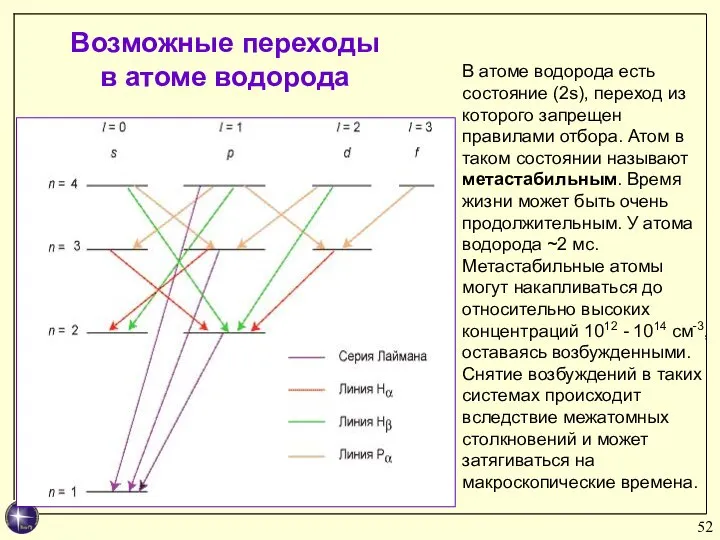
- 52. В атоме водорода есть состояние (2s), переход из которого запрещен правилами отбора. Атом в таком состоянии
- 54. Скачать презентацию






















 Обзор пройденного. Классификация зданий
Обзор пройденного. Классификация зданий Риккетсии и эрлихии
Риккетсии и эрлихии  Рациональное питание
Рациональное питание  Презентация "Рыцарство и его культура" - скачать презентации по МХК
Презентация "Рыцарство и его культура" - скачать презентации по МХК Архитектура Intel Core
Архитектура Intel Core Лекция 18 Проектирование геологического изучения недр
Лекция 18 Проектирование геологического изучения недр Нормативно- правовые документы по биологической безопасности ГМП Терешкова М. ДС5 ФТД5
Нормативно- правовые документы по биологической безопасности ГМП Терешкова М. ДС5 ФТД5 Устройства вывода информации
Устройства вывода информации Загребельна Т.Д.
Загребельна Т.Д.  Центр развития дизайна Карелии
Центр развития дизайна Карелии Презентация "Отечественная война 1812 года в полотнах художников" - скачать презентации по МХК
Презентация "Отечественная война 1812 года в полотнах художников" - скачать презентации по МХК Старт партнерки
Старт партнерки Техническое обслуживание электрооборудования машины вакуумно-формовочной универсал 1М
Техническое обслуживание электрооборудования машины вакуумно-формовочной универсал 1М Фитодизайн по-домашнему (1 класс) - презентация для начальной школы_
Фитодизайн по-домашнему (1 класс) - презентация для начальной школы_ Речевое общение
Речевое общение Наурыз. Спортшыдан үлкен ептілікті, күштілікті, төзімділік пен батылдықты талап ететін ұлттық спорттың бір түрі
Наурыз. Спортшыдан үлкен ептілікті, күштілікті, төзімділік пен батылдықты талап ететін ұлттық спорттың бір түрі Горячие точки мира
Горячие точки мира Город Городок, улица Воровского, 6. Замечания по магазину
Город Городок, улица Воровского, 6. Замечания по магазину 0a7f3921766b4d7ba01f612432d2dbc1
0a7f3921766b4d7ba01f612432d2dbc1 ПРЕЗЕНТАЦИЯ НА ТЕМУ: «СИСТЕМА ВЫСШЕГО ОБРАЗОВАНИЯ ВЕЛИКОБРИТАНИИ».
ПРЕЗЕНТАЦИЯ НА ТЕМУ: «СИСТЕМА ВЫСШЕГО ОБРАЗОВАНИЯ ВЕЛИКОБРИТАНИИ». Маршрут проектирования цифровых ИМС
Маршрут проектирования цифровых ИМС Конструктивные разновидности и системы балок
Конструктивные разновидности и системы балок Презентация "Художественная культура Древней Передней Азии (Месопотамии)" - скачать презентации по МХК
Презентация "Художественная культура Древней Передней Азии (Месопотамии)" - скачать презентации по МХК Політика як соціальне явище. (Тема 5)
Політика як соціальне явище. (Тема 5) Изобразительное искусство – средство познания себя и мира Картавцева О.Д.- к.п.н., доцент кафедры изобразительного искусства
Изобразительное искусство – средство познания себя и мира Картавцева О.Д.- к.п.н., доцент кафедры изобразительного искусства Презентация на тему "Цвет и цветомедитация" - скачать презентации по Педагогике
Презентация на тему "Цвет и цветомедитация" - скачать презентации по Педагогике الدليل المختصر فى سيرة خير البشر
الدليل المختصر فى سيرة خير البشر принятие решения .грегори мэнкью
принятие решения .грегори мэнкью