Содержание
- 2. ПОТЕНЦИОМЕТРИЯ − … … физико-химический метод анализа, позволяющий определить активности (а) ионов на основе измерения Е
- 3. ЭЛЕКТРОДЫ ОПРЕДЕЛЕНИЯ − … … электроды, потенциалы которых зависят от концентрации анализируемых ионов и практически не
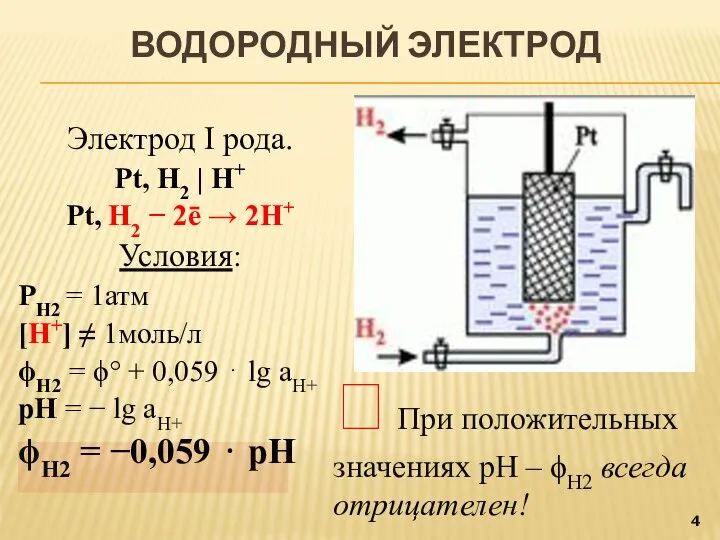
- 4. Электрод I рода. Pt, H2 | H+ Pt, H2 − 2ē → 2H+ Условия: РН2 =
- 5. Фриц Габер (1868-1934) СТЕКЛЯННЫЙ ЭЛЕКТРОД
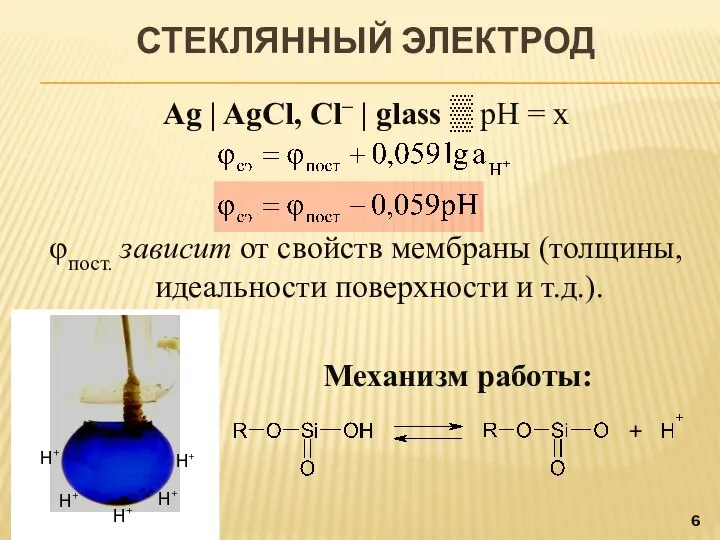
- 6. СТЕКЛЯННЫЙ ЭЛЕКТРОД Ag | AgCl, Cl‒ | glass ▒ pH = x φпост. зависит от свойств
- 7. ЭЛЕКТРОХИМИЧЕСКИЕ ЦЕПИ ДЛЯ ИЗМЕРЕНИЯ РН 1. Водородно ‒ водородная (газовая) цепь: Pt, H2 | H+ ||
- 8. 2. Водородно ‒ хлорсеребряная цепь: Pt, H2 | H+ || Cl ‒, AgCl | Ag Электрод
- 9. 3. Водородно ‒ каломельная цепь: Pt, H2 | H+ || Сl‒, Hg2Cl2 | Hg Электрод Электрод
- 10. 4. Цепь из стеклянного и хлорсеребряного электрода: Ag | AgCl, Cl‒ ¦ pH=x | Cl‒, AgCl
- 12. Скачать презентацию







 Специфика технологии как товара
Специфика технологии как товара Стратегические направления Стратегическое видение Миссия SWOT - анализ
Стратегические направления Стратегическое видение Миссия SWOT - анализ  Поэзия С.А. Клычкова
Поэзия С.А. Клычкова РЕФЕРАТ НА ТЕМУ: «Московский метрополитен как памятник архитектуры » . Группа РГ-08-6
РЕФЕРАТ НА ТЕМУ: «Московский метрополитен как памятник архитектуры » . Группа РГ-08-6 Контрабанда в Дальневосточном таможенном управлении
Контрабанда в Дальневосточном таможенном управлении Александр Сергеевич Пушкин (1799 - 1837)
Александр Сергеевич Пушкин (1799 - 1837) РАЗВИТИЕ ПОЗНАВАТЕЛЬНЫХ ПРОЦЕССОВ И ИГРОВОЙ ДЕЯТЕЛЬНОСТИ В ДОШКОЛЬНОМ ВОЗРАСТЕ
РАЗВИТИЕ ПОЗНАВАТЕЛЬНЫХ ПРОЦЕССОВ И ИГРОВОЙ ДЕЯТЕЛЬНОСТИ В ДОШКОЛЬНОМ ВОЗРАСТЕ Макияж тигра - презентация для начальной школы_
Макияж тигра - презентация для начальной школы_ Что такое йога
Что такое йога Презентация____
Презентация____ Рождество Христово
Рождество Христово Устойчивость оболочек
Устойчивость оболочек Проблемы материи в истории философии
Проблемы материи в истории философии Презентация "Инвестиционный банк – посредник между эмитентом и рынком" - скачать презентации по Экономике
Презентация "Инвестиционный банк – посредник между эмитентом и рынком" - скачать презентации по Экономике История
История ДИФФЕРЕНЦИАЦИЯ ПРОЦЕССА ОБУЧЕНИЯ (ПОНЯТИЯ И СУЩНОСТЬ)
ДИФФЕРЕНЦИАЦИЯ ПРОЦЕССА ОБУЧЕНИЯ (ПОНЯТИЯ И СУЩНОСТЬ)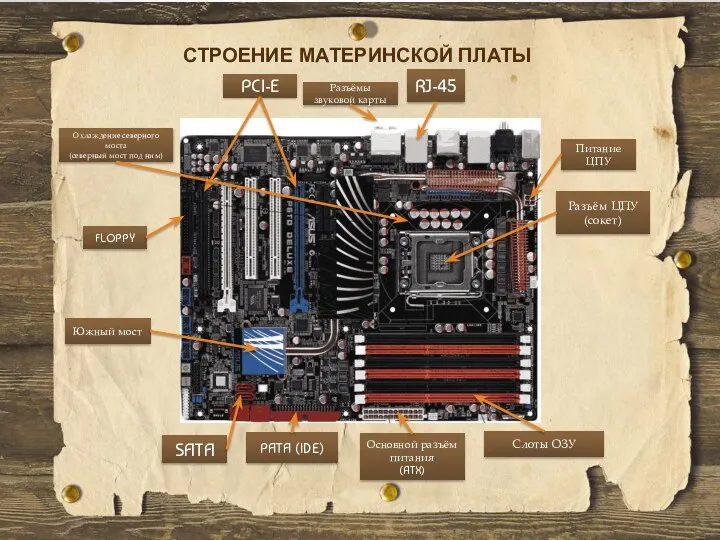 Строение материнской платы
Строение материнской платы Разработка металлических ювелирных и декоративных изделий «Jewelry & paste»
Разработка металлических ювелирных и декоративных изделий «Jewelry & paste» DeVita Ritm base - цифровое устройство оздоровления
DeVita Ritm base - цифровое устройство оздоровления Правовые основы деятельности международных спортивных организаций и олимпийских игр
Правовые основы деятельности международных спортивных организаций и олимпийских игр Презентация Киотская конвенция
Презентация Киотская конвенция Сортоводство лесных древесных пород
Сортоводство лесных древесных пород Языки программирования
Языки программирования Коробка передач на ВАЗ-2106
Коробка передач на ВАЗ-2106 Трещины на торце вала верхнего рулевого управления. LADA 4x4
Трещины на торце вала верхнего рулевого управления. LADA 4x4 第二课 《汉语口语速成 基础 篇》 吃点什么 作者 支悠儿
第二课 《汉语口语速成 基础 篇》 吃点什么 作者 支悠儿 Мақтаншақ бұлақ
Мақтаншақ бұлақ Однофазные линейные электрические цепи синусоидального тока. Элементы цепи. Мощность. Резонанс
Однофазные линейные электрические цепи синусоидального тока. Элементы цепи. Мощность. Резонанс