Классификация кислот
.
По количеству атомов водорода, способных замещаться на металл, все кислоты
делятся на одноосновные (с одним атомом водорода), двухосновные (с 2 атомами Н) и трехосновные (с 3 атомами Н)
** Термин "одноосновная кислота" возник потому, что для нейтрализации одной молекулы такой кислоты требуется "одно основание", т.е. одна молекула какого-либо простейшего основания типа NaOH или KOH:
HNO3 + NaOH = NaNO3 + H2O
HCl + KOH = KCl + H2O
Двухосновная кислота требует для своей нейтрализации уже "два основания", а трехосновная – "три основания":
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O
H3PO4 + 3 NaOH = Na3PO4 + 3 H2O








 1С:Медицина. Больница
1С:Медицина. Больница  Путешествие по городам Германии
Путешествие по городам Германии Пасхальная книжка-раскраска
Пасхальная книжка-раскраска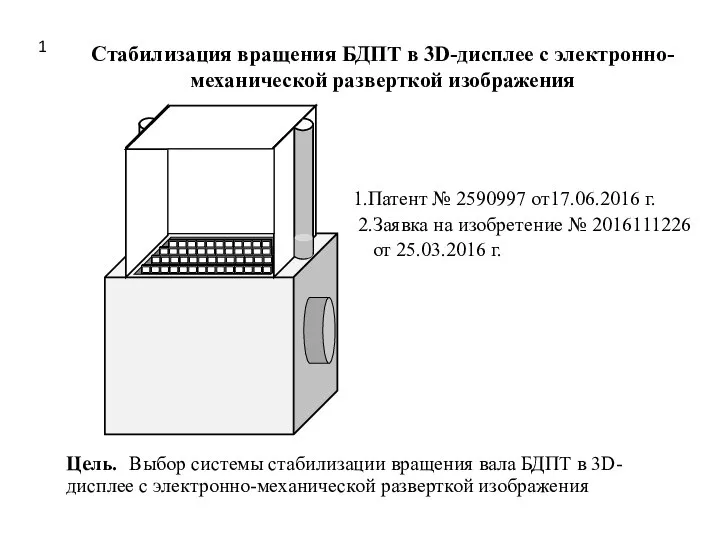 Стабилизация вращения БДПТ в 3D-дисплее с электронно-механической разверткой изображения
Стабилизация вращения БДПТ в 3D-дисплее с электронно-механической разверткой изображения Социология как наука
Социология как наука Холодильні машини
Холодильні машини Психологические основы здоровья
Психологические основы здоровья Внешняя политика России во второй половине в XVII
Внешняя политика России во второй половине в XVII Business object model Диаграммы классов
Business object model Диаграммы классов  Проект детальных инженерно-геологических изысканий на площадке строительства кранового узла №824
Проект детальных инженерно-геологических изысканий на площадке строительства кранового узла №824 Как заработать на арбитраже
Как заработать на арбитраже Галич Александр Аркадьевич
Галич Александр Аркадьевич Активное оконечное оборудование. Аппаратура сопряжения оконечных устройств сети с физической средой передачи
Активное оконечное оборудование. Аппаратура сопряжения оконечных устройств сети с физической средой передачи Основы организации безопасности в Российской Федерации
Основы организации безопасности в Российской Федерации Использование технологии модерации на уроках и во внеклассной деятельности как средство социализации учащихся Единственный пут
Использование технологии модерации на уроках и во внеклассной деятельности как средство социализации учащихся Единственный пут Классы и объекты. Объектно - ориентированное программирование
Классы и объекты. Объектно - ориентированное программирование Обычаи осетинского народа
Обычаи осетинского народа Понятие правопорядка Выполнили: Никонов Владислав Рыбалко Владислав Группа 1309
Понятие правопорядка Выполнили: Никонов Владислав Рыбалко Владислав Группа 1309 Решение тригонометрических уравнений с ограничениями на значение тригонометрических функций действительного аргумента ЕГЭ-2
Решение тригонометрических уравнений с ограничениями на значение тригонометрических функций действительного аргумента ЕГЭ-2 Федерация флорбола
Федерация флорбола Презентация на тему "Применение ИКТ на уроках истории и обществознания" - скачать презентации по Педагогике
Презентация на тему "Применение ИКТ на уроках истории и обществознания" - скачать презентации по Педагогике Фрактальная графика на паскале
Фрактальная графика на паскале поделка коти - презентация для начальной школы
поделка коти - презентация для начальной школы Отстаивание
Отстаивание  Электронные ключи на биполярных транзисторах
Электронные ключи на биполярных транзисторах Psylophyta. Особенности строения в связи с биотопической приуроченностью
Psylophyta. Особенности строения в связи с биотопической приуроченностью Преподаватель: Веселкова Елена Анатольевна
Преподаватель: Веселкова Елена Анатольевна Постоянный электрический ток. Законы цепей постоянного тока
Постоянный электрический ток. Законы цепей постоянного тока