Содержание
- 2. Простые эфиры Низшие простые эфиры называют по радикально-функциональной номенклатуре Простые эфиры сложного строения рассматривают как алканы
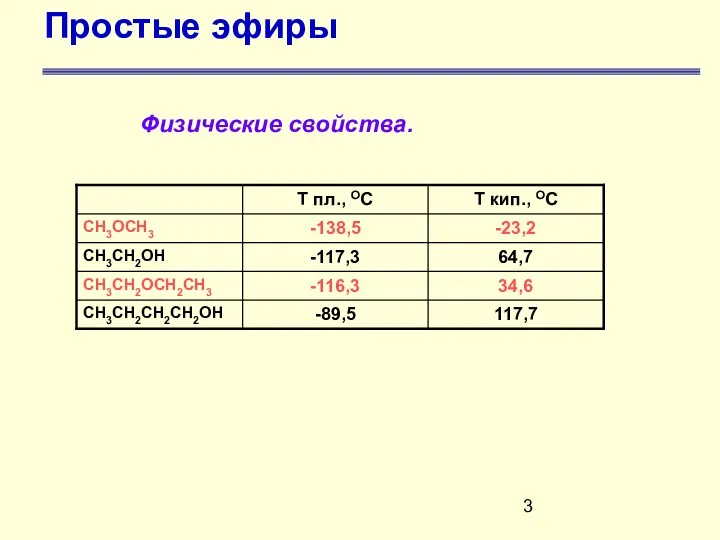
- 3. Простые эфиры Физические свойства.
- 4. Простые эфиры Физические свойства Простые эфиры являются бесцветными жидкостями (кроме диметилового эфира, который в нормальных условиях
- 5. Простые эфиры Химические свойства Простые эфиры отличаются низкой реакционной способностью. Они устойчивы к действию сильных оснований,
- 6. Простые эфиры Основность Простые эфиры являются довольно слабыми основаниями и плохими нуклеофилами. Простые эфиры взаимодействуют с
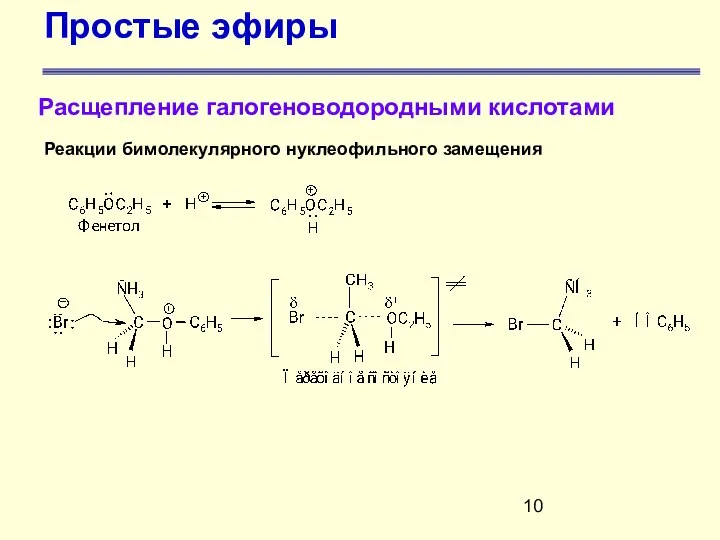
- 7. Простые эфиры Расщепление галогеноводородными кислотами Разрыв связи углерод-кислород происходит только в жестких условиях – при нагревании
- 8. Простые эфиры Расщепление галогеноводородными кислотами
- 9. Простые эфиры Расщепление галогеноводородными кислотами Реакция протекает по механизму SN1 или SN2 в зависимости от строения
- 10. Простые эфиры Расщепление галогеноводородными кислотами Реакции бимолекулярного нуклеофильного замещения
- 11. Простые эфиры Расщепление галогеноводородными кислотами Реакции мономолекулярного нуклеофильного замещения
- 12. Простые эфиры Окисление кислородом воздуха. Пероксиды Простые эфиры на свету медленно окисляются кислородом воздуха с образованием
- 13. Простые эфиры Способы получения Межмолекулярная дегидратация спиртов. Вторичные и третичные спирты при нагревании в присутствии минеральных
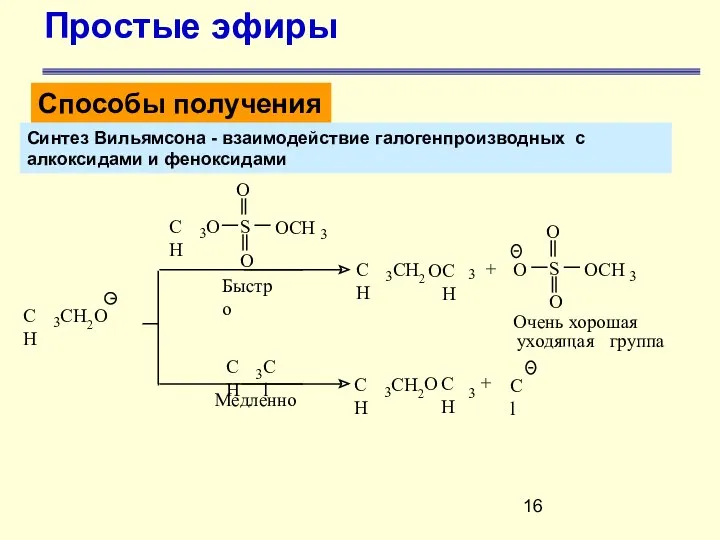
- 14. Простые эфиры Способы получения Синтез Вильямсона - взаимодействие галогенпроизводных с алкоксидами и феноксидами В лабораторных условиях
- 15. Простые эфиры Способы получения При применении алкилтозилатов получение простых эфиров проходит еще более гладко Синтез Вильямсона
- 16. Простые эфиры Способы получения Синтез Вильямсона - взаимодействие галогенпроизводных с алкоксидами и феноксидами CH 3 Cl
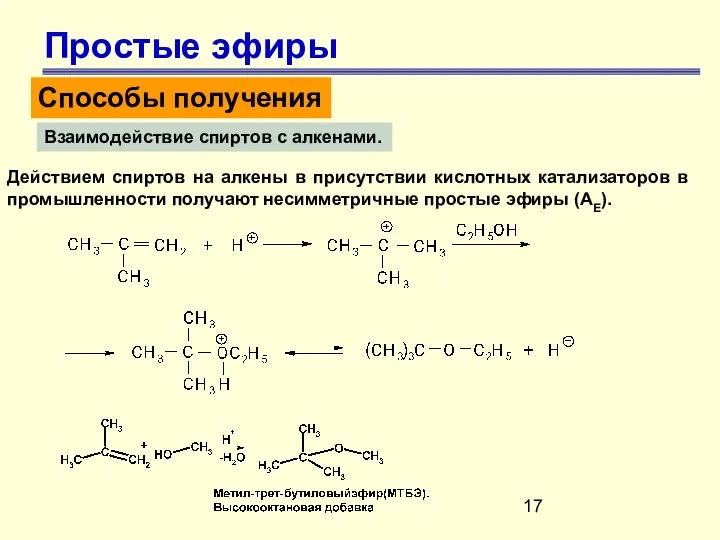
- 17. Простые эфиры Способы получения Взаимодействие спиртов с алкенами. Действием спиртов на алкены в присутствии кислотных катализаторов
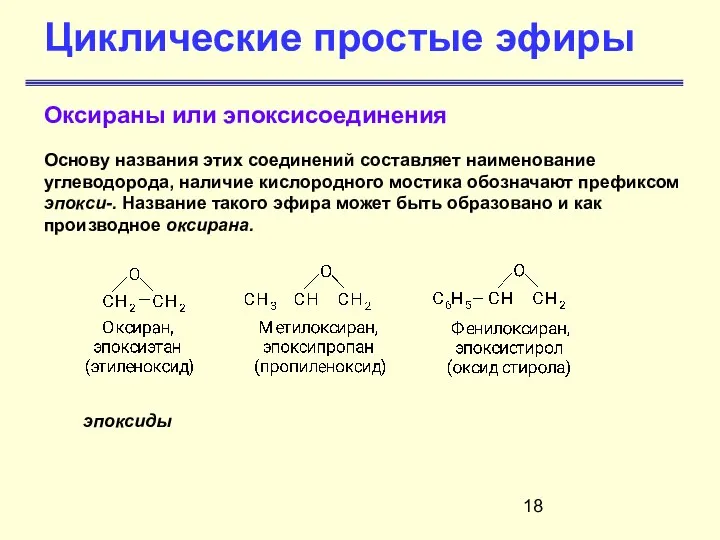
- 18. Циклические простые эфиры Основу названия этих соединений составляет наименование углеводорода, наличие кислородного мостика обозначают префиксом эпокси-.
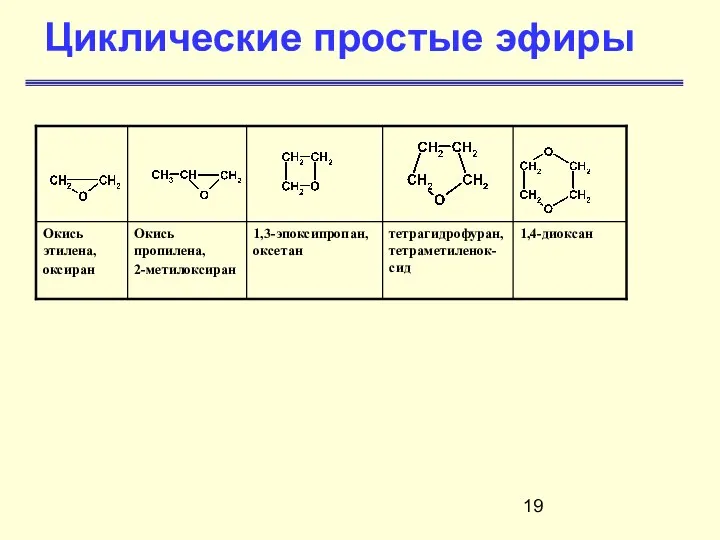
- 19. Циклические простые эфиры
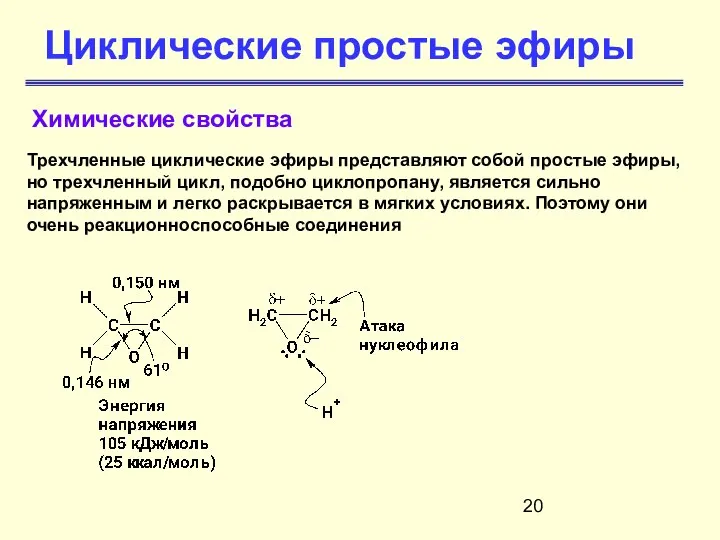
- 20. Циклические простые эфиры Химические свойства Трехчленные циклические эфиры представляют собой простые эфиры, но трехчленный цикл, подобно
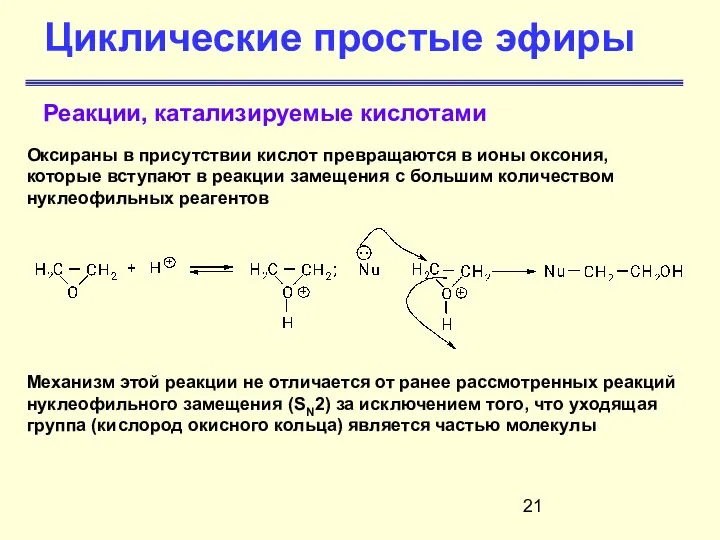
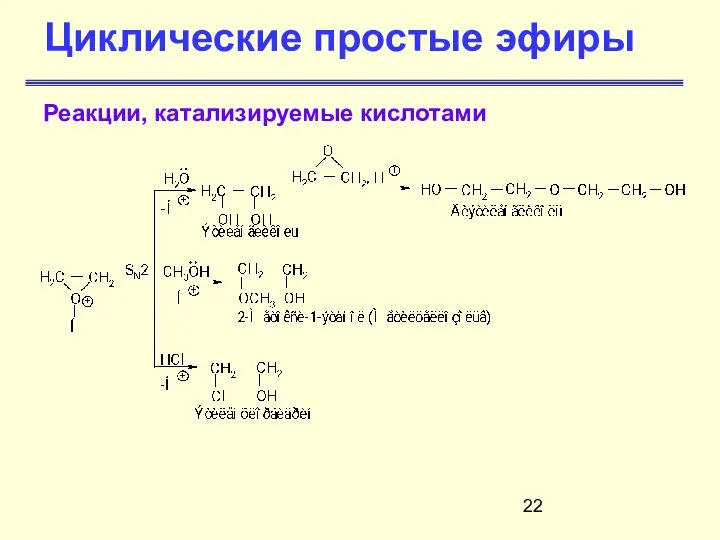
- 21. Циклические простые эфиры Реакции, катализируемые кислотами Оксираны в присутствии кислот превращаются в ионы оксония, которые вступают
- 22. Циклические простые эфиры Реакции, катализируемые кислотами
- 23. Циклические простые эфиры Реакции раскрытия кольца непротонированной эпокиси Более сильный нуклеофильный характер реагента компенсирует более низкую
- 24. Циклические простые эфиры Четырехчленный циклический эфир – окись триметилэтилена (СН2)3О расщепляется труднее, чем окись этилена. Тетрагидрофуран
- 25. Циклические простые эфиры Алкены реагируют с галогенами в присутствии воды с образованием галогенгидринов, при обработке которых
- 26. Циклические простые эфиры Гидропероксиды карбоновых кислот (надкислоты) количественно превращают алкены в эпоксиды 2. Окисление алкенов гидропероксидами
- 28. Скачать презентацию
















 Чебоксары, Муниципальное образовательное учреждение «Школа № 7» Нет меж живущих людей, да не может и быть безымянных, В первый же миг по рождении каждый, убогий и знатный, И
Чебоксары, Муниципальное образовательное учреждение «Школа № 7» Нет меж живущих людей, да не может и быть безымянных, В первый же миг по рождении каждый, убогий и знатный, И ВКР: «Межкультурная коммуникация как инструмент деловой и корпоративной культуры»
ВКР: «Межкультурная коммуникация как инструмент деловой и корпоративной культуры» Усиление деревянных конструкций (1)
Усиление деревянных конструкций (1) Воспаление
Воспаление  Відкриваюча промова – практичні поради для адвокатів
Відкриваюча промова – практичні поради для адвокатів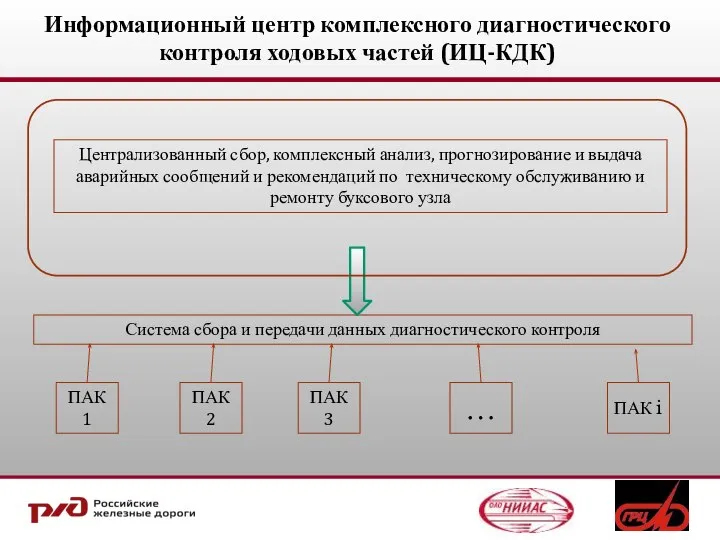 Информационный центр комплексного диагностического контроля ходовых частей (ИЦ-КДК)
Информационный центр комплексного диагностического контроля ходовых частей (ИЦ-КДК) Памятник "Лемболовская твердыня” перешел в собственность Ленинградской области
Памятник "Лемболовская твердыня” перешел в собственность Ленинградской области Валы и оси редуктора
Валы и оси редуктора Костюмированные шоу, как средство формирования культуры праздника
Костюмированные шоу, как средство формирования культуры праздника Подарки детям я несу… (кое-что о дедах морозах мира)
Подарки детям я несу… (кое-что о дедах морозах мира) Солнцевская организованная преступная группировка Выполнили: Трушко П.О. и Тимченко Н.Н.
Солнцевская организованная преступная группировка Выполнили: Трушко П.О. и Тимченко Н.Н.  Алгоритмы и исполнители
Алгоритмы и исполнители Презентация по истории культуры России Великий Новгород Кремль и Ярославово дворище
Презентация по истории культуры России Великий Новгород Кремль и Ярославово дворище Школа 2000 (Новицкая А.Н.)
Школа 2000 (Новицкая А.Н.) The christmas quiz
The christmas quiz Проектная подготовка в строительстве
Проектная подготовка в строительстве Компьютердің конструктивті құрылғылары
Компьютердің конструктивті құрылғылары Выполнила: студент 3 курса (303 группа) факультета ВСО форма обучения: заочная Швачко.А.В.
Выполнила: студент 3 курса (303 группа) факультета ВСО форма обучения: заочная Швачко.А.В. Ультразвуковой контроль
Ультразвуковой контроль Задачи педагогического коллектива по повышению эффективности здоровьесбережения школьников и безопасных условий обучения
Задачи педагогического коллектива по повышению эффективности здоровьесбережения школьников и безопасных условий обучения Многозональные вытяжные вентиляторы
Многозональные вытяжные вентиляторы Организация финансового контроля проведения торгов в сфере гос. и мун. закупок
Организация финансового контроля проведения торгов в сфере гос. и мун. закупок  Лапшина Ольга Ивановна Учитель английского языка. МОУ Первомайская СОШ
Лапшина Ольга Ивановна Учитель английского языка. МОУ Первомайская СОШ МАОУ «Школа № 176». Команда Зарничников
МАОУ «Школа № 176». Команда Зарничников Безопасность предпринимательской деятельности
Безопасность предпринимательской деятельности Механическая коробка передач
Механическая коробка передач Семь русских чайных традиций
Семь русских чайных традиций Модели торговли и логистики
Модели торговли и логистики