Содержание
- 2. Виды дисперсных систем 1) Грубодисперсные (взвеси). rчастиц > 1 мк (10-4 см). Взвеси делятся на суспензии
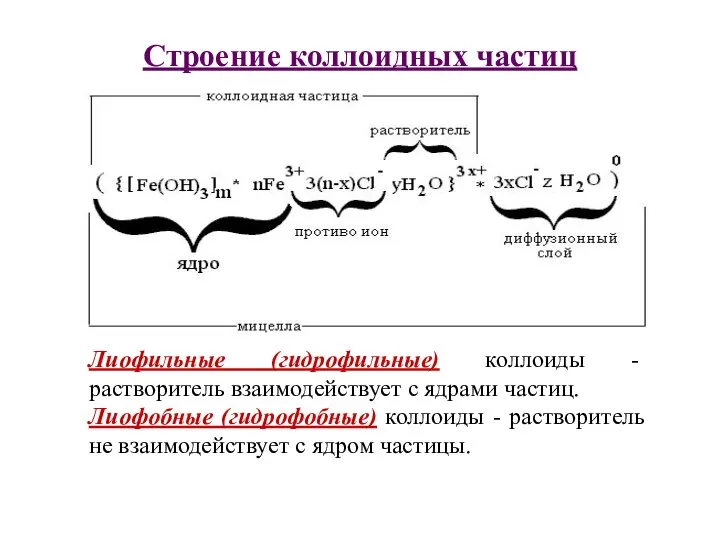
- 3. Строение коллоидных частиц Лиофильные (гидрофильные) коллоиды - растворитель взаимодействует с ядрами частиц. Лиофобные (гидрофобные) коллоиды -
- 4. Поверхностная энергия Для границы раздела: жидкость – жидкость, жидкость – твердое тело применяют термин межфазная энергия.
- 5. Процесс поглощения одного вещества поверхностью или объёмом другого – это сорбция. Вещество, частицы которого поглощаются, (газ,
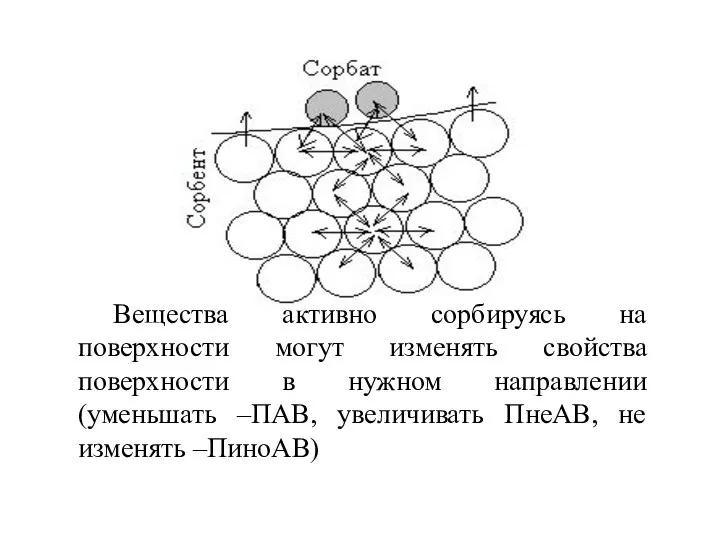
- 6. Вещества активно сорбируясь на поверхности могут изменять свойства поверхности в нужном направлении (уменьшать –ПАВ, увеличивать ПнеАВ,
- 7. Удельной поверхностью - площадь, приходящейся на единицу массы сорбента. So = S/m S – площадь поверхности
- 8. Различают физическую адсорбцию и химическую (хемосорбцию). При физической адсорбции: Возникают непрочные межмолекулярные силы (силы Ван-дер-Ваальса). Теплота
- 9. При химической адсорбции: Возникают прочные химические связи. Энергия хемосорбции значительна ΔН~100 кДж/моль. 3) Хемосорбция может распространяться
- 10. Изотерма адсорбции. Процесс отрыва частиц сорбата от поверхности сорбента, т.е. явление, обратное адсорбции, называется десорбцией. Степень
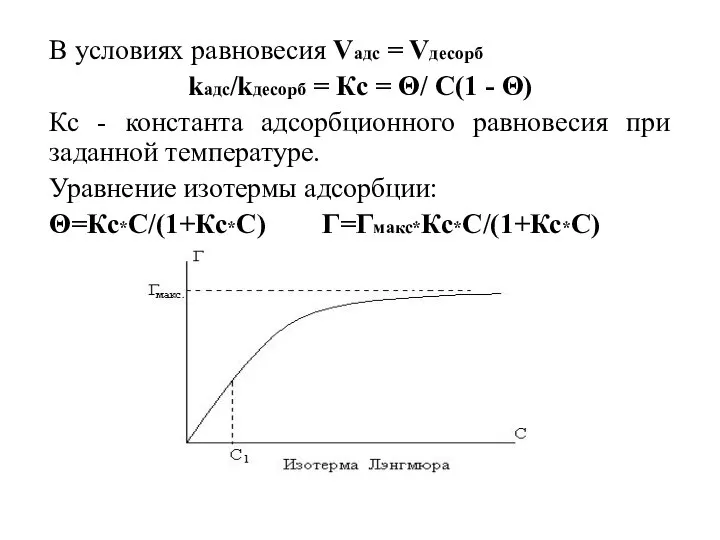
- 11. В условиях равновесия Vадс = Vдесорб kадс/kдесорб = Кс = Θ/ С(1 - Θ) Кс -
- 12. В области малых равновесных концентраций: Г=Гмакс*Кс*С Жидкостная – адсорбция твердой неподвижной фазой из потока раствора жидкости.
- 13. Раствор - это многокомпонентная однофазная система переменного состава. Раствор - это продукт физического или химического взаимодействия
- 14. Виды растворов по фазовому состоянию растворителя: газообразный, 2) твердый, 3)жидкий. Газовые растворы - физическая смесь не
- 15. Твердые растворы Различают твердые растворы замещения и твердые растворы внедрения. Твердые растворы замещения образуются, если: а)
- 16. Твердые растворы замещения есть во всех типах кристаллических решеток, которые мы рассматривали Кристаллическая Твердые растворы решетка
- 17. Твердые растворы внедрения образуют два компонента, когда частиц одного компонента не превышает 2/3 размера частиц другого,
- 18. По типу растворителя растворы бывают: протонные и апротонные. Растворитель протонный, если его молекулы способны отщиплять ион
- 19. Жидкие растворы. По исходному фазовому состоянию растворяемого вещества делятся: Газ в жидкости – раствор СО2 в
- 20. Диссоциация – это процесс разделения под действием растворителя ионов, уже имеющихся в растворяемом веществе. Ионизация –
- 21. Если Q1>Q2, процесс растворения эндотермический. Если Q1 Раствор остается истинным, если размер частиц растворенного вещества не
- 22. АВтв↔ АВр-р Раствор, в котором устанавливается равновесие между растворением и образованием (осаждением) вещества, называется насыщенным, а
- 23. Растворимость газов уменьшается с увеличением температуры. закон Генри: Растворимость газов в жидкости пропорциональна их парциальному давлению
- 24. При понижении температуры насыщенного раствора в определенных условиях растворенное вещество может не выпадать в осадок и
- 25. Идеальные растворы, в которых не происходят химические реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами
- 26. Коллигативные свойства растворов. Свойства растворов, которые зависят от концентрации и практически не зависят от природы растворенных
- 27. Первый закон Рауля Р1 Давление насыщенного пара над раствором равно его давлению над чистым растворителем, умноженному
- 28. Для электролитов первый закон Рауля: (Р0- Р1)/ Р0 = i*N2 i–изотонический коэффициент, учитывают увеличение числа частиц
- 29. Второй закон Рауля. Повышение температуры кипения или уменьшения температуры кристаллизации раствора пропорционально моляльной концентрации растворенного вещества.
- 30. Вторая формулировка второго закона Рауля: Повышение температуры кипения и понижение температуры застывания растворов пропорциональны числу частиц
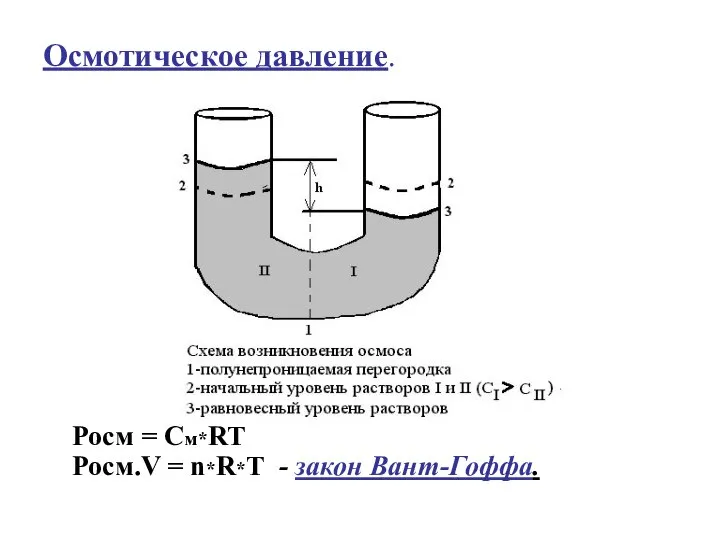
- 31. Осмотическое давление. Росм = См*RT Росм.V = n*R*T - закон Вант-Гоффа.
- 32. Осматическое давление -это давление, которое создавало бы растворенное вещество в объеме раствора V, если бы его
- 33. Законы Рауля и Вант-Гоффа соблюдаются в разбавленных растворах неэлектролитов. При увеличении концентрации возникают отклонения от законов
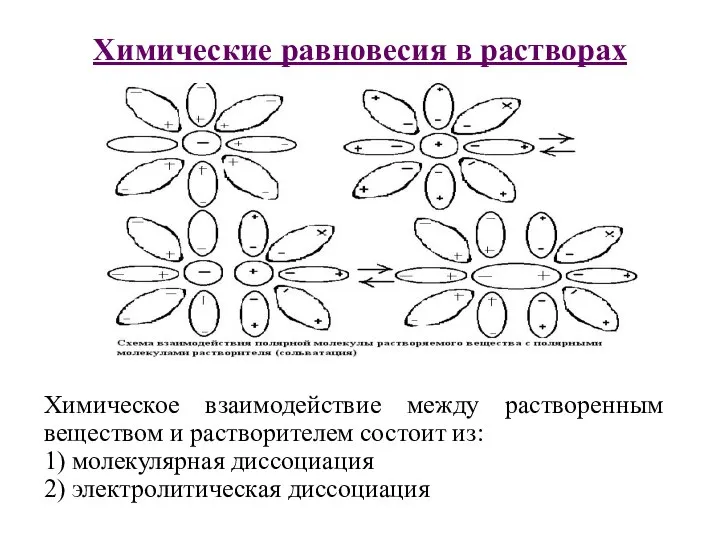
- 34. Химические равновесия в растворах Химическое взаимодействие между растворенным веществом и растворителем состоит из: 1) молекулярная диссоциация
- 35. Первая стадия происходит из-за химического взаимодействия между молекулами растворенного вещества АВ и (n+m) молекулами растворителя S.
- 36. Если процесс сольватации останавливается на стадии молекулярной диссоциации, то система является раствором не электролита. Если процесс
- 37. Теория Аррениуса. 1) Электролитическая диссоциация- распад растворенных веществ на ионы. 2) Ионы H+ и OH-- продукты
- 38. Недостатки теории Аррениуса. Не объясняла, что в разбавленном растворе степень диссоциации слабой кислоты или основания становилась
- 39. 3) Не объясняла диссоциацию кислых солей. По Аррениусу: NaHSO4 =Na+ + HSO4- HSO4- =H+ + SO42-
- 40. 4) Не объясняла гидролиз солей, образованных слабыми кислотами или слабыми основаниями, например: AlCl3 + H2O =(AlOH)Cl2
- 41. 5) По Аррениусу реакции нейтрализации типа: KOH + HNO3 =KNO3 + H2O OH- + H+ =H2O
- 42. Процесс распада вещества при его растворении на ионы называют электролитической диссоциацией. Теории электролитической диссоциации. 1) Теории
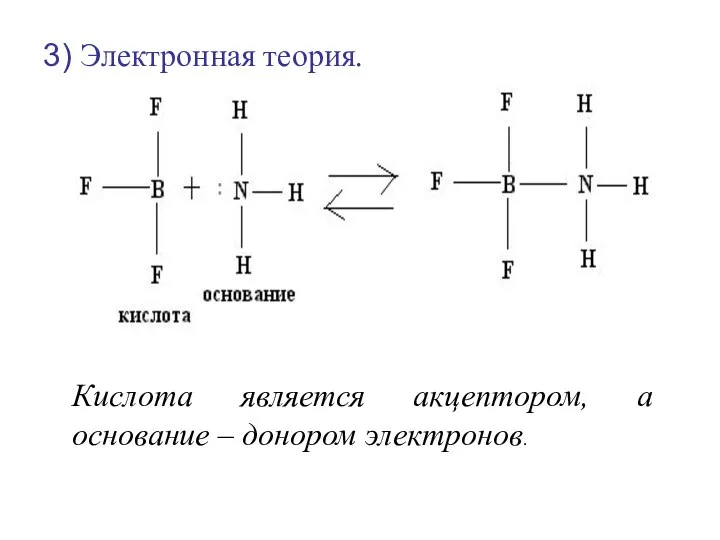
- 43. 2) Протонная теория кислот и оснований. Кислоту считают донором протонов, основание – акцептором протонов. Основание +
- 44. Энергия, которая выделяется при присоединении протона к молекуле или иону является количественной характеристикой кислотно-основных свойств, и
- 45. OH-(г) + H+(г) =H2O(г) ; ΔH0 = -1644 кДж F-(г) + H+(г) =HF(г) ; ΔH0 =
- 46. Конкуренция за обладание протоном делает кислотно-оснoвную реакцию обратимой и приводит ее к состоянию протолитического равновесия с
- 47. Иногда протонсодержащая частица HA- (молекула или ион) способна как отдавать, так и принимать протоны. Это протолиты
- 48. Пример: 1) автопротолиз газообразной воды: H2O(г)+H2O(г)=OH-(г)+H3O+(г) кислота + основание ↔ основание + кислота 2) взаимодействие двух
- 49. 3) Электронная теория. Кислота является акцептором, а основание – донором электронов.
- 50. Растворители, которые являются протолитами по отношению ко многим растворенным веществам, называются протонными растворителями. Например: H2O, NH3,
- 51. Кислотные и основные растворители заставляют протолиты быть или только основаниями, или только кислотами. Примеры кислотных растворителей:
- 52. Амфотерные растворители по отношению к одному большому набору протолитов проявляют кислотные свойства, а к другому большому
- 53. Амфотерные растворители (амфолиты) склонны к автопротолизу: HL + HL =L-(s) + H2L+(s); Kс При этом образуются
- 54. Ионное произведение воды обозначается Kв: H2O+H2O=OH-+H3O+; Kв = 1,0 * 10-14 (250C) Значение Ks остается постоянным
- 55. Молекулы воды влияют на структуру раствора, а растворенное вещество влияет на структуру воды (растворителя). Ионы обладают
- 56. Различают три области вокруг иона. Зона 1 под действием поля иона молекулы воды ориентируются, как в
- 57. Степень диссоциации α - отношение числа молекул, диссоциированных на ионы, к общему числу молекул = Сдисс/Со
- 58. Сильные электролиты Диссоциируют: а) необратимо HNO3 + H2O = NO3- + H3O+ Поэтому ни ион H3O+,
- 59. Если не учитывать влияния аниона растворенного вещества, наибольшей по силе кислотой в растворителе HL будет всегда
- 60. Если не учитывать влияния катионов растворенного вещества, то наибольшим по силе основанием в растворителе HL будет
- 61. Самая сильная кислота в водном растворе ион оксония H3O+: H3O+ + H2O =H2O + H3O+; Kс
- 62. Т.е. ионные кристаллы Na2O и NaNH2 полностью гидролизуются водой. Поэтому ни ион OH-, ни продукты гидролиза
- 63. Для сильных электролитов при учете свойств растворов используют вместо концентрации – активность аi. аi = fi*Сi
- 64. Правило ионной силы: ионы одинаковой зарядности, независимо от их природы, в разбавленных растворах с одинаковой концентрацией
- 65. Физический смысл f (коэффициента активности) и α (кажущейся степени диссоциации) - они моделируют степень диссоциации для
- 66. Слабые электролиты Диссоциируют: а) обратимо; б) ступенчато. Это вода, ряд кислот, основания р-, d-, f- элементов.
- 67. Связь константы и степени диссоциации. Закон разбавления Освальда А) для сильных электролитов: Kдисс = α2* C0/(1-α)
- 68. Произведение растворимости Константа гетерогенного равновесия раствор ↔ осадок определяться произведением активностей ионов в растворе и не
- 69. ПР зависит от природы растворенного вещества и растворителя, температуры и не зависит от концентрации ионов в
- 71. Скачать презентацию






























































 урок анатомии 3 гимназия
урок анатомии 3 гимназия Презентация опыта работы учителя начальных классов МОУ СОШ № 6 п. Каскадный Андроповского района Ставропольского края по теме: «И
Презентация опыта работы учителя начальных классов МОУ СОШ № 6 п. Каскадный Андроповского района Ставропольского края по теме: «И Инженерная графика. Начертательная геометрия. Конспект лекций
Инженерная графика. Начертательная геометрия. Конспект лекций Место и роль науки о культуре в системе современного гуманитарного знания
Место и роль науки о культуре в системе современного гуманитарного знания Этикетные требования к проведению переговоров
Этикетные требования к проведению переговоров Scheduling and lot sizing
Scheduling and lot sizing «Личностные качества медицинской сестры и её основные функции»
«Личностные качества медицинской сестры и её основные функции» Организация Африканского сотрудничества
Организация Африканского сотрудничества Методическая разработка занятия по теме «Моя любимая кукла»
Методическая разработка занятия по теме «Моя любимая кукла» Физиология сердечно- сосудистой системы
Физиология сердечно- сосудистой системы Программирование на языке высокого уровня (C++)
Программирование на языке высокого уровня (C++) Единый социальный налог
Единый социальный налог  Машины постоянного тока
Машины постоянного тока Презентация на тему "Гигиена и правила ухода за кожей" - скачать презентации по Медицине
Презентация на тему "Гигиена и правила ухода за кожей" - скачать презентации по Медицине Состав персонального компьютера и периферийные устройства. (Часть 1)
Состав персонального компьютера и периферийные устройства. (Часть 1) Подготовка к ЕГЭ по обществознанию. Политические режимы
Подготовка к ЕГЭ по обществознанию. Политические режимы Глобализация. Плюсы и минусы
Глобализация. Плюсы и минусы Вчитель Новоспаської ЗОШ Подлєсна І.С.
Вчитель Новоспаської ЗОШ Подлєсна І.С. Построение диаграмм и графиков
Построение диаграмм и графиков Наименьшее общее кратное - презентация по Алгебре_
Наименьшее общее кратное - презентация по Алгебре_ Информационные технологии Диаграммы Диаграммы вариантов использования (прецедентов)
Информационные технологии Диаграммы Диаграммы вариантов использования (прецедентов) Презентация "Сертификация продукции и систем качества" - скачать презентации по Экономике
Презентация "Сертификация продукции и систем качества" - скачать презентации по Экономике Електромагнітні явища. Потік вектора магнітної індукції. (Лекція 14)
Електромагнітні явища. Потік вектора магнітної індукції. (Лекція 14) умножение и деление на 9 - презентация для начальной школы
умножение и деление на 9 - презентация для начальной школы Программирование на языке С. Модуль 1. Введение в язык С
Программирование на языке С. Модуль 1. Введение в язык С Древняя Индия
Древняя Индия Гибридные двигатели
Гибридные двигатели Самые необычные праздники мира
Самые необычные праздники мира