Содержание
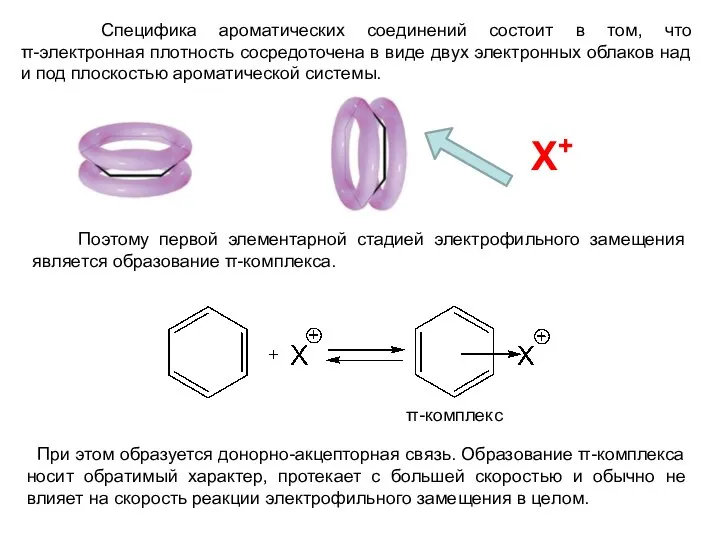
- 2. Специфика ароматических соединений состоит в том, что π-электронная плотность сосредоточена в виде двух электронных облаков над
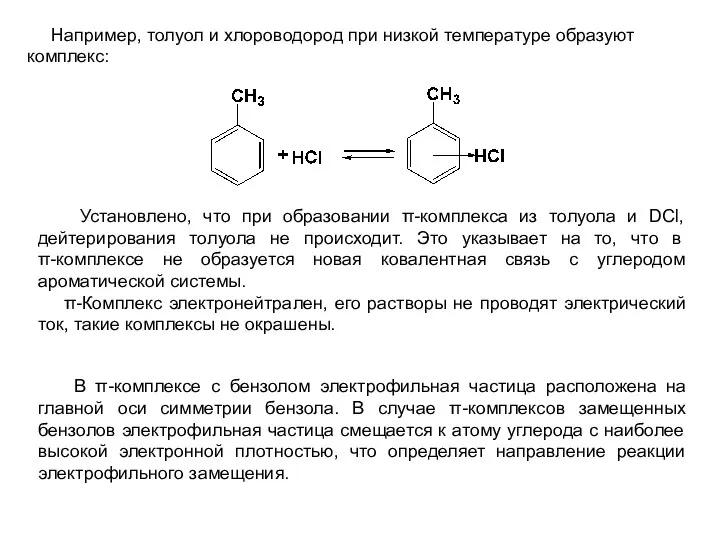
- 3. Например, толуол и хлороводород при низкой температуре образуют комплекс: Установлено, что при образовании π-комплекса из толуола
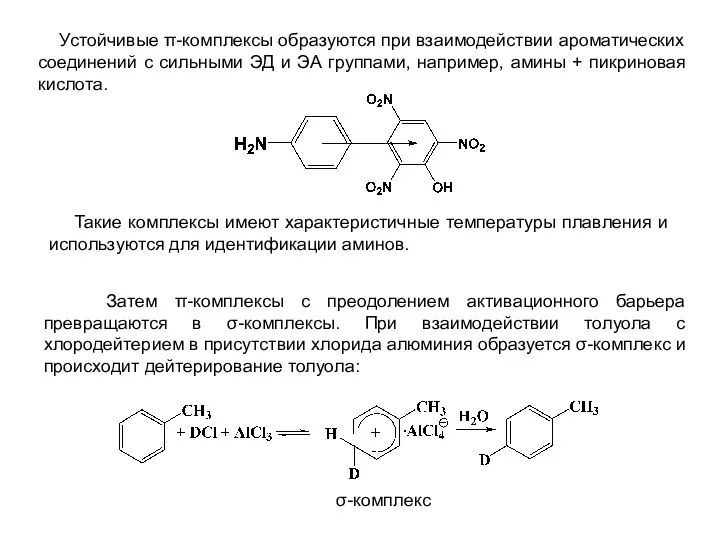
- 4. Устойчивые π-комплексы образуются при взаимодействии ароматических соединений с сильными ЭД и ЭА группами, например, амины +
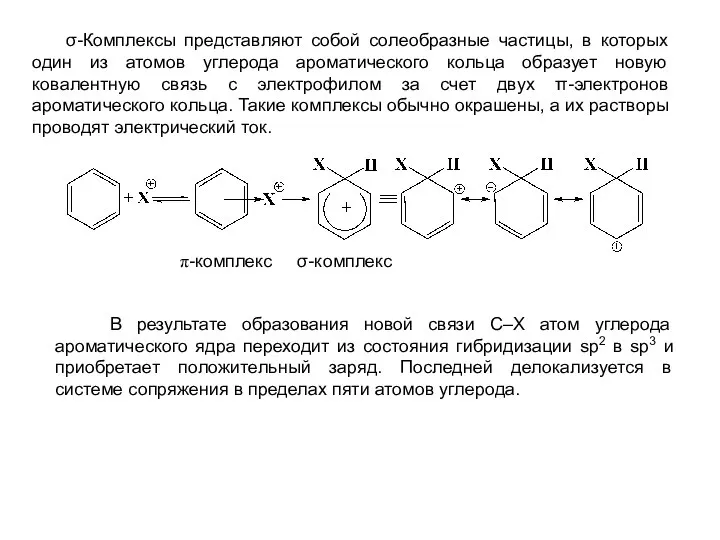
- 5. σ-Комплексы представляют собой солеобразные частицы, в которых один из атомов углерода ароматического кольца образует новую ковалентную
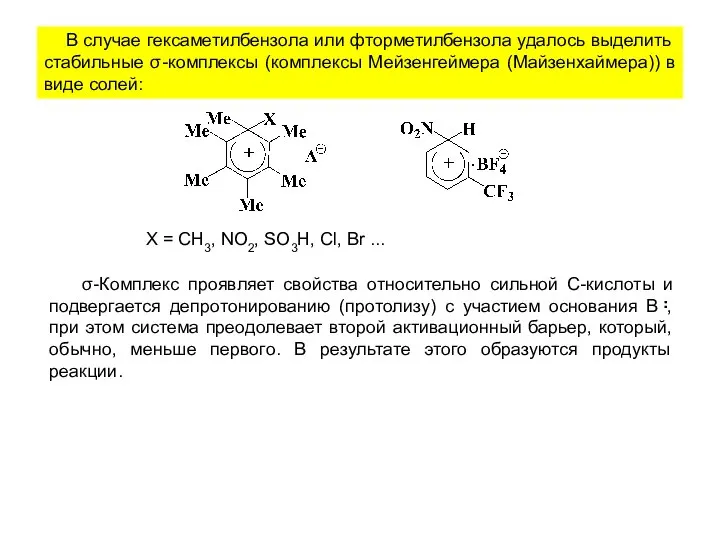
- 6. В случае гексаметилбензола или фторметилбензола удалось выделить стабильные σ-комплексы (комплексы Мейзенгеймера (Майзенхаймера)) в виде солей: Х
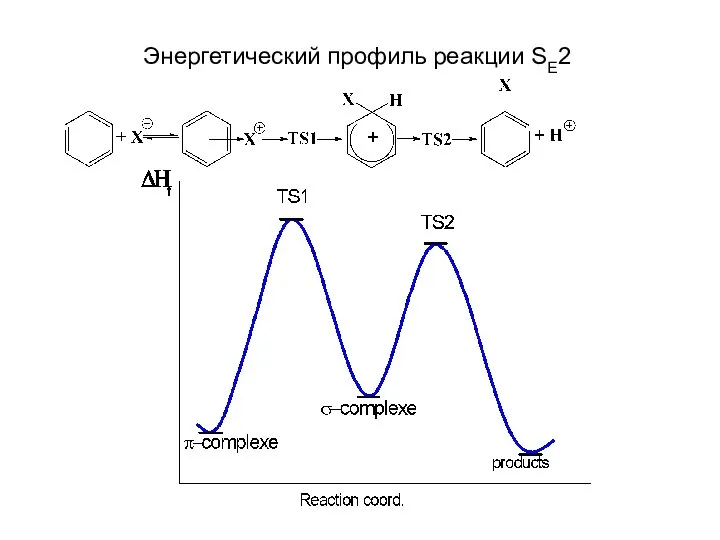
- 7. Энергетический профиль реакции SE2
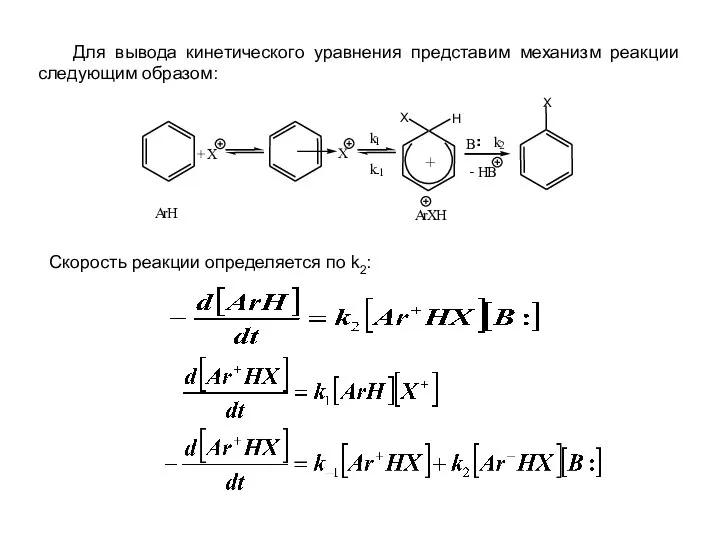
- 8. Для вывода кинетического уравнения представим механизм реакции следующим образом: Скорость реакции определяется по k2: ¨
- 9. Полагая, что в стационарном режиме скорость образования σ–комплекса равна скорости его расходования, можно записать: Тогда концентрация
- 10. В зависимости от условий протекания реакции возможны два предельных случая: 1. Наиболее типичный случай Скорость реакции
- 11. Реакции замещения бывают обратимыми и необратимыми, при этом обратимость реакций определяется вероятностью протонирования атома углерода, связанного
- 12. Реакции SE2 в монозамещенных бензолах Направление электорофильной атаки в монозамещенных определяется: статическим фактором (распределением электронной плотности
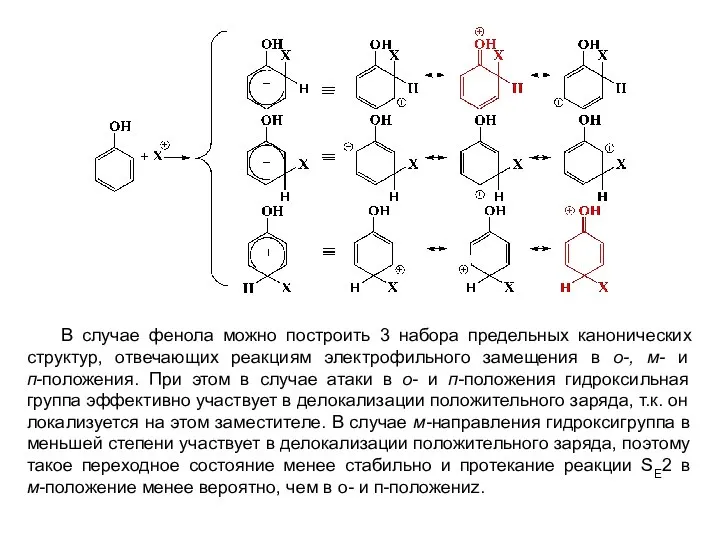
- 13. В случае фенола можно построить 3 набора предельных канонических структур, отвечающих реакциям электрофильного замещения в о-,
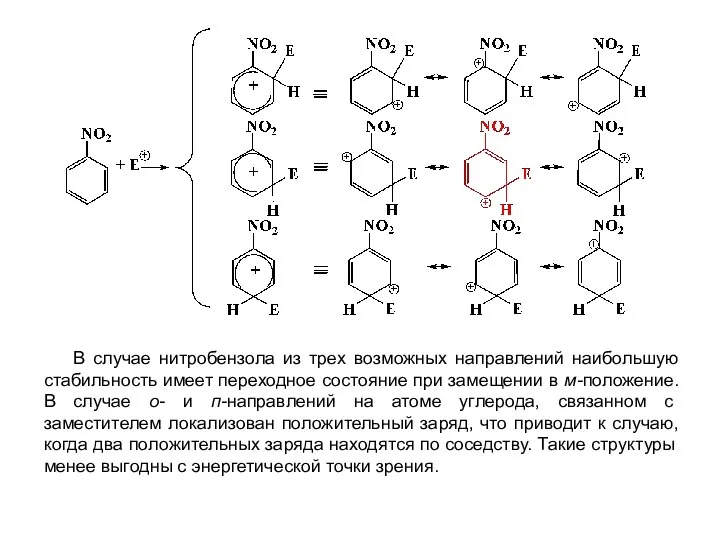
- 14. В случае нитробензола из трех возможных направлений наибольшую стабильность имеет переходное состояние при замещении в м-положение.
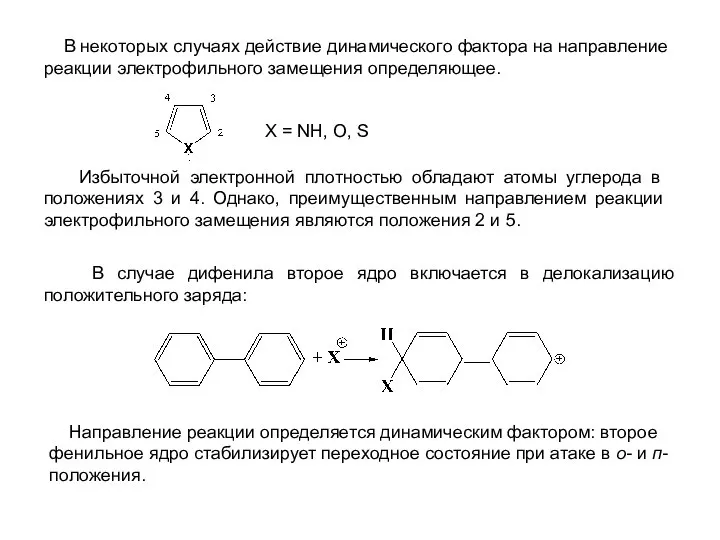
- 15. В некоторых случаях действие динамического фактора на направление реакции электрофильного замещения определяющее. Избыточной электронной плотностью обладают
- 16. Субстратная и позиционная селективность Присутствие заместителя в бензольном ядре изменяет общую скорость реакции электрофильного замещения по
- 17. Произведения относительной скорости на величины, характеризующие соотношения образующихся изомеров, выражают относительную скорость реакции электрофильного замещения в
- 18. Поскольку получим выражение для ПФС: Относительная скорость нитрования, соотношение региоизомеров (%) и ФПС замещенных бензолов
- 19. При наличии в бензольном ядре метильной группы скорость нитрования почти в 25 раз выше, чем в
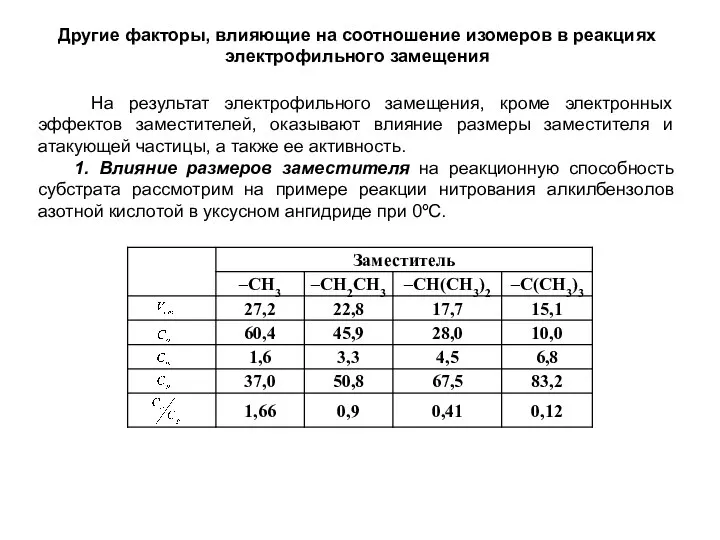
- 20. Другие факторы, влияющие на соотношение изомеров в реакциях электрофильного замещения На результат электрофильного замещения, кроме электронных
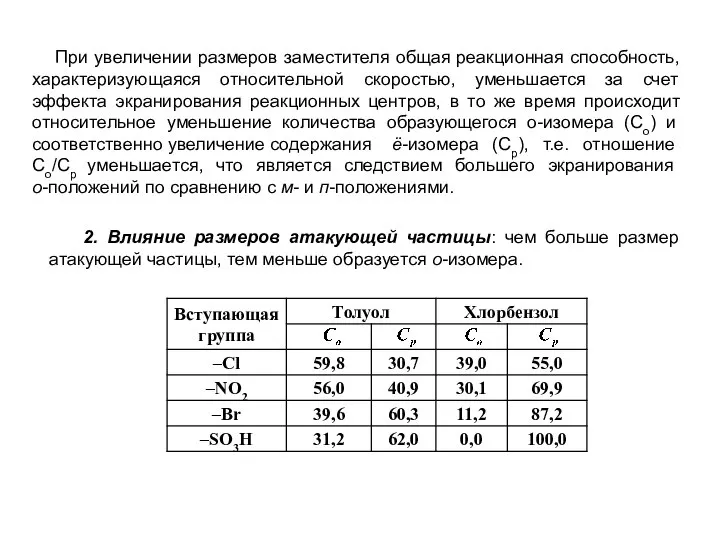
- 21. При увеличении размеров заместителя общая реакционная способность, характеризующаяся относительной скоростью, уменьшается за счет эффекта экранирования реакционных
- 22. Не зависимо от природы заместителя в молекуле субстрата (замещенного бензола) происходит относительное уменьшение количества образующегося о-изомера
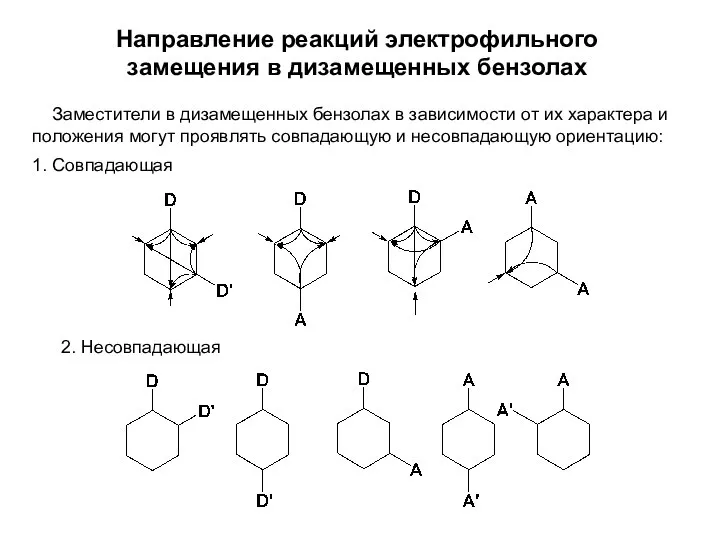
- 23. Направление реакций электрофильного замещения в дизамещенных бензолах Заместители в дизамещенных бензолах в зависимости от их характера
- 24. В случае присутствия в молекуле ЭД (D) и ЭА (A) заместителей направление реакции электрофильного замещения определяется
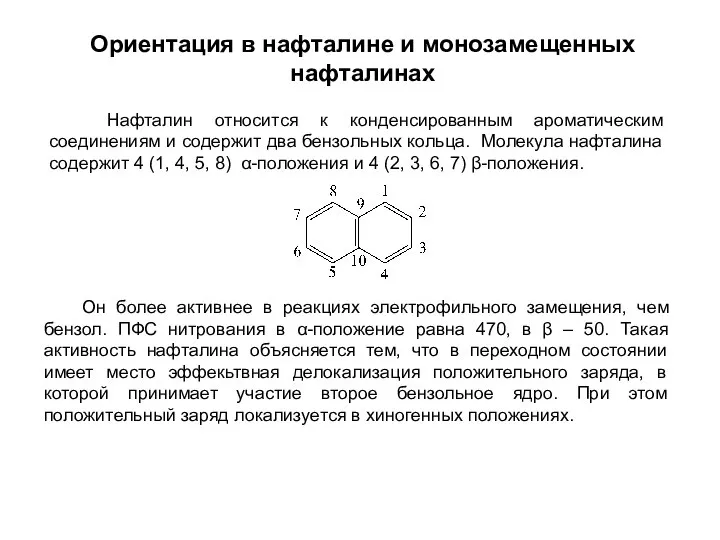
- 25. Ориентация в нафталине и монозамещенных нафталинах Нафталин относится к конденсированным ароматическим соединениям и содержит два бензольных
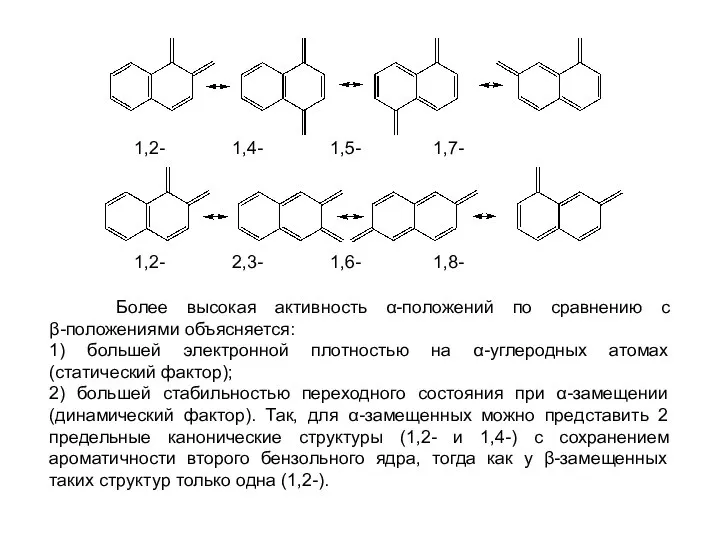
- 26. 1,2- 1,4- 1,5- 1,7- 1,2- 2,3- 1,6- 1,8- Более высокая активность α-положений по сравнению с β-положениями
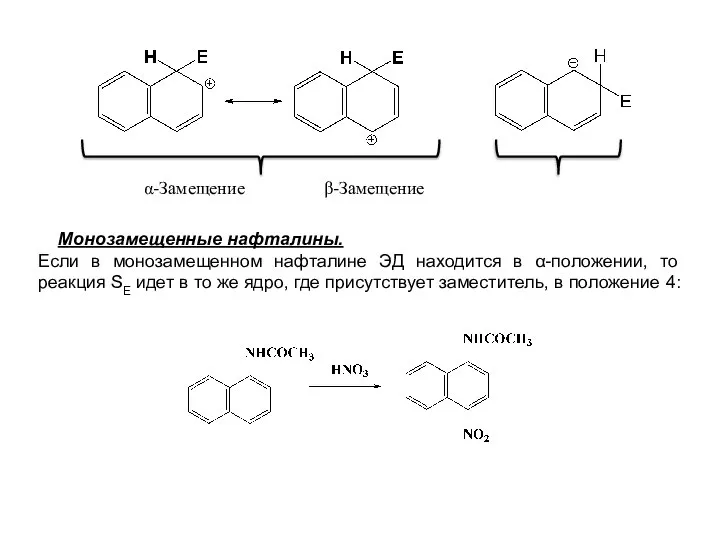
- 27. α-Замещение β-Замещение Монозамещенные нафталины. Если в монозамещенном нафталине ЭД находится в α-положении, то реакция SE идет
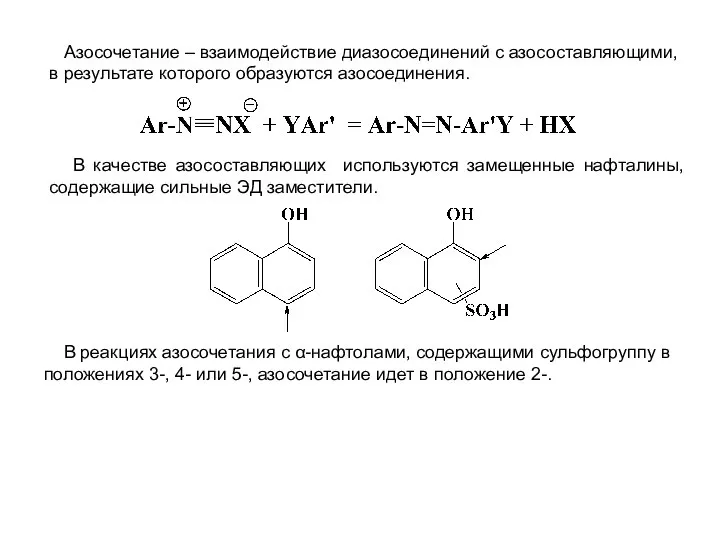
- 28. Азосочетание – взаимодействие диазосоединений с азосоставляющими, в результате которого образуются азосоединения. В качестве азосоставляющих используются замещенные
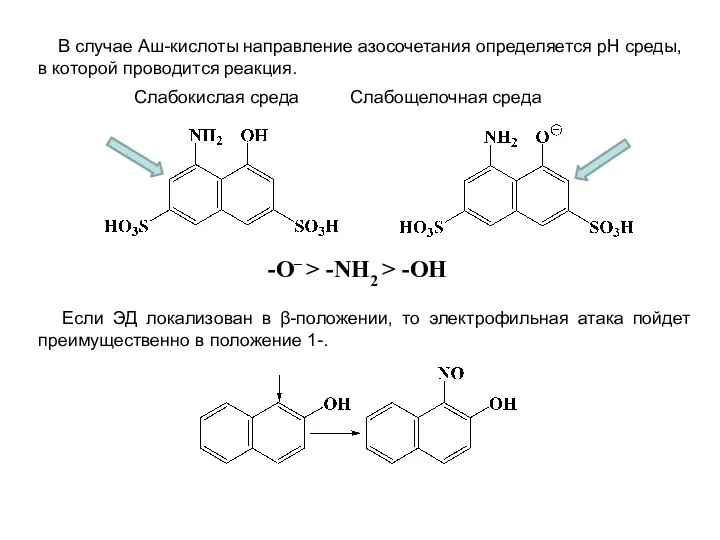
- 29. В случае Аш-кислоты направление азосочетания определяется рН среды, в которой проводится реакция. Слабокислая среда Слабощелочная среда
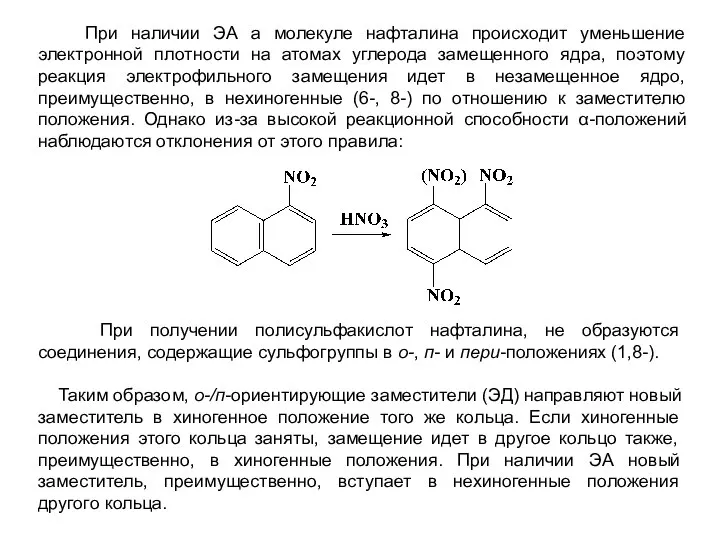
- 30. При наличии ЭА а молекуле нафталина происходит уменьшение электронной плотности на атомах углерода замещенного ядра, поэтому
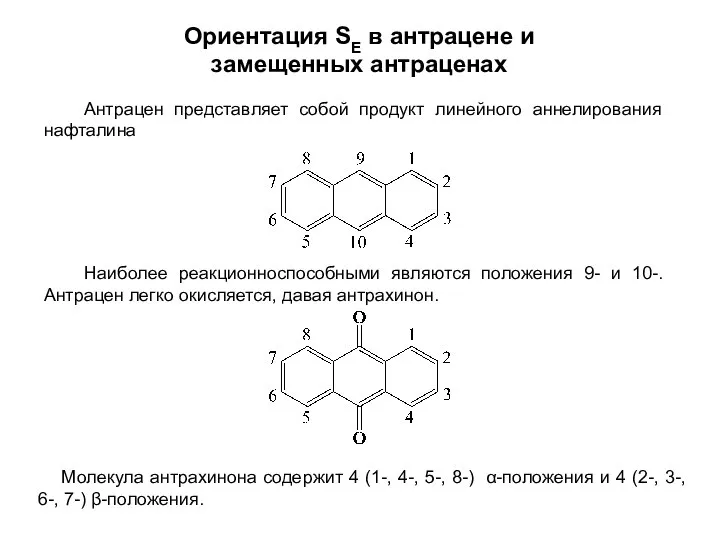
- 31. Ориентация SE в антрацене и замещенных антраценах Наиболее реакционноспособными являются положения 9- и 10-. Антрацен легко
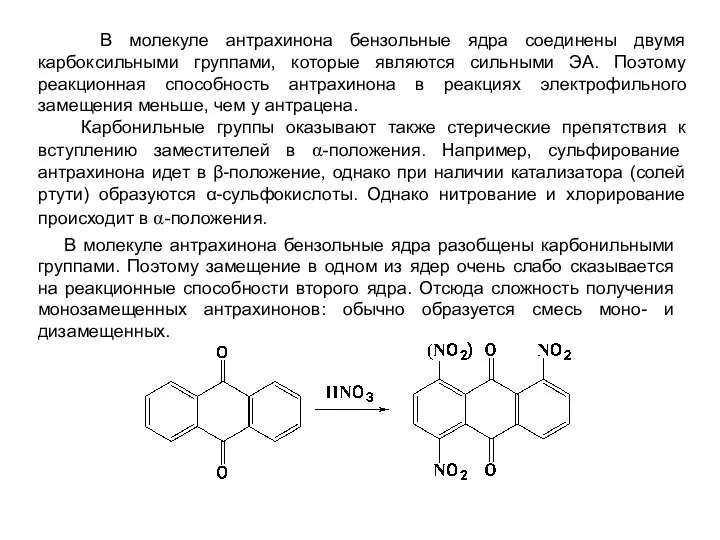
- 32. В молекуле антрахинона бензольные ядра соединены двумя карбоксильными группами, которые являются сильными ЭА. Поэтому реакционная способность
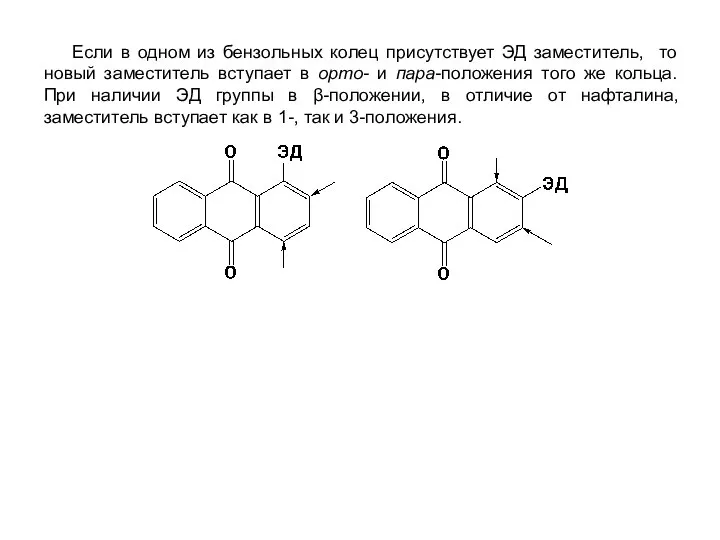
- 33. Если в одном из бензольных колец присутствует ЭД заместитель, то новый заместитель вступает в орто- и
- 35. Скачать презентацию










 Тригонометрические неравенства
Тригонометрические неравенства Анализ кадровой политики ОАО «РУСАЛ-ИркАЗ»
Анализ кадровой политики ОАО «РУСАЛ-ИркАЗ» Язык программирования С++. Указатель. Массив и указатель. Арифметика для указателей
Язык программирования С++. Указатель. Массив и указатель. Арифметика для указателей Волжская Булгария
Волжская Булгария Проектная деятельность в учебном процессе Подготовила учитель химии МОУ Дубровицкая СОШ Венедиктова Г.Н.
Проектная деятельность в учебном процессе Подготовила учитель химии МОУ Дубровицкая СОШ Венедиктова Г.Н. Спуски, подъемы, торможение, подъемы на лыжах
Спуски, подъемы, торможение, подъемы на лыжах Внимание: профессиональная ошибка медицинского работника!
Внимание: профессиональная ошибка медицинского работника! Выборы. Политические партии в Англии
Выборы. Политические партии в Англии Сравнение GIMP и Photoshop
Сравнение GIMP и Photoshop Методы правового регулирования информационного права
Методы правового регулирования информационного права  Основные нормативно-правовые акты, регулирующие отношение государства к лицам с ограниченными возможностями здоровья
Основные нормативно-правовые акты, регулирующие отношение государства к лицам с ограниченными возможностями здоровья зарплата
зарплата  Гибридные двигатели
Гибридные двигатели Основные правила Web-дизайна
Основные правила Web-дизайна Статистическое наблюдение
Статистическое наблюдение Конституция-основной закон РФ
Конституция-основной закон РФ  Указатель уровня топлива
Указатель уровня топлива Анаэробный распад глюкозы Глюконеогенез
Анаэробный распад глюкозы Глюконеогенез Cybersport-bootsamp
Cybersport-bootsamp Презентация Экономическая сущность и значение материальных запасов
Презентация Экономическая сущность и значение материальных запасов Современные религиозные проблемы
Современные религиозные проблемы Производственная мощность1
Производственная мощность1 Организация пользовательского приемочного тестирования (UAT) в крупном проекте Александр Башарин. Перфоманс лаб.
Организация пользовательского приемочного тестирования (UAT) в крупном проекте Александр Башарин. Перфоманс лаб. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ
РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ 1 сентября Визит министра образования и науки РФ ДМИТРИЯ ЛИВАНОВА
1 сентября Визит министра образования и науки РФ ДМИТРИЯ ЛИВАНОВА Презентация Правовая характеристика, виды и особенности экологической экспертизы
Презентация Правовая характеристика, виды и особенности экологической экспертизы  Информационные технологии в защите баз данных таможенных органов в свете вступления России в ВТО Студентка 2 курса Экономическо
Информационные технологии в защите баз данных таможенных органов в свете вступления России в ВТО Студентка 2 курса Экономическо Жанғыш сұйықтықтар температурасы
Жанғыш сұйықтықтар температурасы