Содержание
- 2. На скорость и механизм реакции SN определяющее влияние оказывают: - нуклеофильная способность (нуклеофильность) реагента Y; -
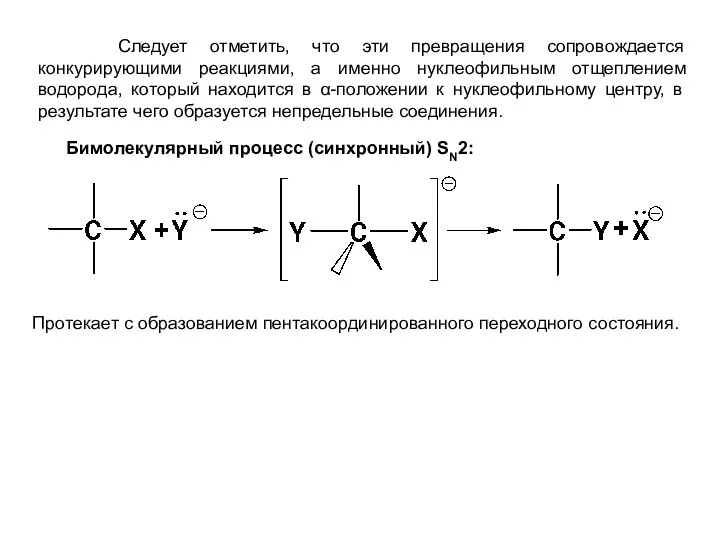
- 3. Следует отметить, что эти превращения сопровождается конкурирующими реакциями, а именно нуклеофильным отщеплением водорода, который находится в
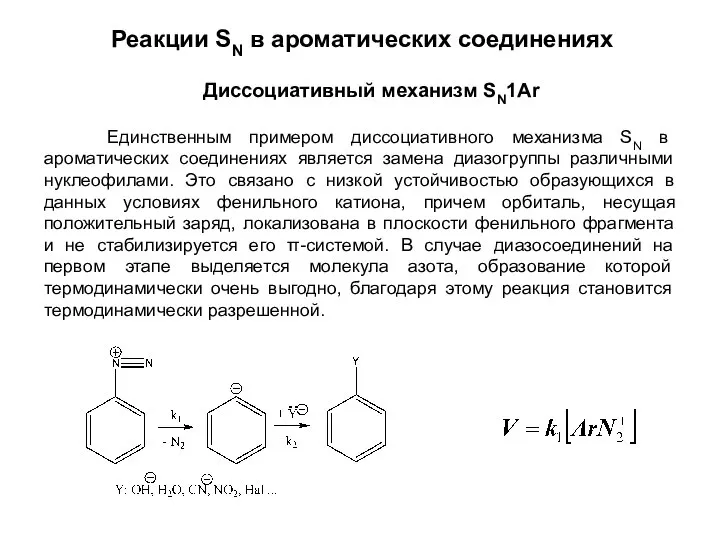
- 4. Диссоциативный механизм SN1Ar Реакции SN в ароматических соединениях Единственным примером диссоциативного механизма SN в ароматических соединениях
- 5. Присутствие в диазосоединениях как ЭД, так и ЭА заместителей существенно замедляет скорость реакции. Это происходит из-за
- 6. Реакции SN в ароматических соединениях К такому типу реакций SN относятся превращения, в которых новая связь
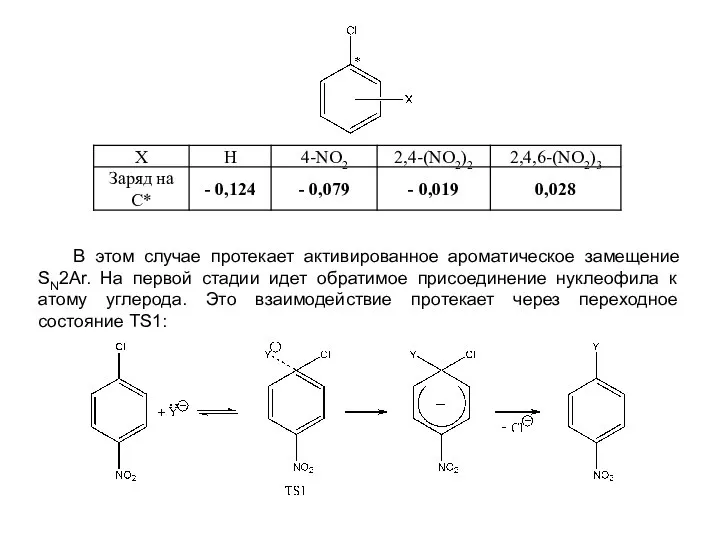
- 7. В этом случае протекает активированное ароматическое замещение SN2Аr. На первой стадии идет обратимое присоединение нуклеофила к
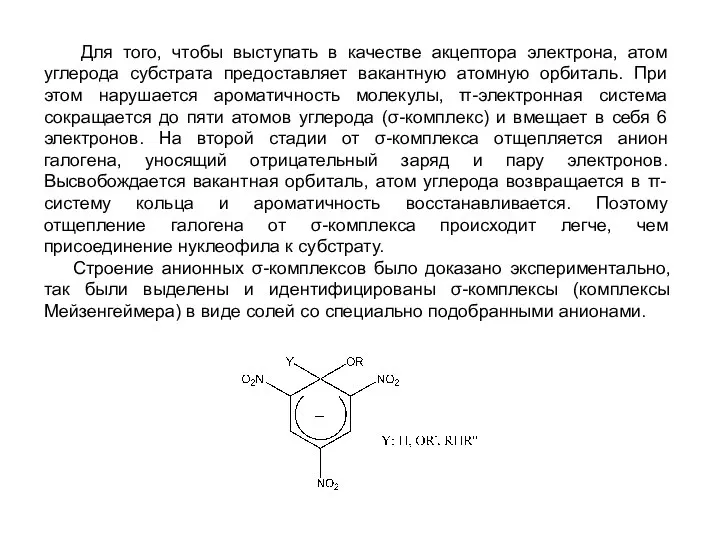
- 8. Для того, чтобы выступать в качестве акцептора электрона, атом углерода субстрата предоставляет вакантную атомную орбиталь. При
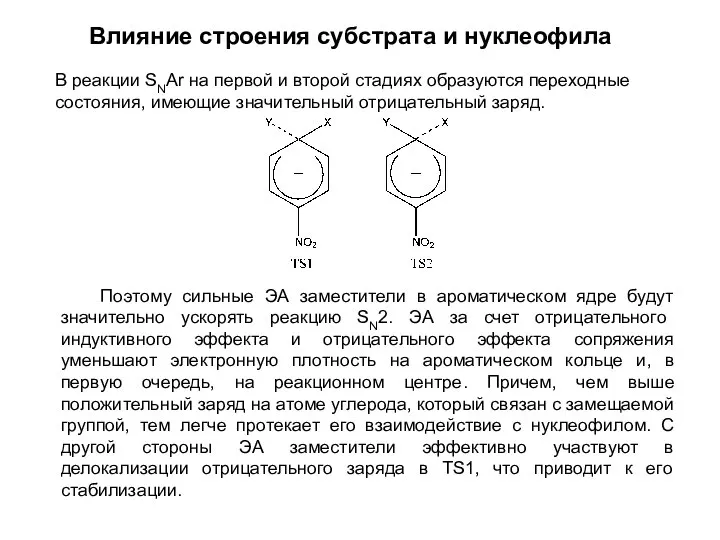
- 9. Влияние строения субстрата и нуклеофила В реакции SNАr на первой и второй стадиях образуются переходные состояния,
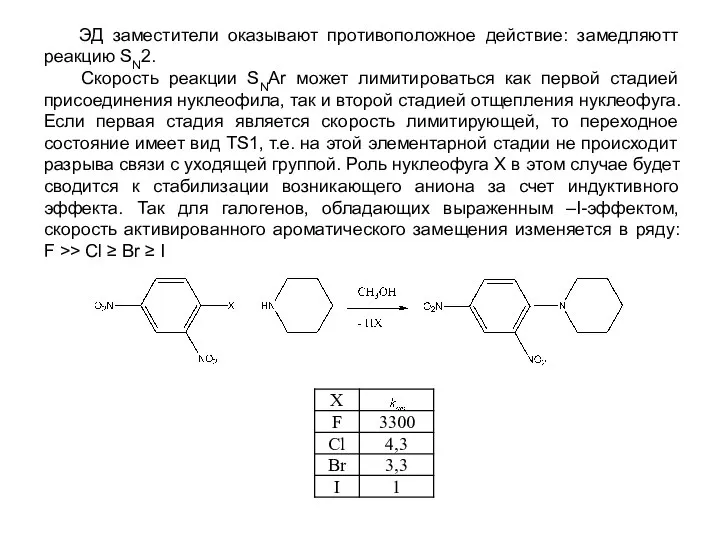
- 10. ЭД заместители оказывают противоположное действие: замедляютт реакцию SN2. Скорость реакции SNАr может лимитироваться как первой стадией
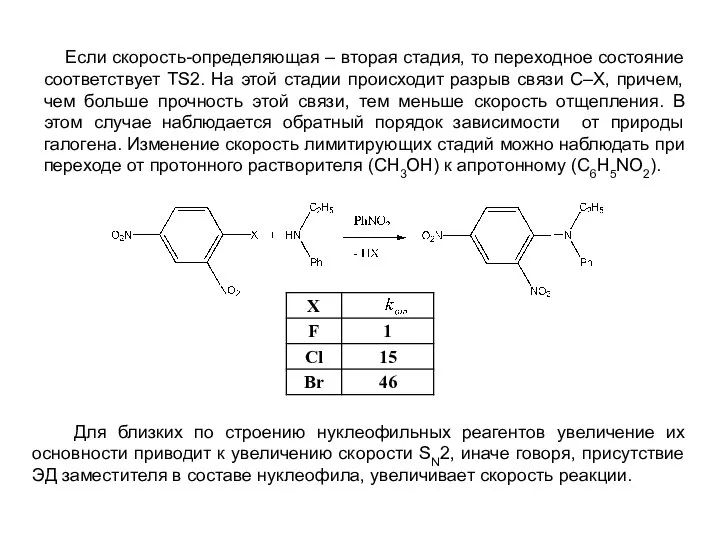
- 11. Если скорость-определяющая – вторая стадия, то переходное состояние соответствует ТS2. На этой стадии происходит разрыв связи
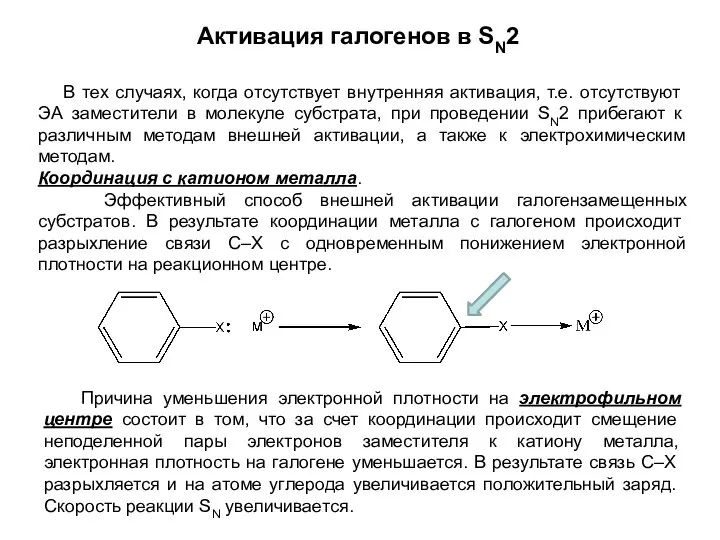
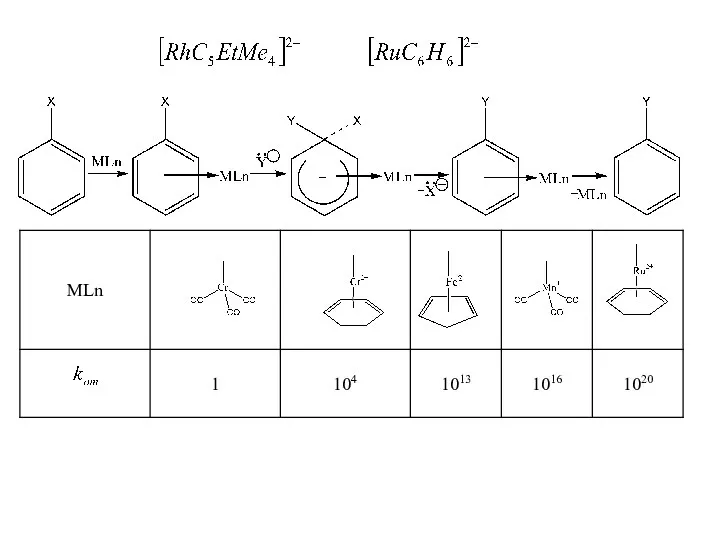
- 12. Активация галогенов в SN2 В тех случаях, когда отсутствует внутренняя активация, т.е. отсутствуют ЭА заместители в
- 13. Лучшим катализатором являнтся катион меди. Скорость реакции в его присутствии возрастает в 7-9 раз. Если в
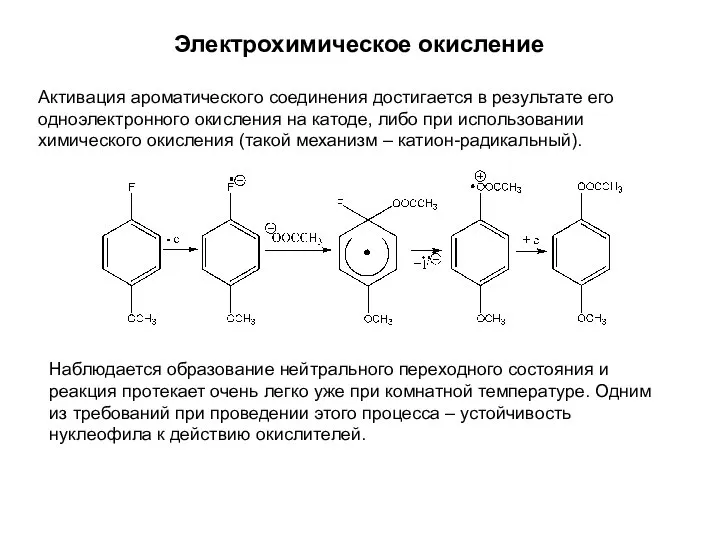
- 15. Электрохимическое окисление Активация ароматического соединения достигается в результате его одноэлектронного окисления на катоде, либо при использовании
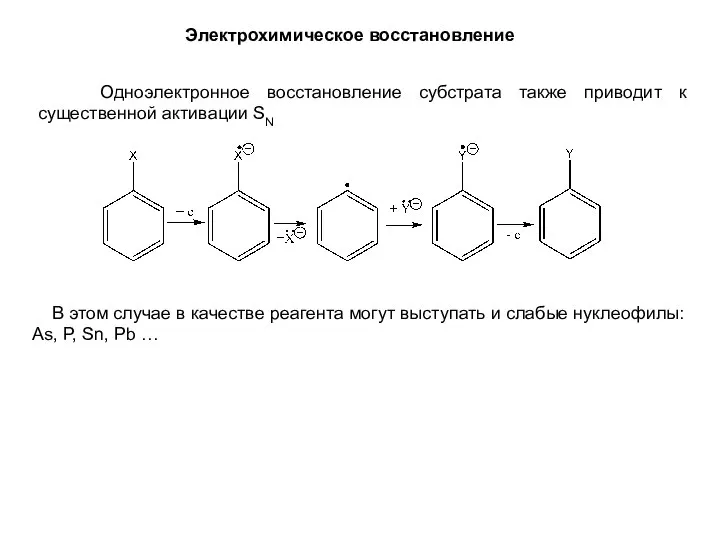
- 16. Электрохимическое восстановление Одноэлектронное восстановление субстрата также приводит к существенной активации SN В этом случае в качестве
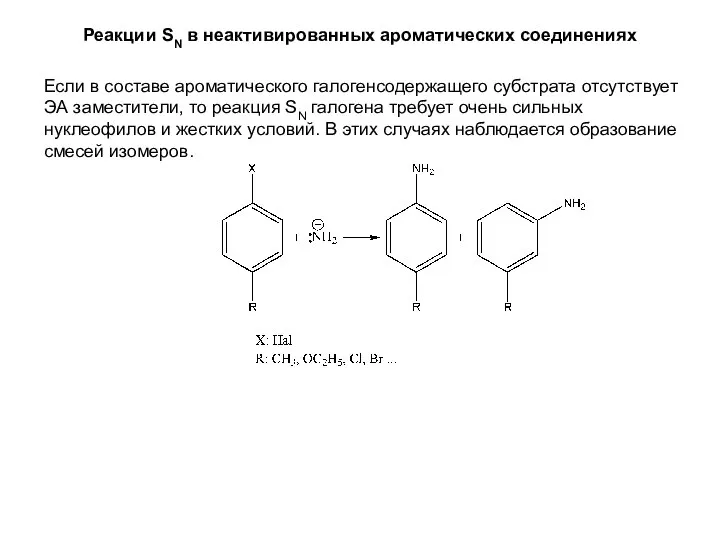
- 17. Реакции SN в неактивированных ароматических соединениях Если в составе ароматического галогенсодержащего субстрата отсутствует ЭА заместители, то
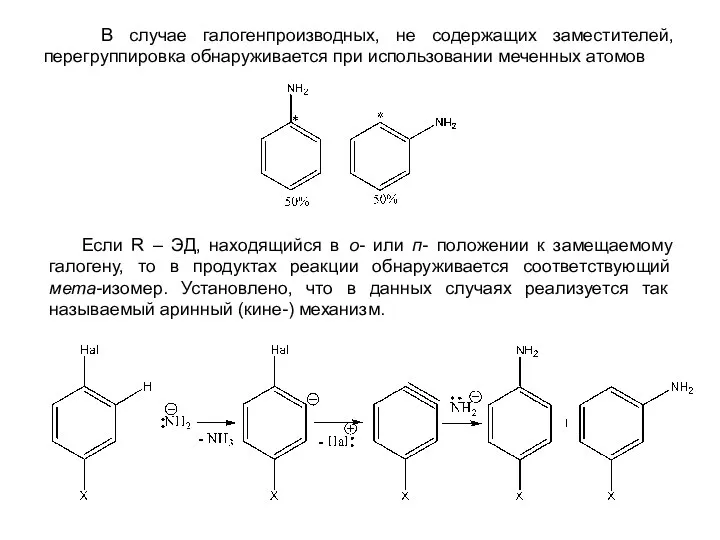
- 18. В случае галогенпроизводных, не содержащих заместителей, перегруппировка обнаруживается при использовании меченных атомов Если R – ЭД,
- 19. Образование в ходе реакции дегидроарина, являющегося диенофилом, подтверждено его фиксацией в виде продуктов присоединения с такими
- 22. Скачать презентацию






 Professional etiquette
Professional etiquette Команда SIFE КНЭУ на Мировом Кубке в Сингапуре
Команда SIFE КНЭУ на Мировом Кубке в Сингапуре Эволюция права собственности в Новейшее время (Запад)
Эволюция права собственности в Новейшее время (Запад) Система команд процесора архітектури ІА-32
Система команд процесора архітектури ІА-32 Обобщение опыта работы учителя Методические рекомендации. Подготовила Ефимова Г.В., заместитель директора по УВР.
Обобщение опыта работы учителя Методические рекомендации. Подготовила Ефимова Г.В., заместитель директора по УВР. Основы теории судна
Основы теории судна 7 класс
7 класс  Великий шелковый путь – великий путь межкультурной коммуникации
Великий шелковый путь – великий путь межкультурной коммуникации Наблюдение командования воинской части
Наблюдение командования воинской части Стандарт как элемент промышленной политики
Стандарт как элемент промышленной политики МЕЖДУНАРОДНЫЕ ВЫСТАВКИ КАК ФАКТОР ФОРМИРОВАНИЯ И РЕАЛИЗАЦИИ ЭКСПОРТНОГО ПОТЕНЦИАЛА ПРОМЫШЛЕННЫХ ПРЕДПРИЯТИЙ
МЕЖДУНАРОДНЫЕ ВЫСТАВКИ КАК ФАКТОР ФОРМИРОВАНИЯ И РЕАЛИЗАЦИИ ЭКСПОРТНОГО ПОТЕНЦИАЛА ПРОМЫШЛЕННЫХ ПРЕДПРИЯТИЙ Олимпиада на карте мира
Олимпиада на карте мира Отклонения и допуски расположения рассматриваемого элемента (ГОСТ 24642-83)
Отклонения и допуски расположения рассматриваемого элемента (ГОСТ 24642-83) Системы обслуживания заявок
Системы обслуживания заявок Дело ЕСПЧ. Hirst vs UK
Дело ЕСПЧ. Hirst vs UK (з†бвм 2)-ПРОСТОЙ КАТЕГОРИЧЕСКИЙ СИЛЛОГИЗМ
(з†бвм 2)-ПРОСТОЙ КАТЕГОРИЧЕСКИЙ СИЛЛОГИЗМ Обобщение и сжатие данных
Обобщение и сжатие данных Место РПрдУ в радиосистеме
Место РПрдУ в радиосистеме Геополитические конфликты
Геополитические конфликты Презентация на тему: Зачем нужна экономика
Презентация на тему: Зачем нужна экономика Сигнализация на ССОП
Сигнализация на ССОП Презентация «Предпосылки образования Древнерусского государства»
Презентация «Предпосылки образования Древнерусского государства» Легко ли быть очкариком? - презентация для начальной школы_
Легко ли быть очкариком? - презентация для начальной школы_ Векторная алгебра.Линейные операции над векторами
Векторная алгебра.Линейные операции над векторами СОЗДАНИЕ ЛИДЕРА МИРОВОЙ АЛЮМИНИЕВОЙ ОТРАСЛИ
СОЗДАНИЕ ЛИДЕРА МИРОВОЙ АЛЮМИНИЕВОЙ ОТРАСЛИ Путешествие в эпоху Возрождения (образование и воспитание)
Путешествие в эпоху Возрождения (образование и воспитание) Проект «Спортивный интерес»
Проект «Спортивный интерес» Контроль над стратегическими наступательными и оборонительными вооружениями РФ и США
Контроль над стратегическими наступательными и оборонительными вооружениями РФ и США