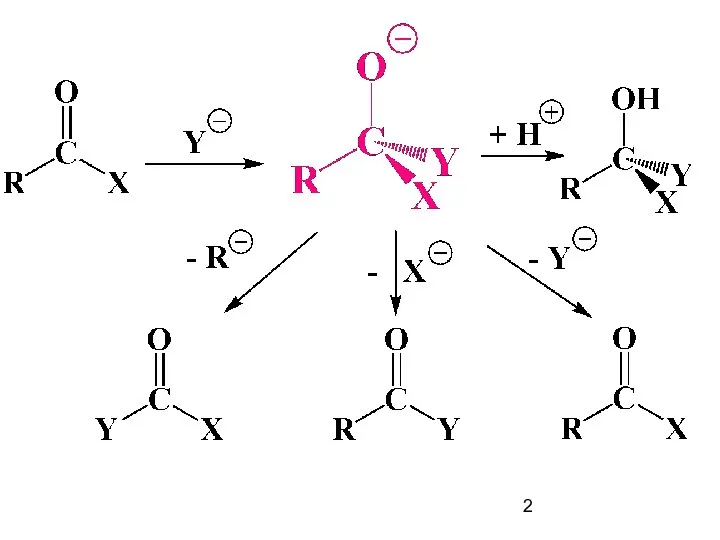
Содержание
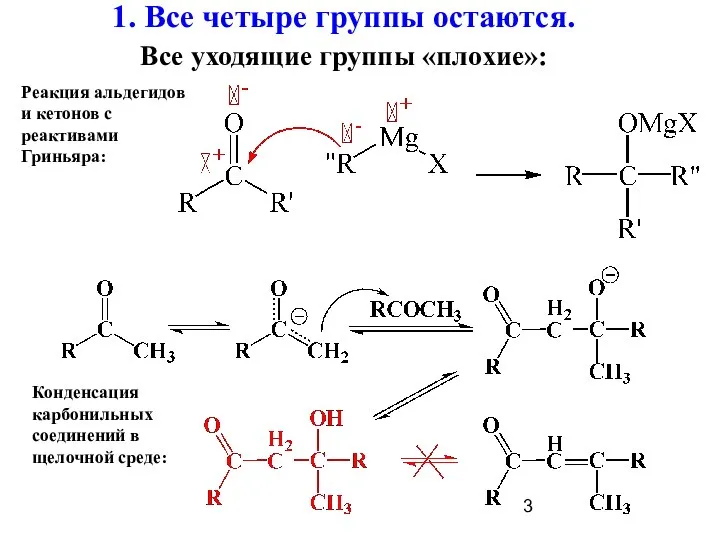
- 3. 1. Все четыре группы остаются. Все уходящие группы «плохие»: Реакция альдегидов и кетонов с реактивами Гриньяра:
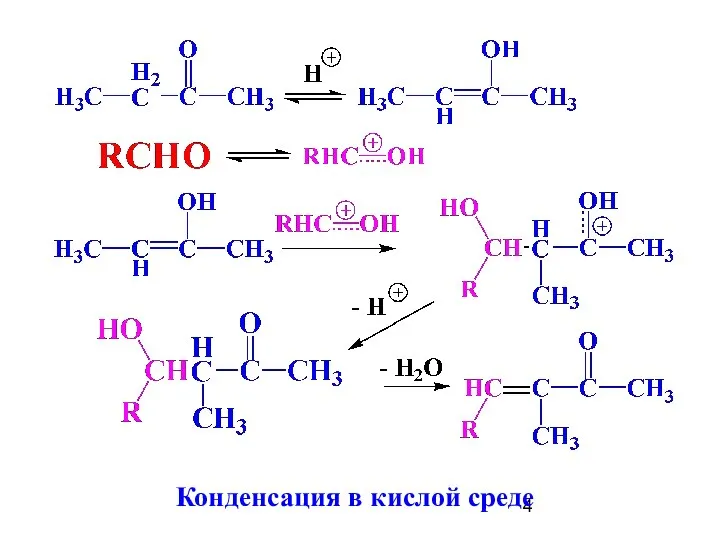
- 4. Конденсация в кислой среде
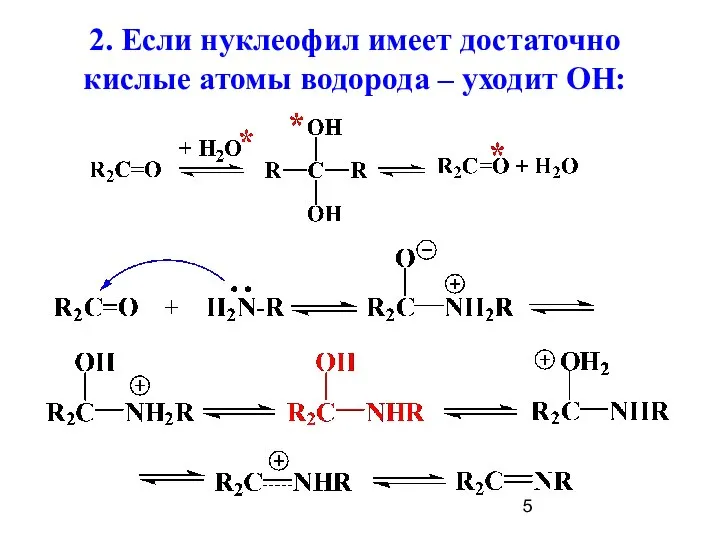
- 5. 2. Если нуклеофил имеет достаточно кислые атомы водорода – уходит ОН:
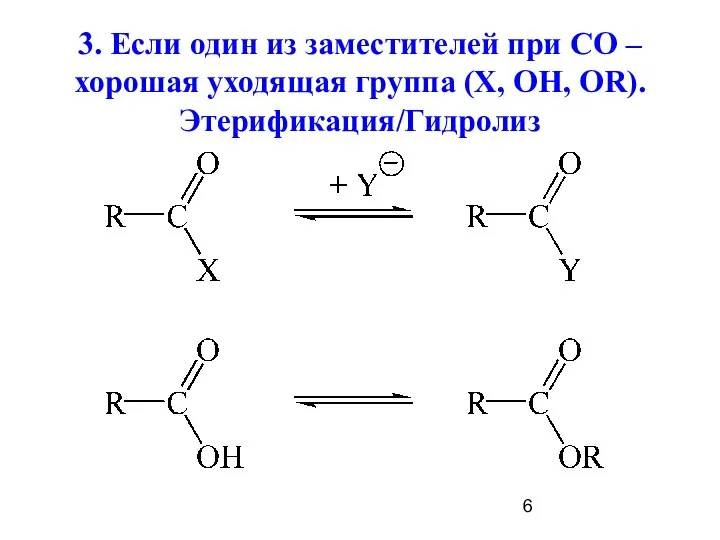
- 6. 3. Если один из заместителей при СО – хорошая уходящая группа (X, OH, OR). Этерификация/Гидролиз
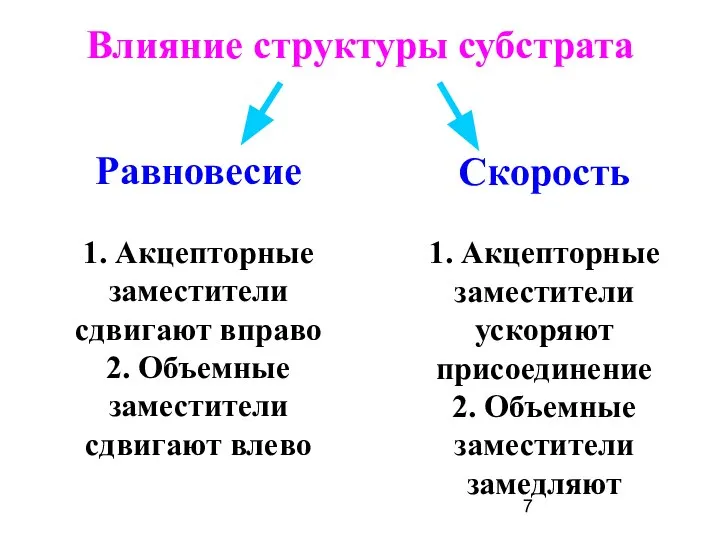
- 7. Влияние структуры субстрата Равновесие 1. Акцепторные заместители сдвигают вправо 2. Объемные заместители сдвигают влево Скорость 1.
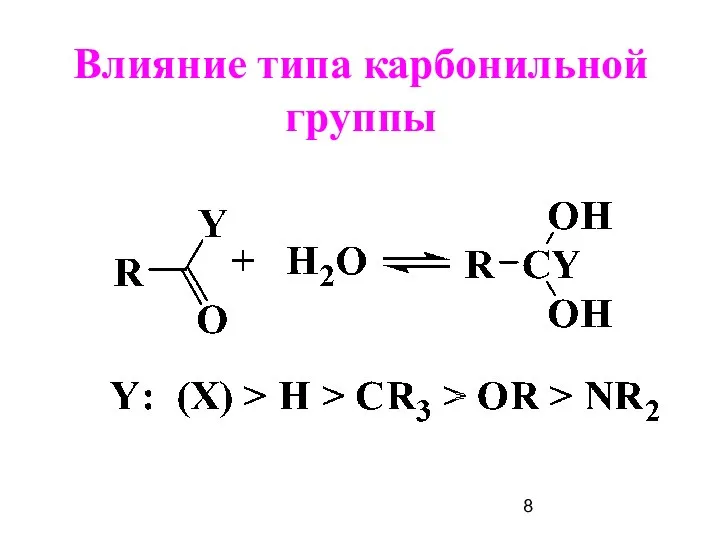
- 8. Влияние типа карбонильной группы
- 9. Влияние полярного эффекта заместителей в субстрате Кравновесия присоединения
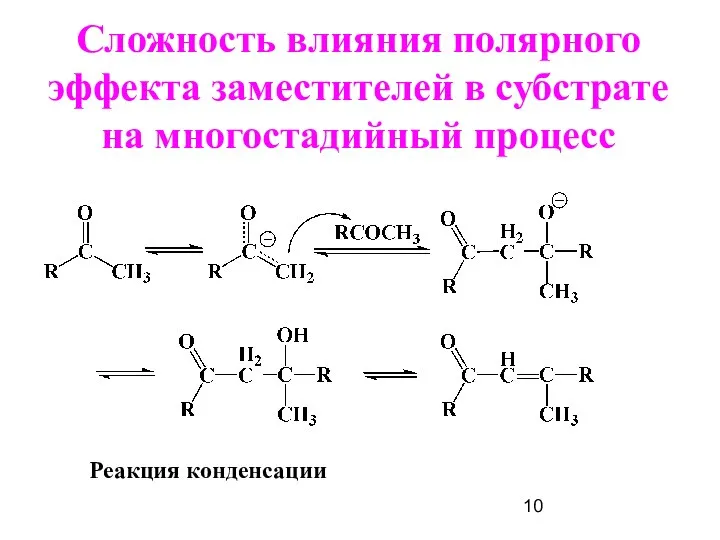
- 10. Сложность влияния полярного эффекта заместителей в субстрате на многостадийный процесс Реакция конденсации
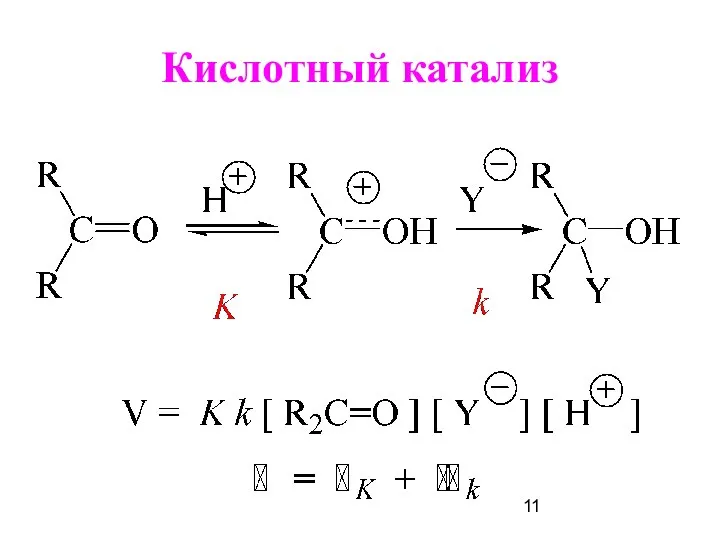
- 11. Кислотный катализ
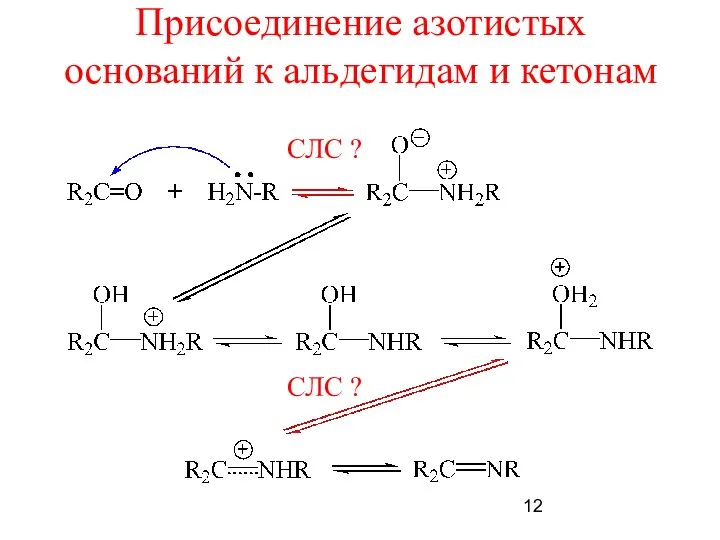
- 12. Присоединение азотистых оснований к альдегидам и кетонам СЛС ? СЛС ?
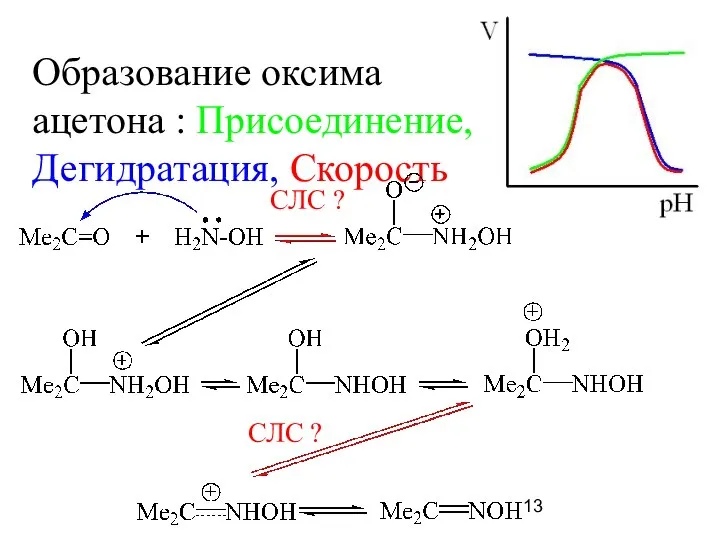
- 13. Образование оксима ацетона : Присоединение, Дегидратация, Скорость СЛС ? СЛС ?
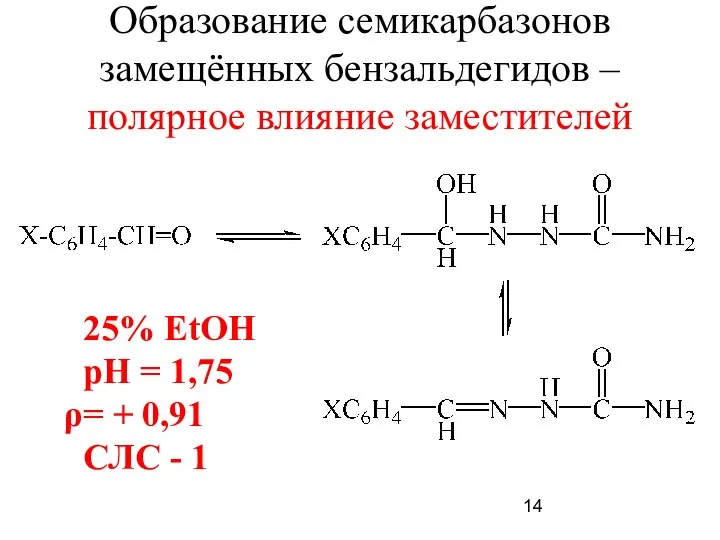
- 14. Образование семикарбазонов замещённых бензальдегидов – полярное влияние заместителей 25% EtOH pH = 1,75 = + 0,91
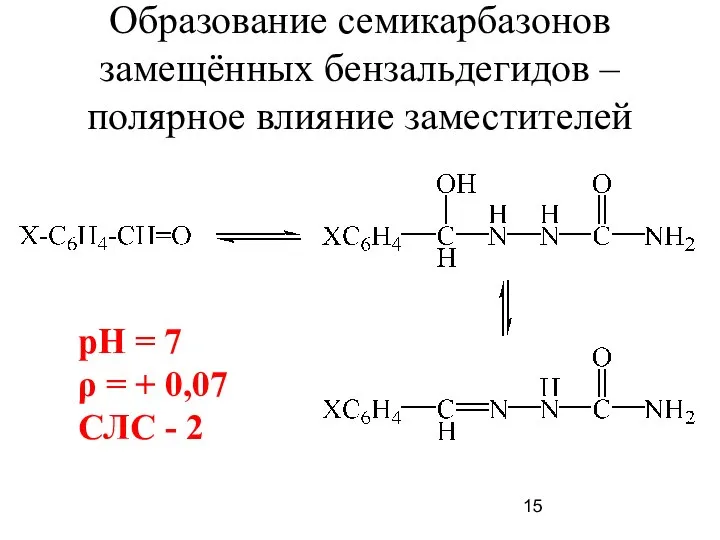
- 15. Образование семикарбазонов замещённых бензальдегидов – полярное влияние заместителей pH = 7 ρ = + 0,07 СЛС
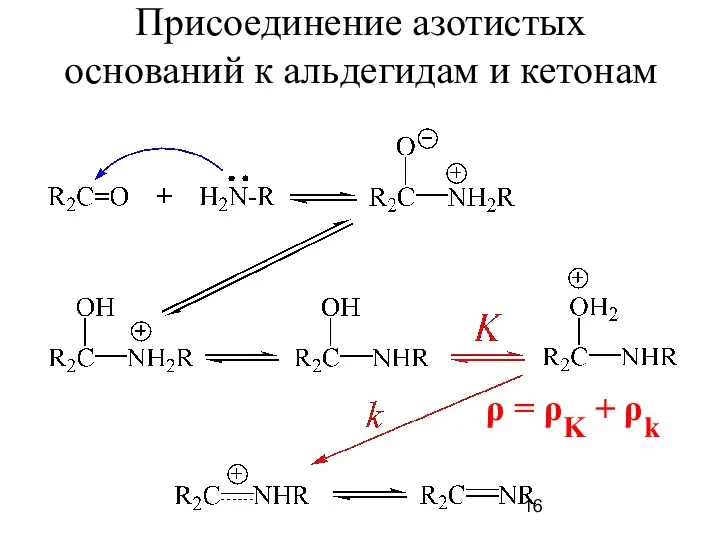
- 16. Присоединение азотистых оснований к альдегидам и кетонам ρ = ρK + ρk
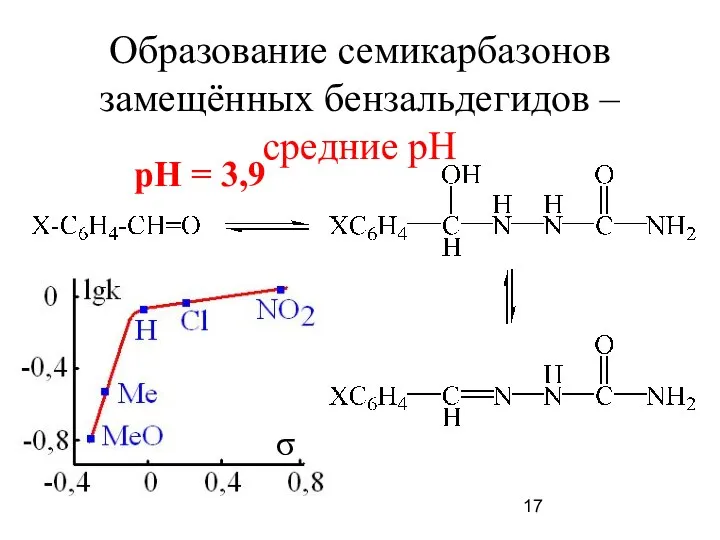
- 17. Образование семикарбазонов замещённых бензальдегидов – средние рН σ pH = 3,9
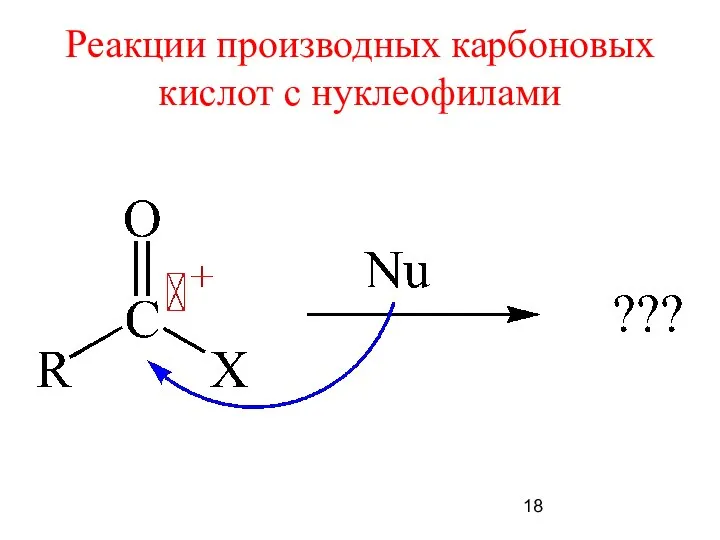
- 18. Реакции производных карбоновых кислот с нуклеофилами
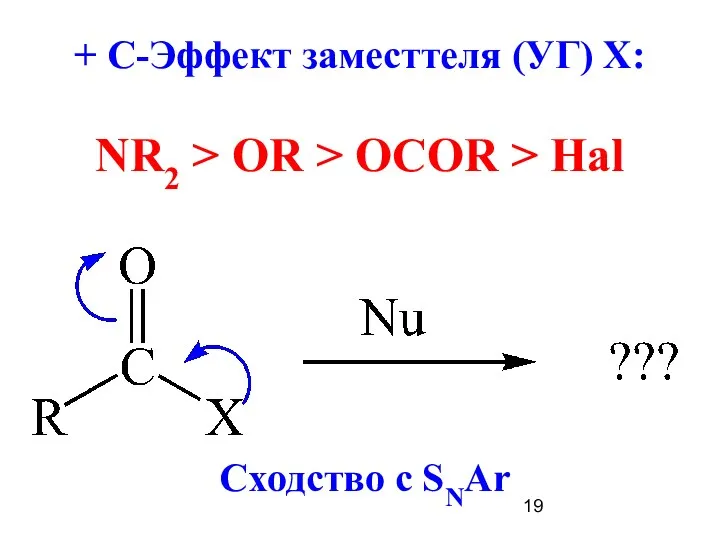
- 19. + С-Эффект заместтеля (УГ) Х: NR2 > OR > OCOR > Hal Сходство с SNAr
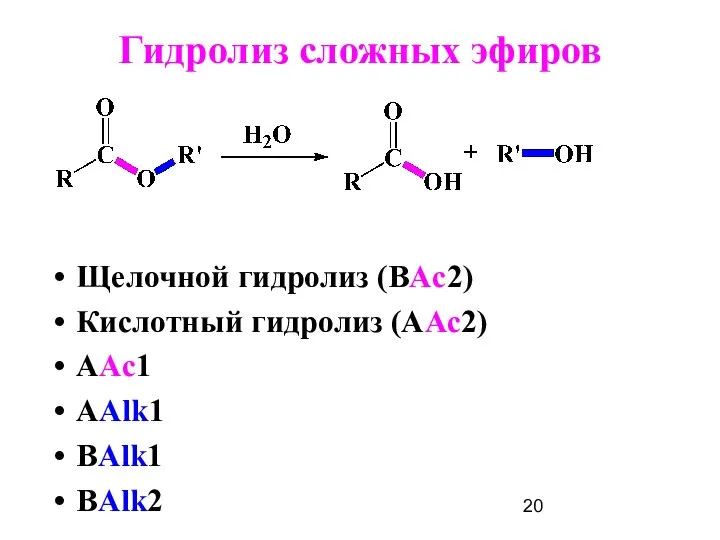
- 20. Гидролиз сложных эфиров Щелочной гидролиз (BAс2) Кислотный гидролиз (ААс2) ААс1 ААlk1 BAlk1 BAlk2
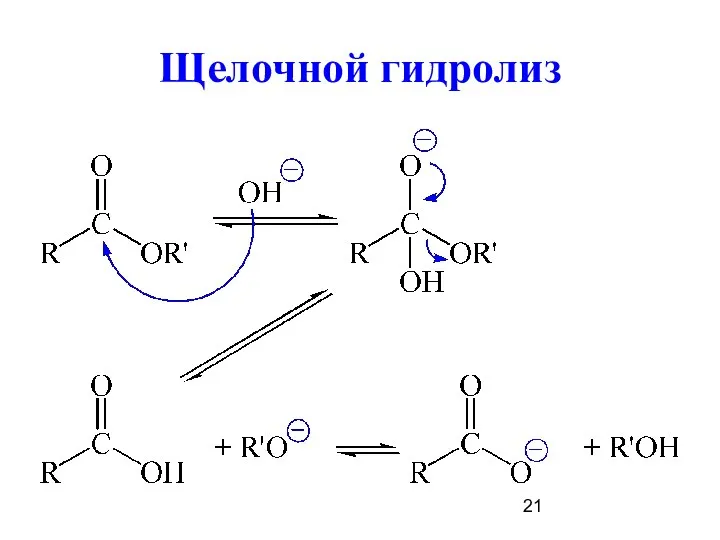
- 21. Щелочной гидролиз
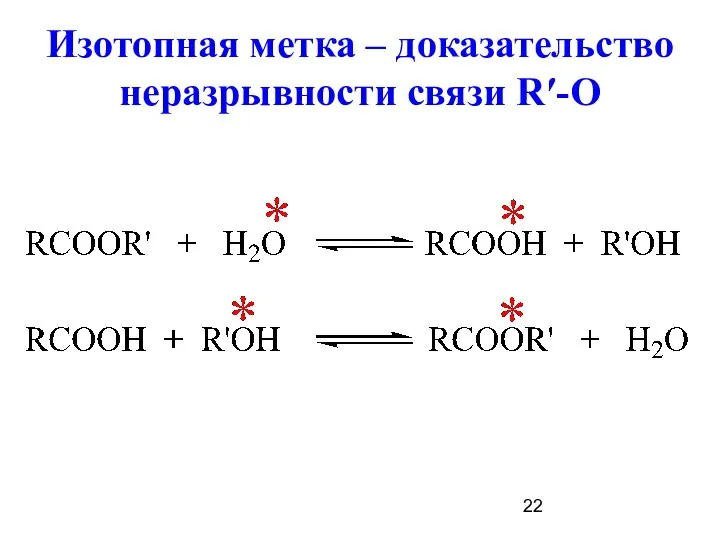
- 22. Изотопная метка – доказательство неразрывности связи R′-О
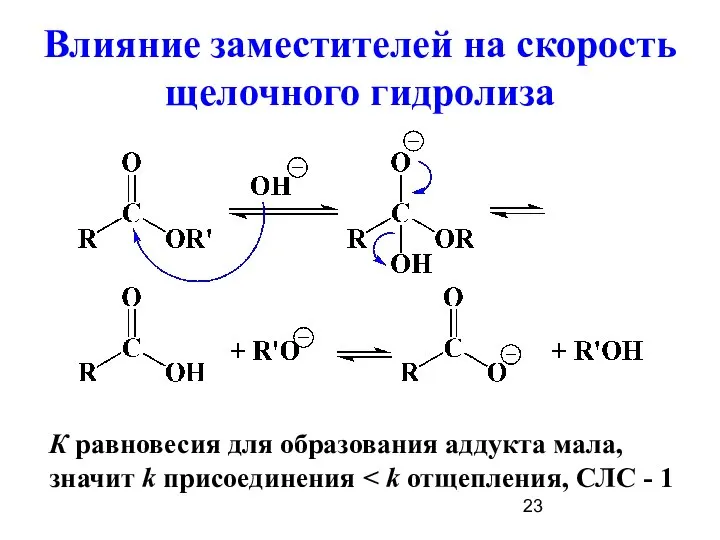
- 23. Влияние заместителей на скорость щелочного гидролиза К равновесия для образования аддукта мала, значит k присоединения
- 24. Электронное влияние заместителей на скорость щелочного гидролиза Акцепторы и в спиртовой, и в кислотной части эфира
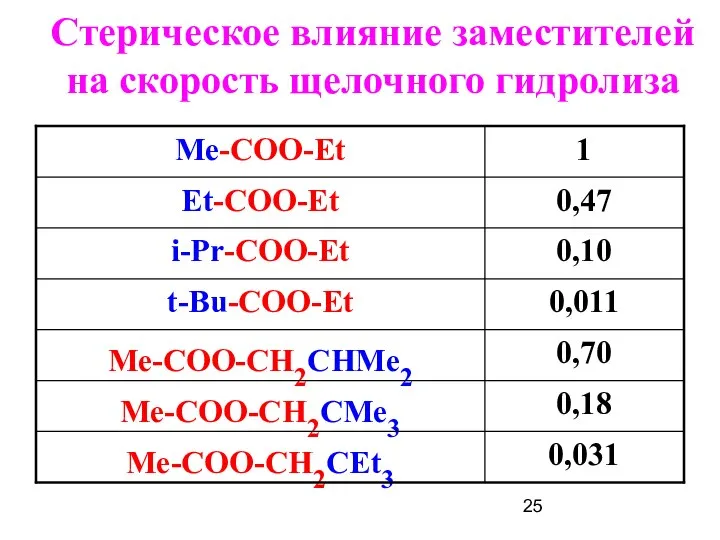
- 25. Стерическое влияние заместителей на скорость щелочного гидролиза
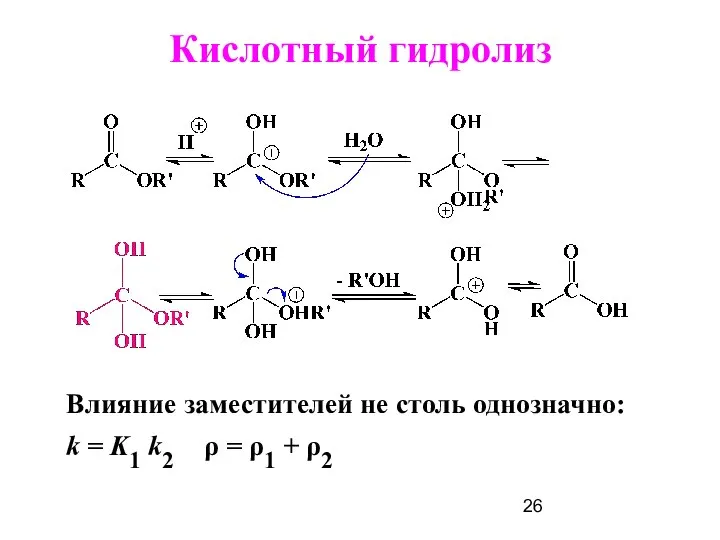
- 26. Влияние заместителей не столь однозначно: k = K1 k2 ρ = ρ1 + ρ2 Кислотный гидролиз
- 27. Полярное влияние заместителей при кислотном гидролизе
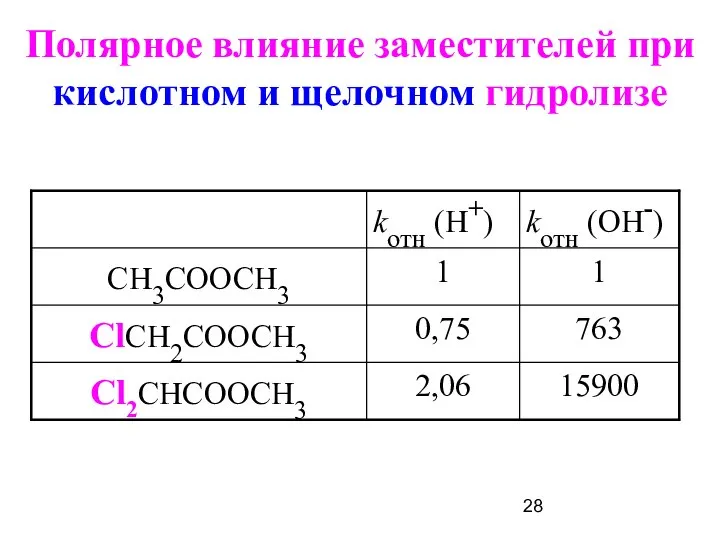
- 28. Полярное влияние заместителей при кислотном и щелочном гидролизе
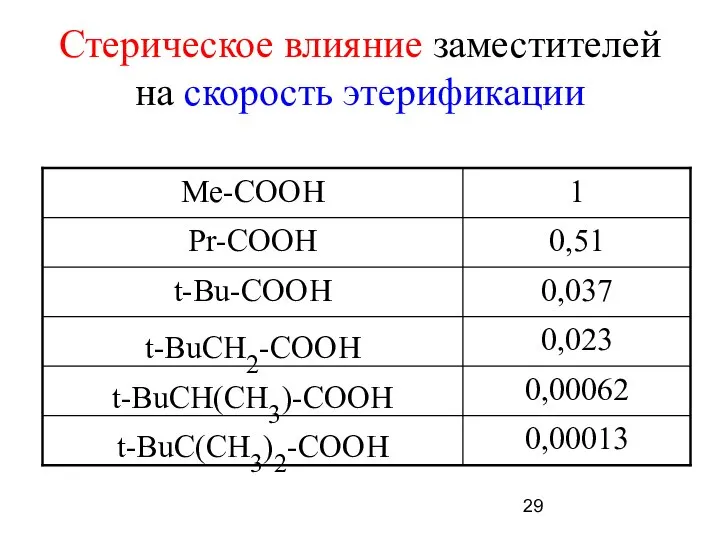
- 29. Стерическое влияние заместителей на скорость этерификации
- 30. Стерические и индуктивные коснтанты Тафта Кислотный гидролиз – слабое электронное влияние заместителей Кислотный гидролиз – сильное
- 31. Стерические и индуктивные коснтанты Тафта Стерические константы – относительные скорости кислотного гидролиза этиловых эфиров Индуктивные коснтанты
- 32. «Редкие» механизмы гидролиза сложных эфиров ААс1 ААlk1 BAlk1 BAlk2
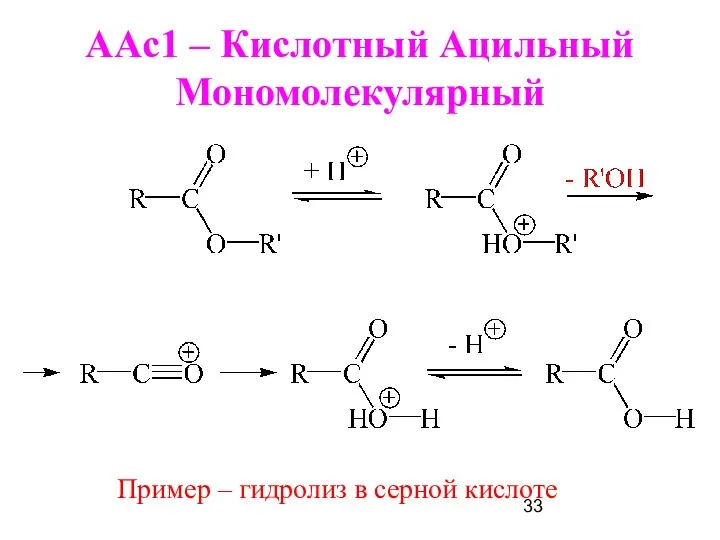
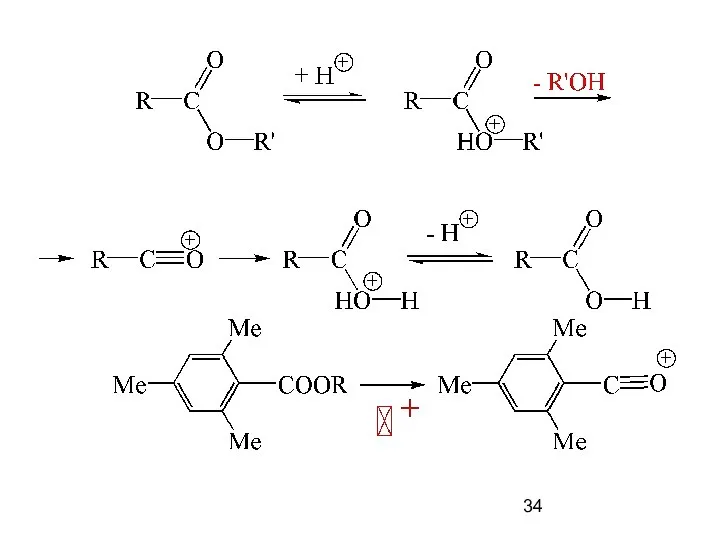
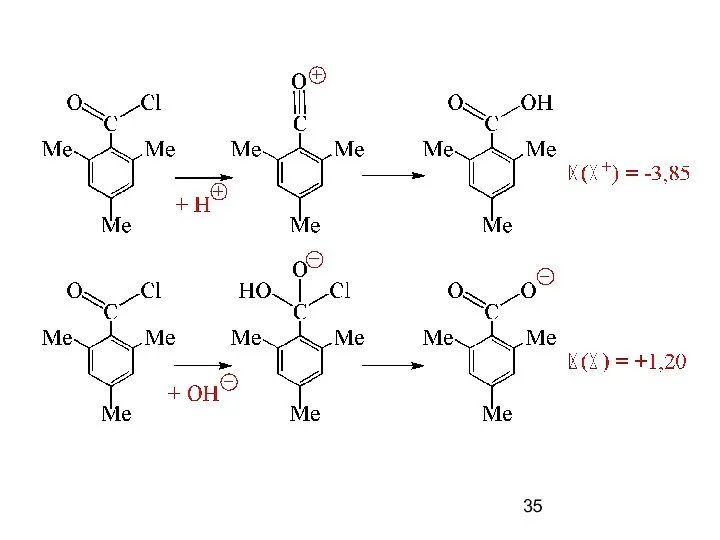
- 33. ААс1 – Кислотный Ацильный Мономолекулярный Пример – гидролиз в серной кислоте
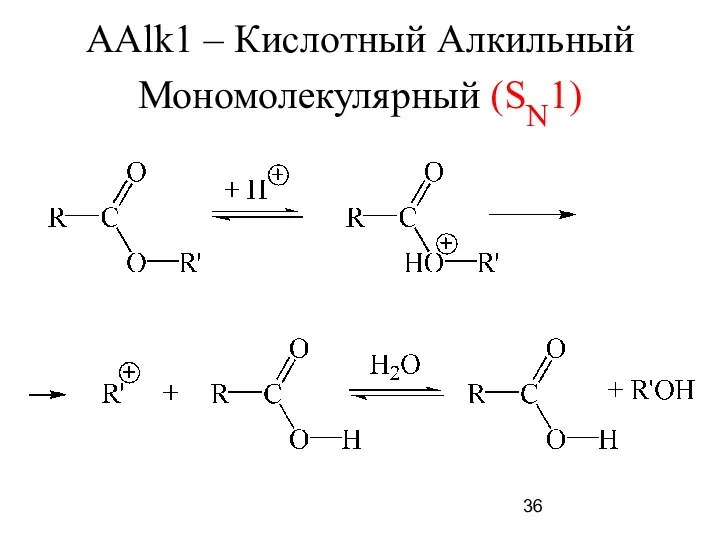
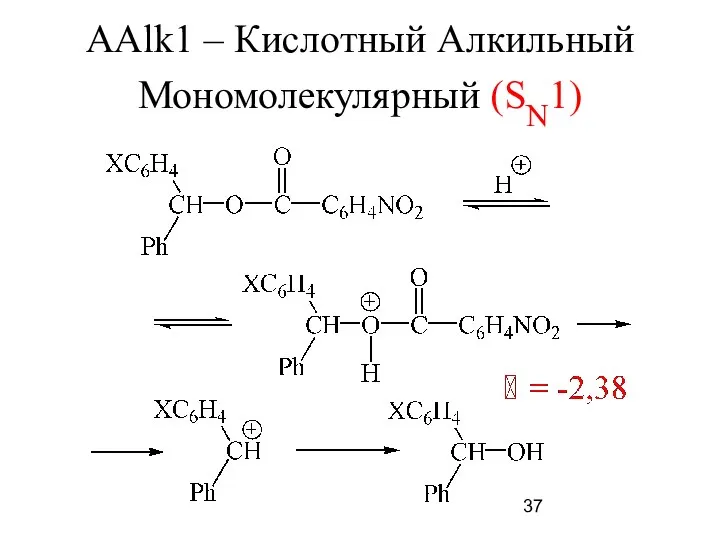
- 36. ААlk1 – Кислотный Алкильный Мономолекулярный (SN1)
- 37. ААlk1 – Кислотный Алкильный Мономолекулярный (SN1)
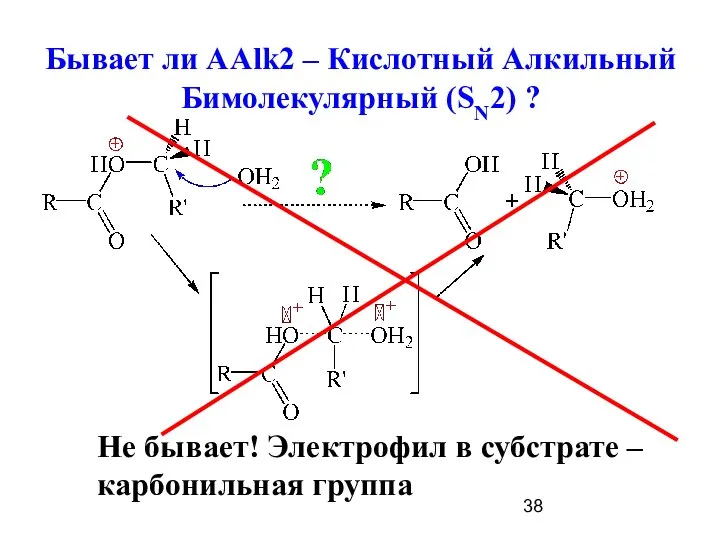
- 38. Бывает ли ААlk2 – Кислотный Алкильный Бимолекулярный (SN2) ? Не бывает! Электрофил в субстрате – карбонильная
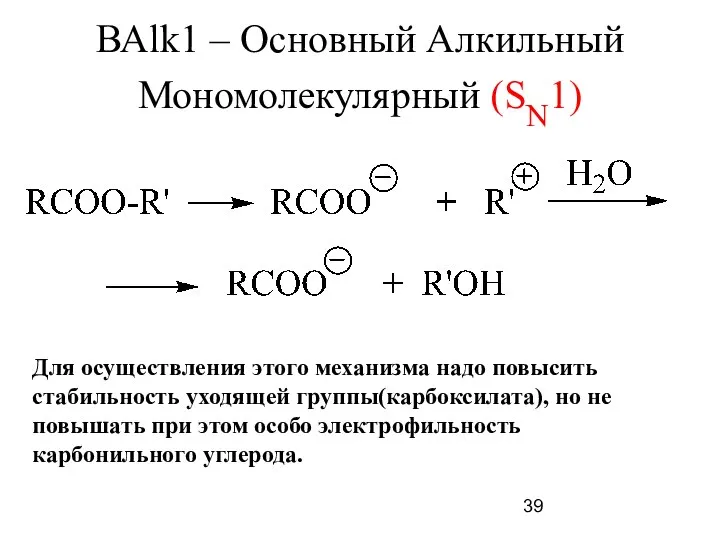
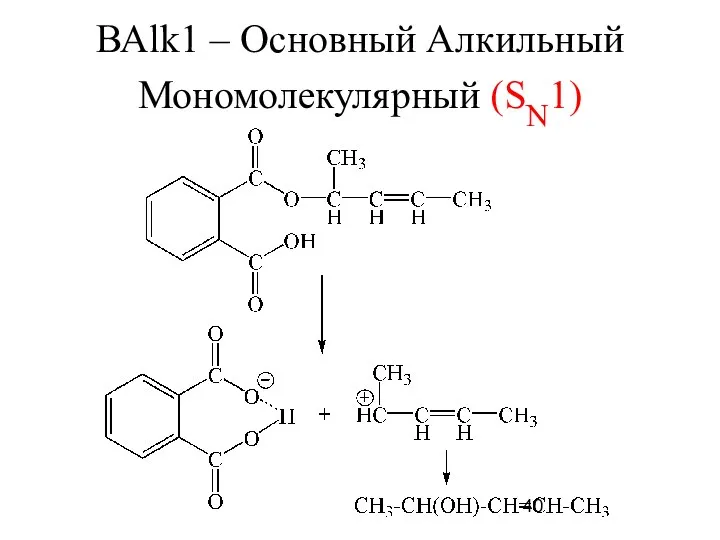
- 39. ВАlk1 – Основный Алкильный Мономолекулярный (SN1) Для осуществления этого механизма надо повысить стабильность уходящей группы(карбоксилата), но
- 40. ВАlk1 – Основный Алкильный Мономолекулярный (SN1)
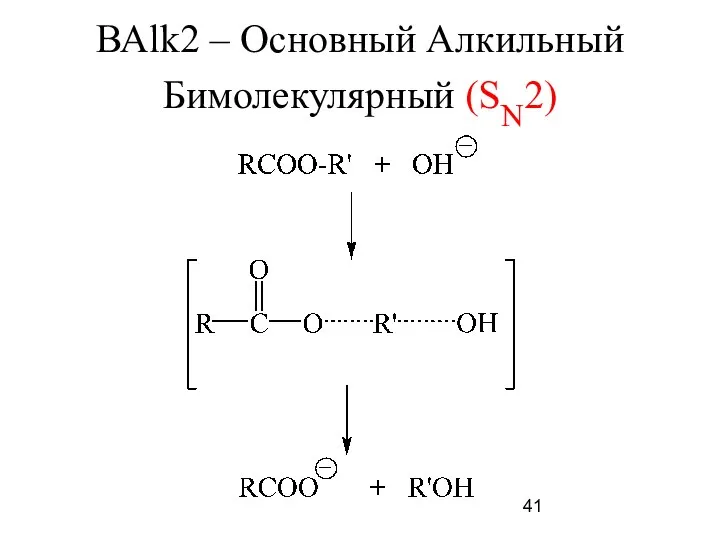
- 41. ВАlk2 – Основный Алкильный Бимолекулярный (SN2)
- 43. Скачать презентацию






 "Счастливая жизнь" - международный образовательный проект
"Счастливая жизнь" - международный образовательный проект Презентация Великобритания
Презентация Великобритания Дар созидания Эстетическое формирование искусством окружающей среды
Дар созидания Эстетическое формирование искусством окружающей среды  УРОК № 118 КОРОБКА АВТОМАТ ЭЛИСОН
УРОК № 118 КОРОБКА АВТОМАТ ЭЛИСОН Этические нормы поведения в интернете
Этические нормы поведения в интернете Решение задачи Коши для систем обыкновенных ДУ
Решение задачи Коши для систем обыкновенных ДУ по теме: «Степень с рациональным показателем»
по теме: «Степень с рациональным показателем» Детекторы
Детекторы Плоская произвольная система сил (практика)
Плоская произвольная система сил (практика) Научно-методическое обеспечение процесса подготовки высококвалифицированных спортсменов
Научно-методическое обеспечение процесса подготовки высококвалифицированных спортсменов Фазы сердечного цикла. ЭКГ
Фазы сердечного цикла. ЭКГ Средства для работы в Защ реж
Средства для работы в Защ реж ОРГАНИЗАЦИЯ, ВООРУЖЕНИЕ И БОЕВАЯ ТЕХНИКА ПОДРАЗДЕЛЕНИЙ МОТОСТРЕЛКОВОГО (ТАНКОВОГО) БАТАЛЬОНА
ОРГАНИЗАЦИЯ, ВООРУЖЕНИЕ И БОЕВАЯ ТЕХНИКА ПОДРАЗДЕЛЕНИЙ МОТОСТРЕЛКОВОГО (ТАНКОВОГО) БАТАЛЬОНА Международная защита прав человека в условиях мирного и военного времени
Международная защита прав человека в условиях мирного и военного времени Презентация Таможенная конвенция о международной перевозке грузов с применением книжки МДП
Презентация Таможенная конвенция о международной перевозке грузов с применением книжки МДП  Презентация на тему "Лимфа жүйесі" - скачать презентации по Медицине
Презентация на тему "Лимфа жүйесі" - скачать презентации по Медицине Олимпийские игры от истоков до наших дней
Олимпийские игры от истоков до наших дней Презентация Ставки страховых взносов
Презентация Ставки страховых взносов Субедей-WPS Office
Субедей-WPS Office Завод FLINS
Завод FLINS  Искусство иконописи Византии
Искусство иконописи Византии Прикладная экономика Микроэкономика
Прикладная экономика Микроэкономика  Развитие творческих способностей детей посредством занятий хореографией
Развитие творческих способностей детей посредством занятий хореографией Фирма «Samsung
Фирма «Samsung  Master class de português
Master class de português Лыжный спорт
Лыжный спорт Наноэлектроника. Молекулярная электроника (макромолекулярная, органическая, полимерная)
Наноэлектроника. Молекулярная электроника (макромолекулярная, органическая, полимерная) Век портрета. Русское портретное искусство XVIII-начала XIX века
Век портрета. Русское портретное искусство XVIII-начала XIX века