Содержание
- 2. ПЛАН 9.1 Классификация и номенклатура карбоновых кислот 9.2. Электронное и пространственное строение карбоксильной группы 9.3 Реакции
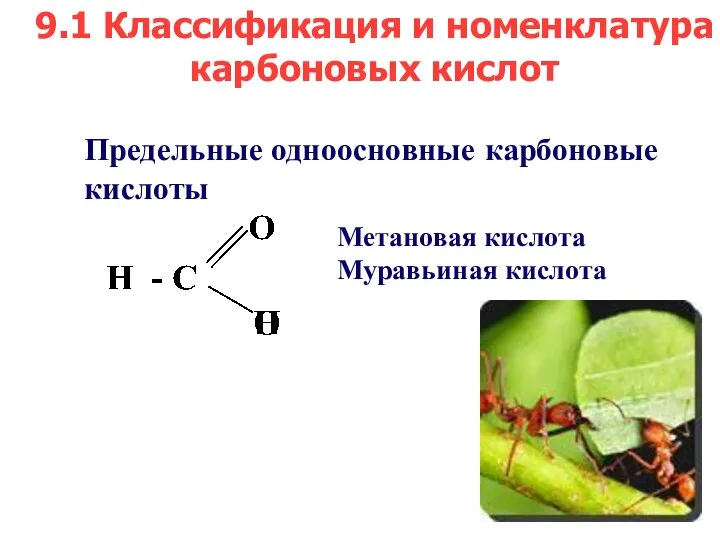
- 3. Предельные одноосновные карбоновые кислоты Метановая кислота Муравьиная кислота 9.1 Классификация и номенклатура карбоновых кислот
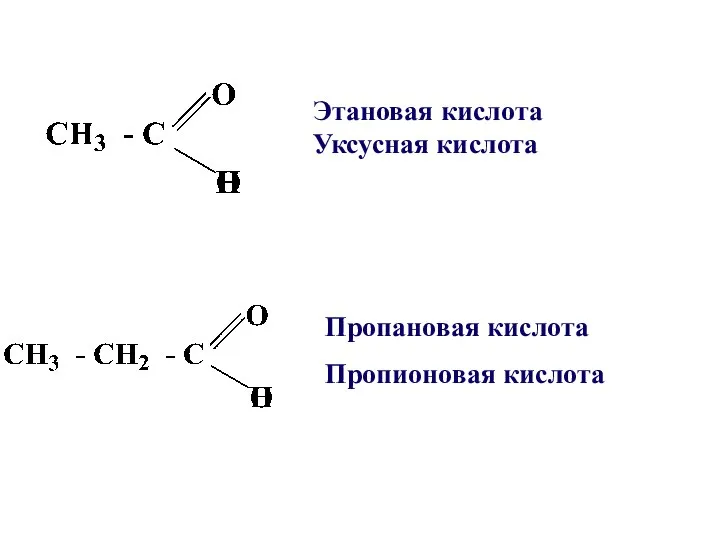
- 4. Пропановая кислота Пропионовая кислота Этановая кислота Уксусная кислота
- 5. Бутановая кислота Масляная кислота Пентановая кислота Валериановая кислота
- 6. Гексановая кислота Капроновая кислота Козы являются источником капроновой, каприловой и каприновой кислот: CH3(CH2)nCOOH n = 4,
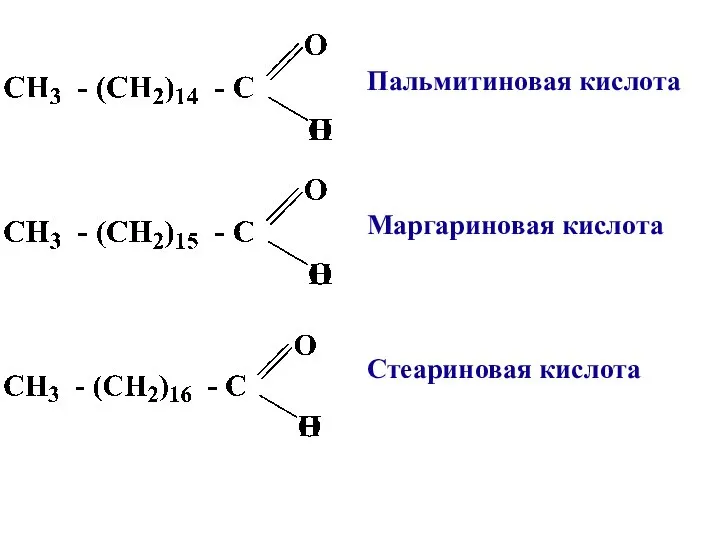
- 7. Пальмитиновая кислота Маргариновая кислота Стеариновая кислота
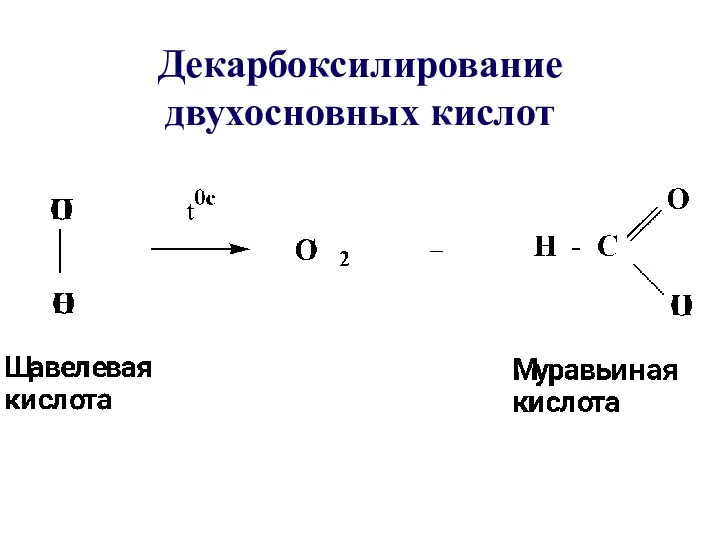
- 8. ДВУХОСНОВНЫЕ ПРЕДЕЛЬНЫЕ КИСЛОТЫ Этандиовая кислота Щавелевая кислота Пропандиовая кислота Малоновая кислота
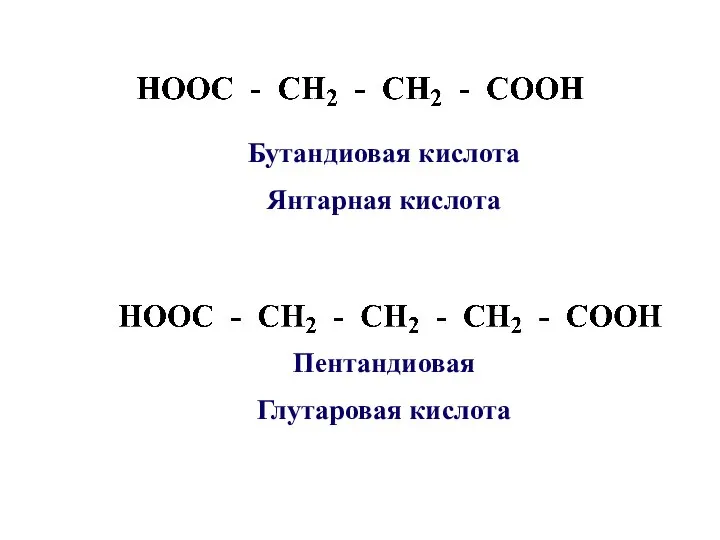
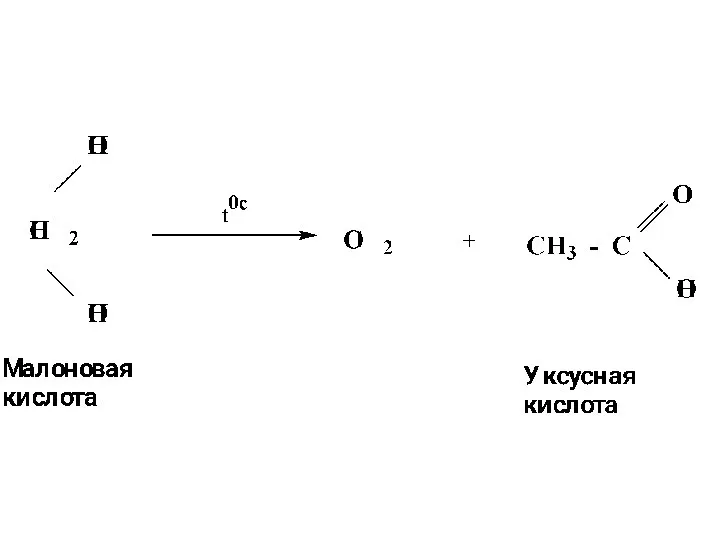
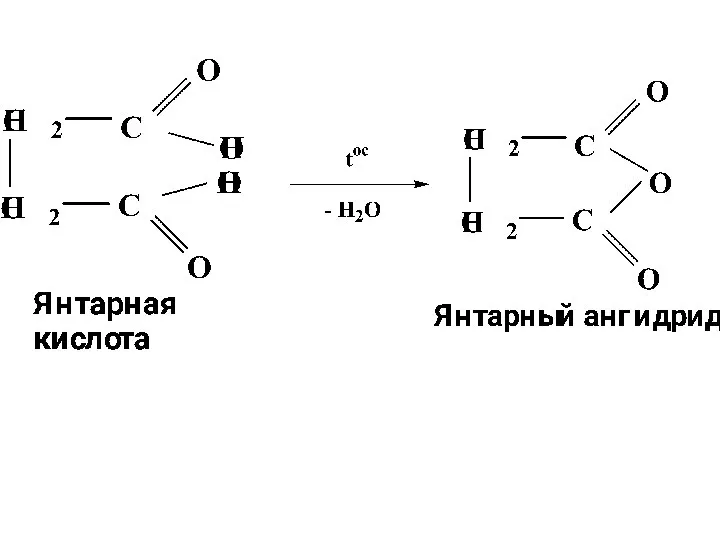
- 9. Пентандиовая Глутаровая кислота Бутандиовая кислота Янтарная кислота
- 10. Непредельные одноосновные кислоты
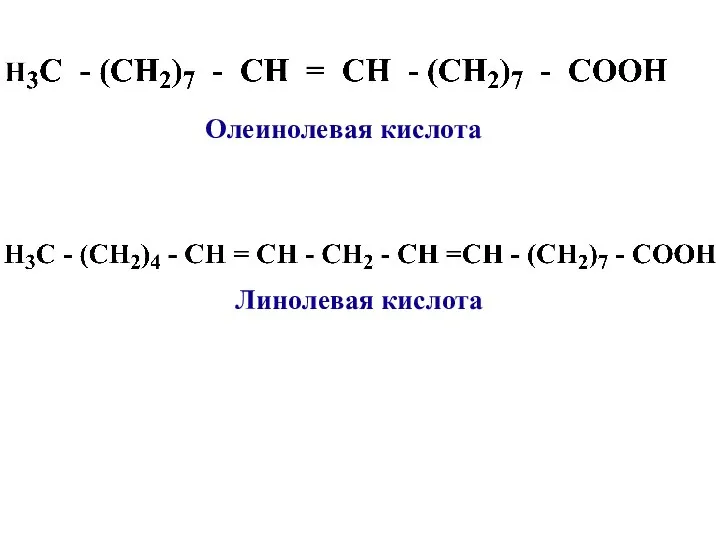
- 11. Линолевая кислота Олеинолевая кислота
- 12. Линоленовая кислота Арахидоновая кислота
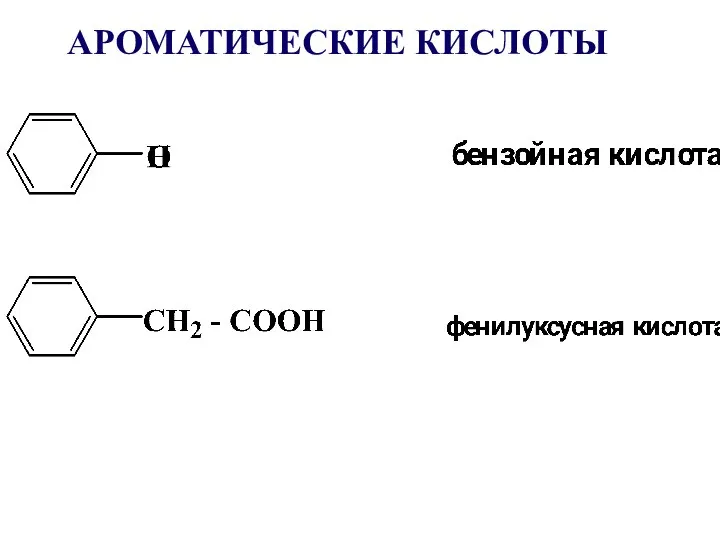
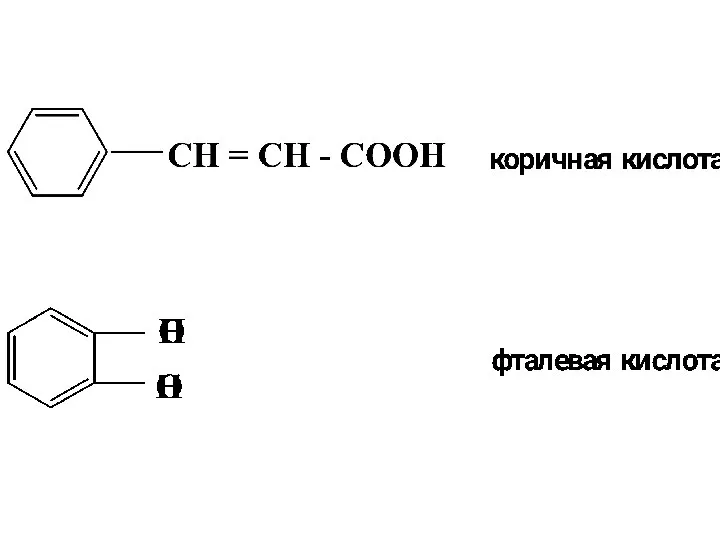
- 13. АРОМАТИЧЕСКИЕ КИСЛОТЫ
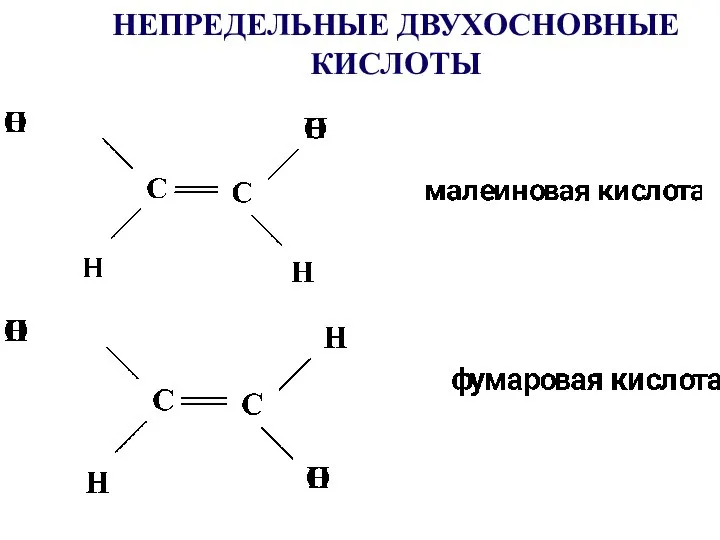
- 15. НЕПРЕДЕЛЬНЫЕ ДВУХОСНОВНЫЕ КИСЛОТЫ
- 16. Карбоксильная группа состоит из карбонильной и гидроксильной групп, взаимно влияющих друг на друга, что приводит к
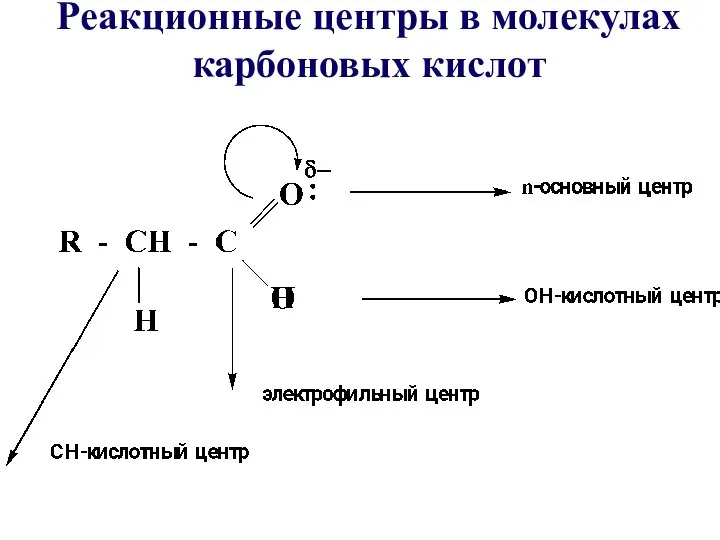
- 17. Реакционные центры в молекулах карбоновых кислот
- 18. Характеристика реакционной способности карбоновых кислот: •У карбоновых кислот повышены основные свойства атома кислорода по сравнению с
- 19. •У карбоновых кислот частичный положительный заряд на карбоксильном атоме углерода меньше, чем в оксосоединениях, т.е. кислоты
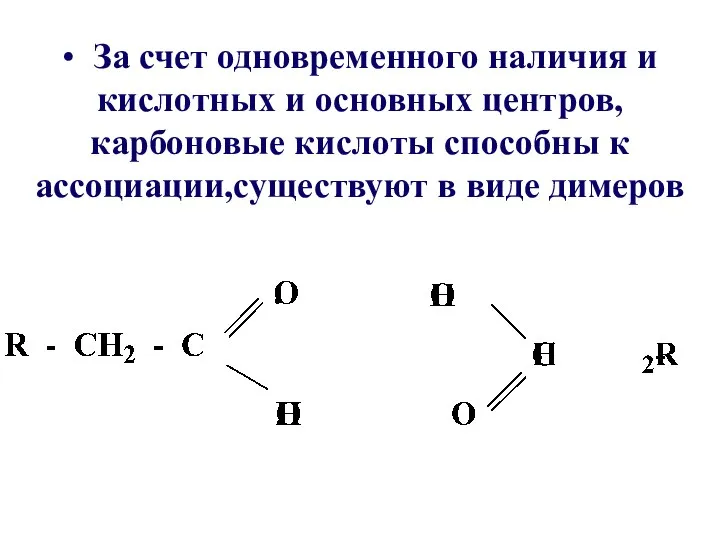
- 20. • За счет одновременного наличия и кислотных и основных центров, карбоновые кислоты способны к ассоциации,существуют в
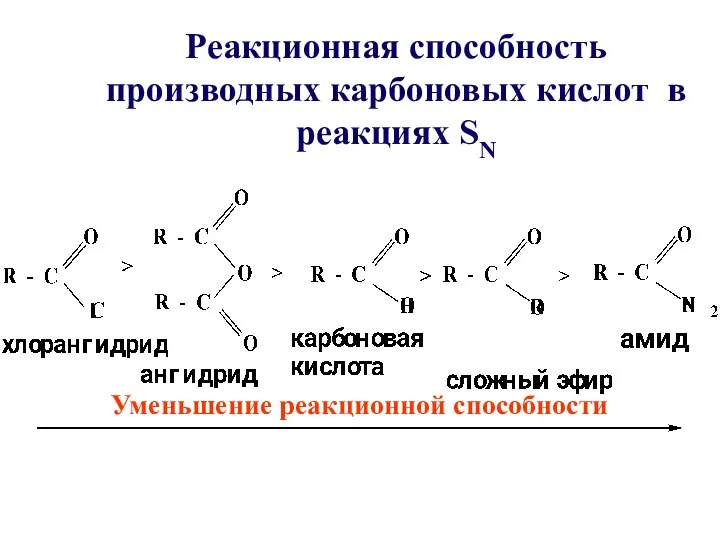
- 21. Реакционная способность производных карбоновых кислот в реакциях SN Уменьшение реакционной способности
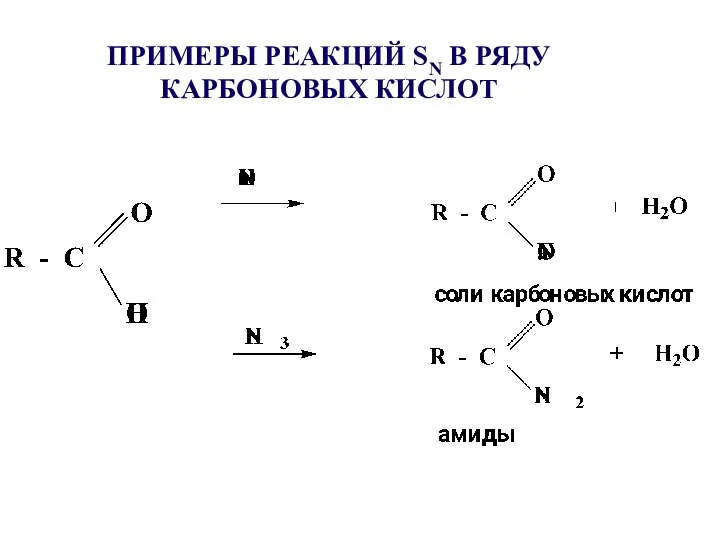
- 22. 9.3 Реакции нуклеофильного замещения (SN), их роль Реакции SN характерны для карбоновых кислот и их функциональных
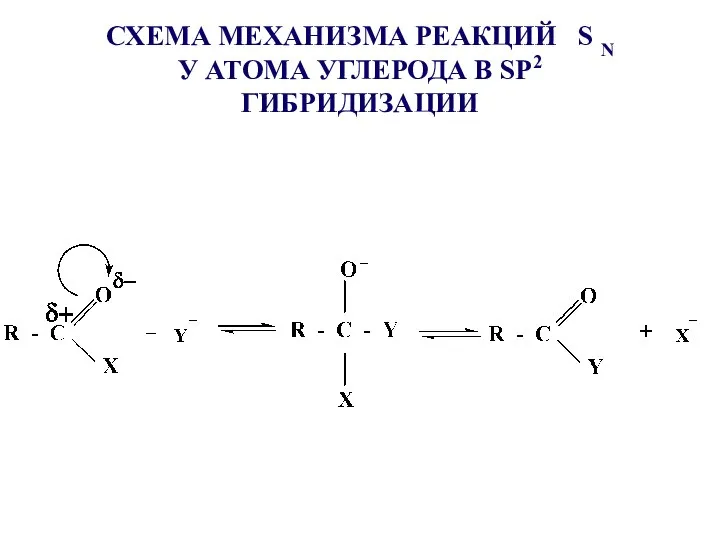
- 23. СХЕМА МЕХАНИЗМА РЕАКЦИЙ S N У АТОМА УГЛЕРОДА В SР2 ГИБРИДИЗАЦИИ
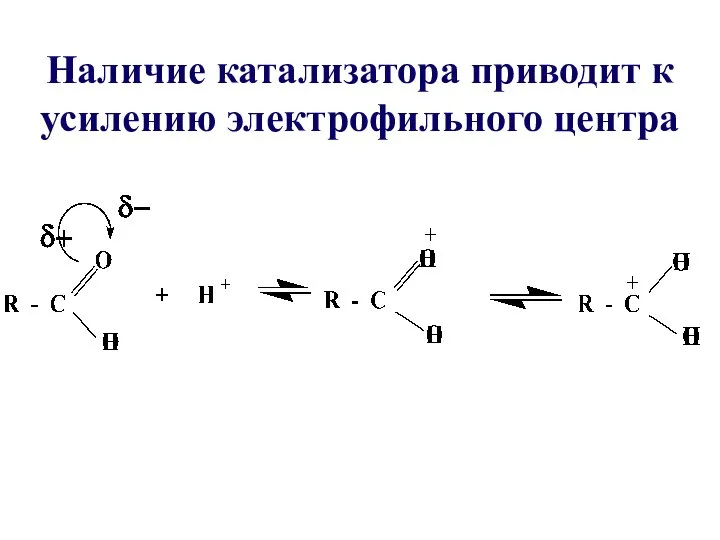
- 24. Реакция протекает при наличии сильного нуклеофила Y- и хорошо уходящей группы Х- Увеличение реакционной способности карбоновых
- 25. Наличие катализатора приводит к усилению электрофильного центра
- 26. ПРИМЕРЫ РЕАКЦИЙ SN В РЯДУ КАРБОНОВЫХ КИСЛОТ
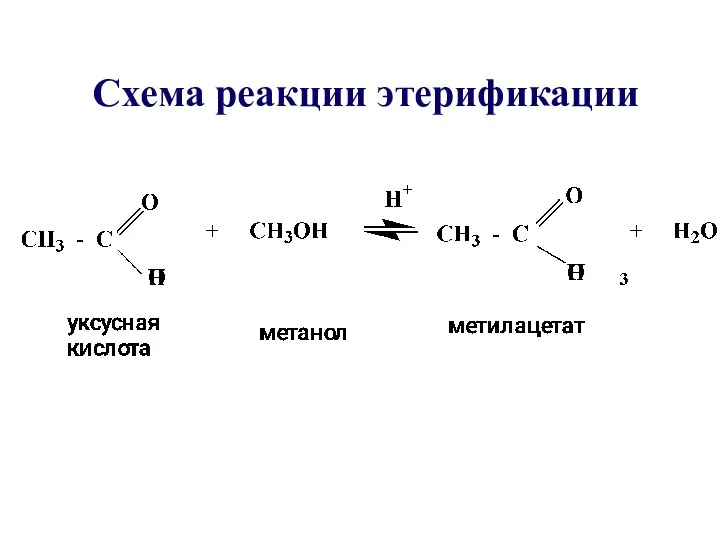
- 28. Схема реакции этерификации
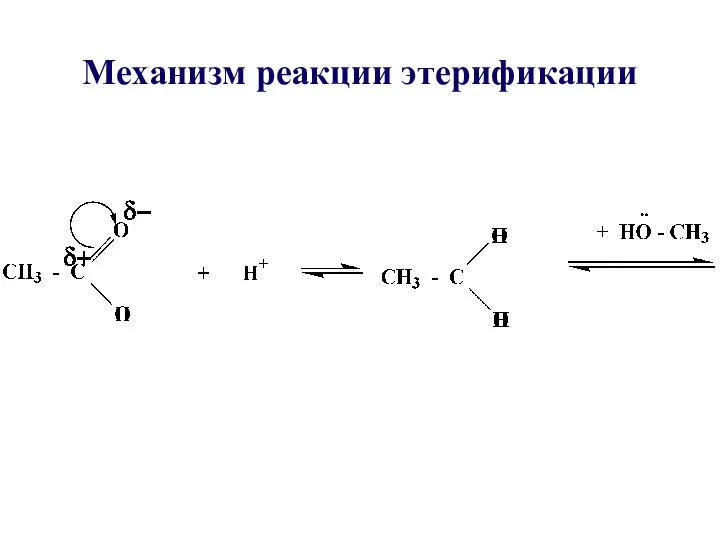
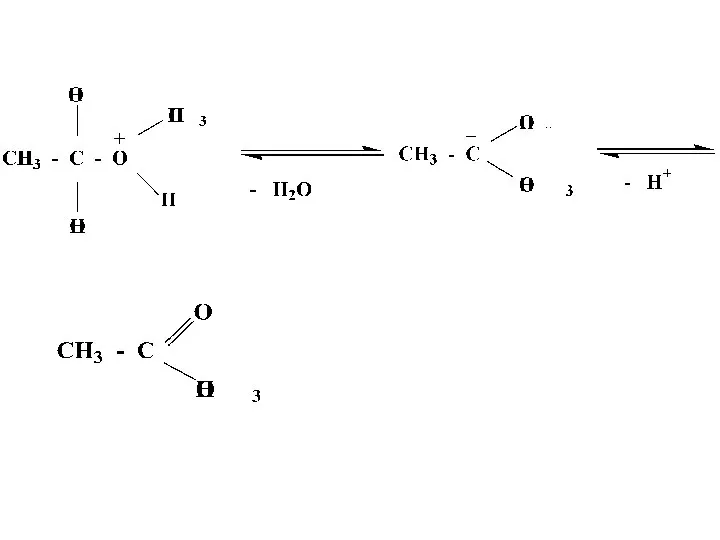
- 29. Механизм реакции этерификации
- 31. Реакция этерификации протекает в присутствии минеральных кислот, т.к. спирт является слабым нуклеофилом. Все стадии обратимы, поэтому
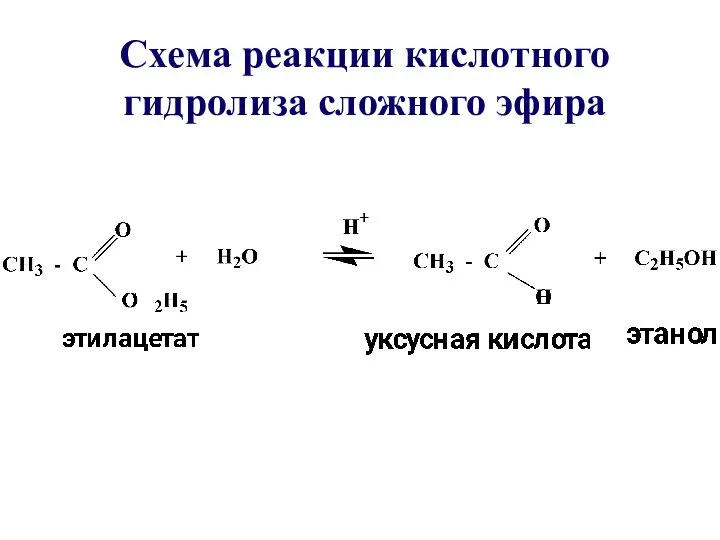
- 32. Схема реакции кислотного гидролиза сложного эфира
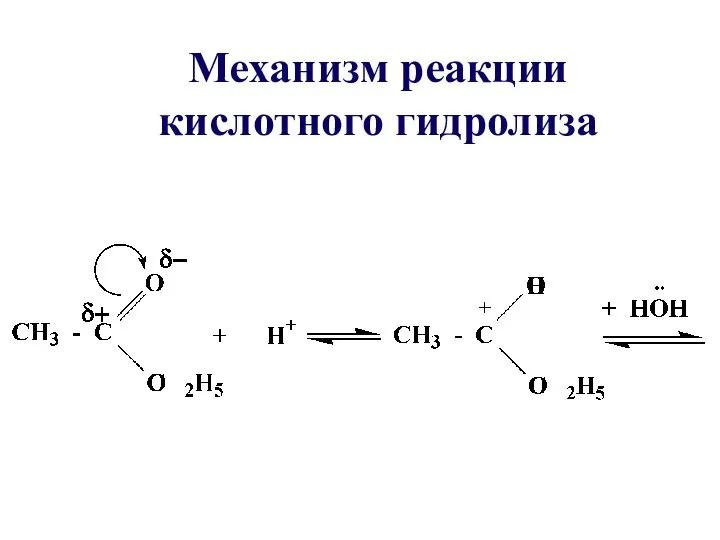
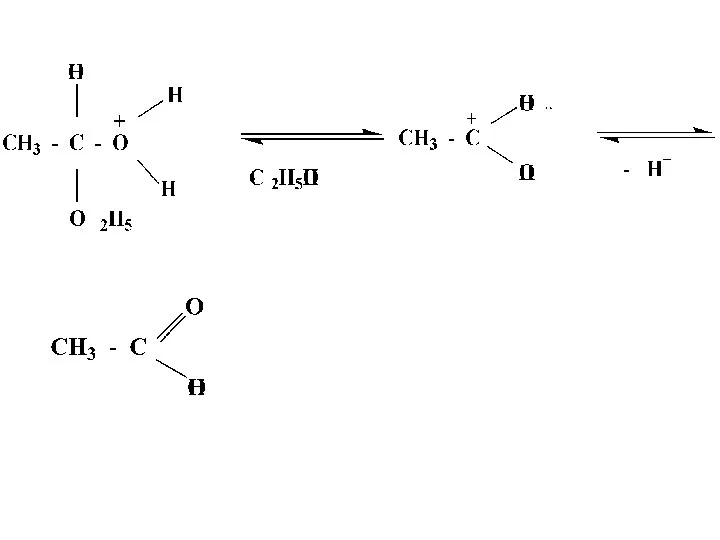
- 33. Механизм реакции кислотного гидролиза
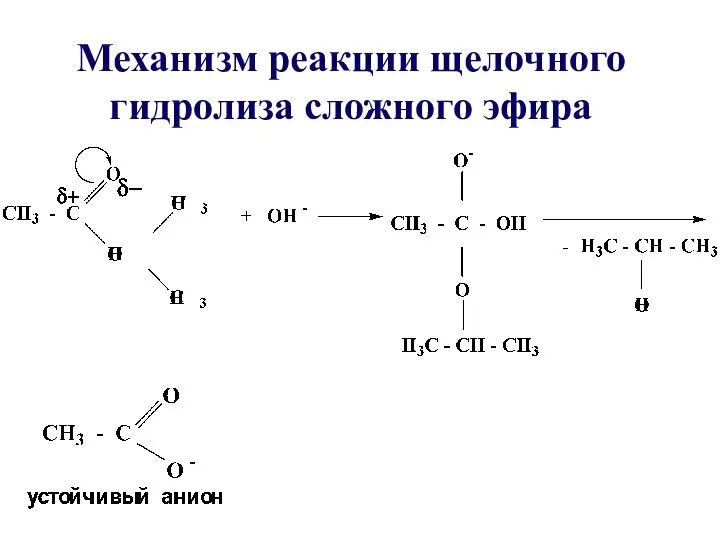
- 35. В щелочной среде гидролиз необратим, причиной этого является образование в щелочной среде стабильного ацилат-иона
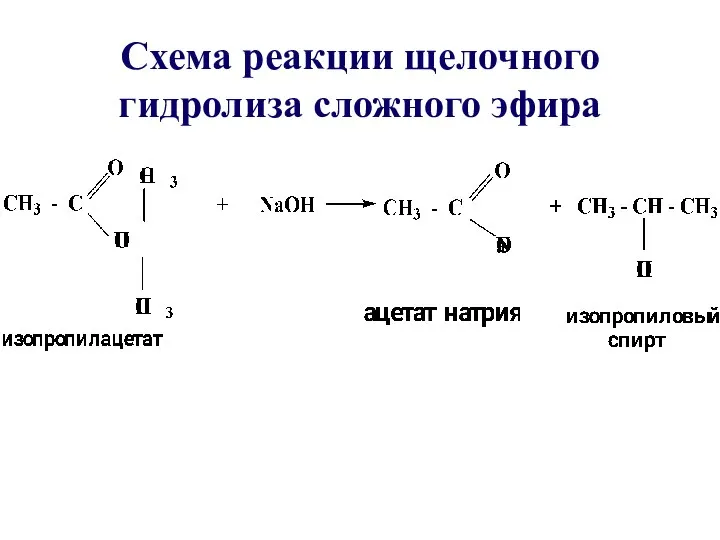
- 36. Схема реакции щелочного гидролиза сложного эфира
- 37. Механизм реакции щелочного гидролиза сложного эфира
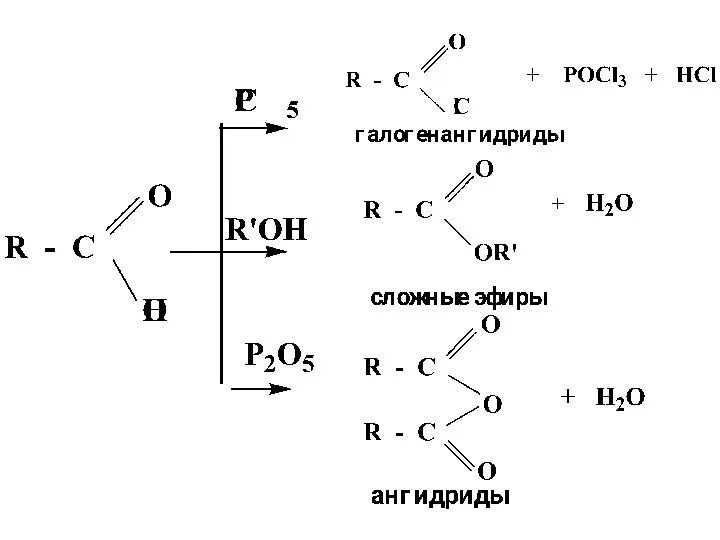
- 38. Для практического получения сложных эфиров обычно используют реакцию ацилирования спиртов галогенангидридами или ангидридами кислот, при этом
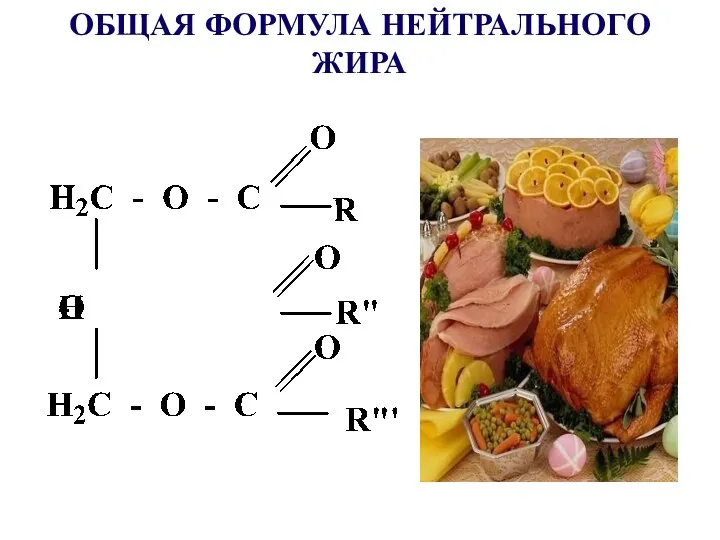
- 39. Сложными эфирами являются жиры и липиды, в образовании которых принимают участие многоатомные спирты и ВЖК
- 40. ОБЩАЯ ФОРМУЛА НЕЙТРАЛЬНОГО ЖИРА
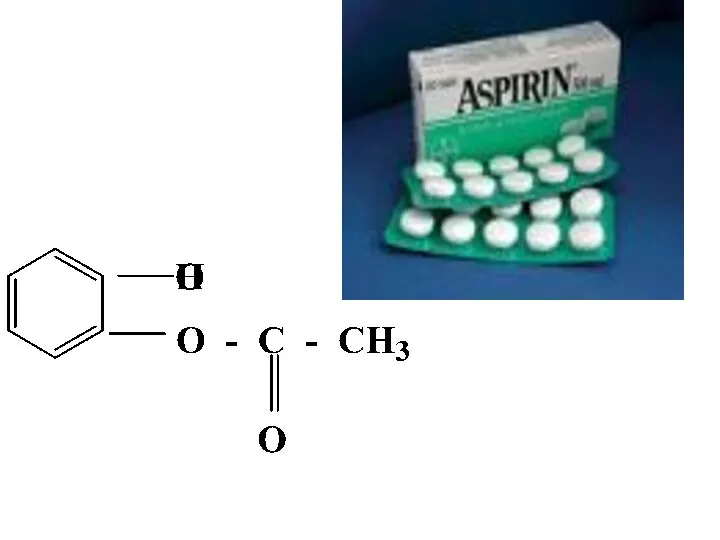
- 41. Многие лекарственные препараты являются сложными эфирами. Поэтому всегда следует учитывать возможность их гидролиза в кислой среде
- 43. Аспирин использовали при лечении зубной, головной боли и артритов на протяжении 100 лет. Но только в
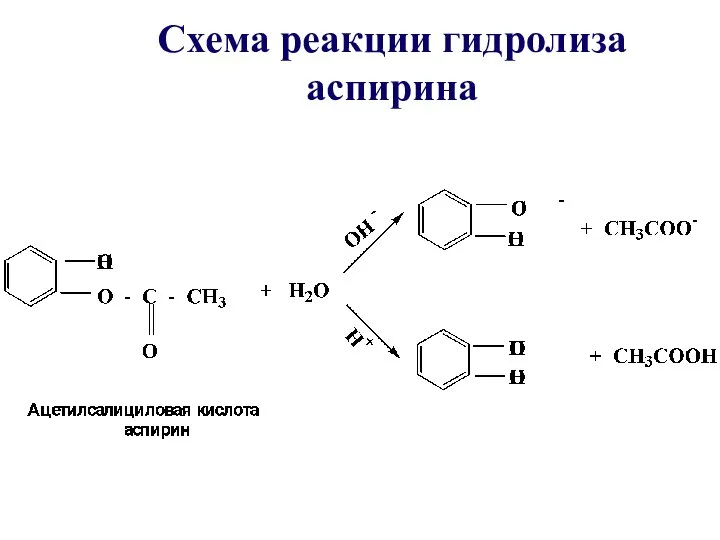
- 44. Схема реакции гидролиза аспирина
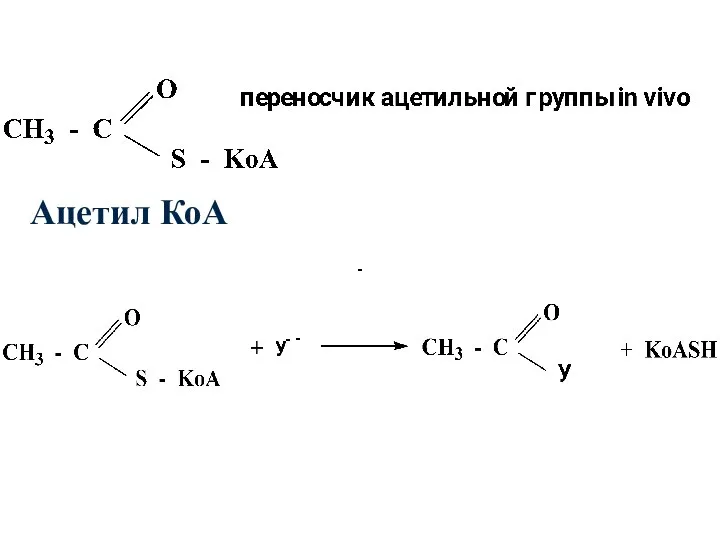
- 45. Сложные тиоэфиры наряду со сложными эфирами являются наиболее распространенными в природе производными карбоновых кислот. В организме
- 46. Ацетил КоА
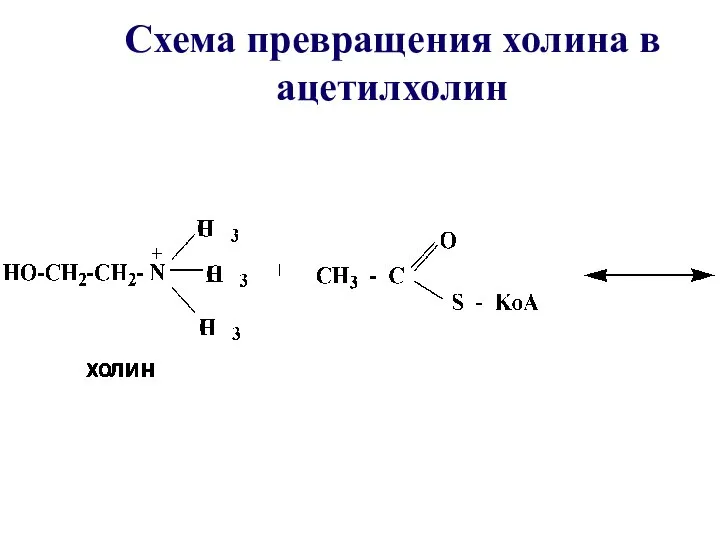
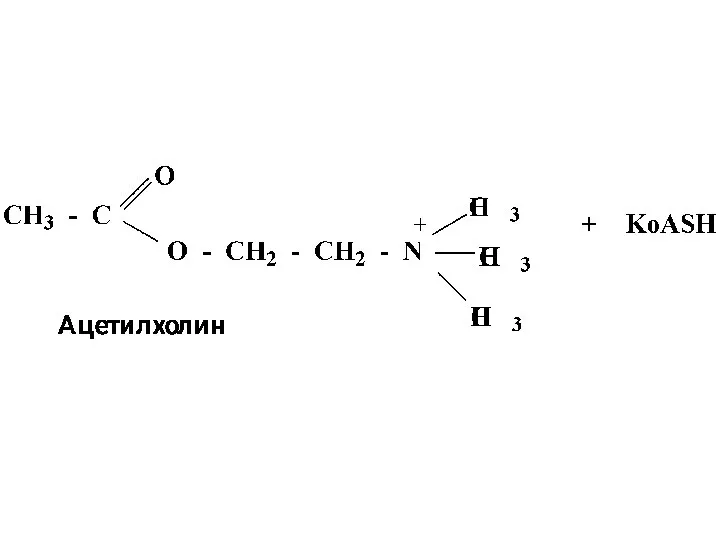
- 47. Таким образом осуществляется превращение холина в ацетилхолин – нейромедиатор, посредник при передаче нервного импульса
- 48. Схема превращения холина в ацетилхолин
- 50. При передаче нервного импульса ацетилхолин синтезируется в окончаниях нервных волокон и мигрирует к белковому рецептору следующей
- 51. Схемы реакций декарбоксилирования Реакции декарбоксилирования карбоновых кислот – энергетически выгодный процесс Декарбоксилирование характерно для кислот у
- 52. Декарбоксилирование двухосновных кислот
- 54. При декарбоксилировании янтарной и глутаровой кислот происходит образование циклических ангидридов, что обусловлено образованием пяти- или шестичленных
- 56. В биологических системах реакции декарбоксилирования протекают с участием ферментов – декарбоксилаз Декарбоксилирование аминокислот приводит к образованию
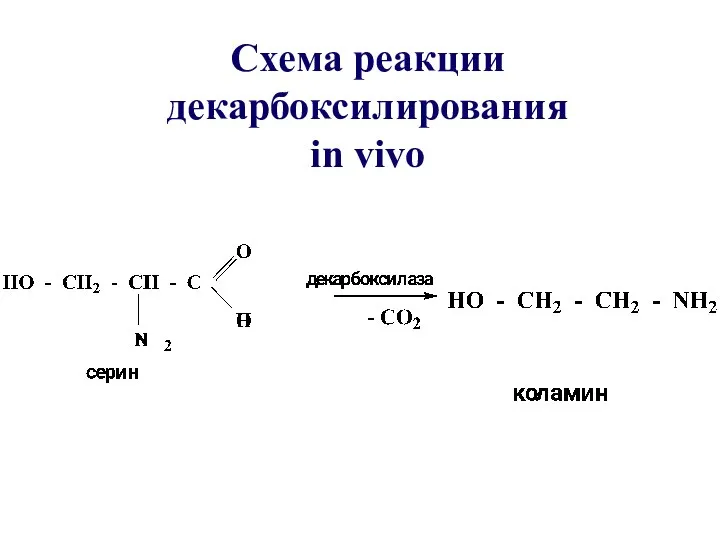
- 57. Схема реакции декарбоксилирования in vivo
- 58. В насыщенных алифатических кислотах в результате ЭА-влияния карбоксильной группы появляется СН - кислотный центр у α-углеродного
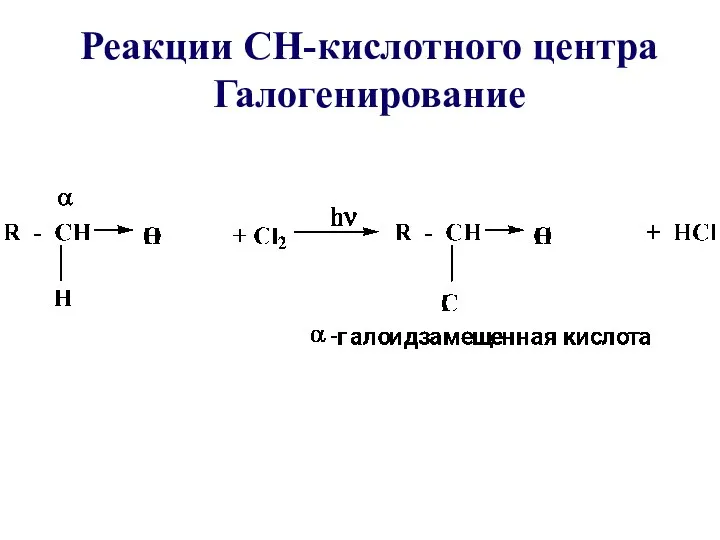
- 59. Реакции СН-кислотного центра Галогенирование
- 61. Скачать презентацию
























 рак толстой кишки
рак толстой кишки Базовое эксплуатационное депо, с детальной разработкой электромашинного цеха. Ремонт тягового электродвигателя
Базовое эксплуатационное депо, с детальной разработкой электромашинного цеха. Ремонт тягового электродвигателя мой вятский край - презентация для начальной школы
мой вятский край - презентация для начальной школы Путешествуем по графу
Путешествуем по графу Строение ядра
Строение ядра Финансовый менеджмент
Финансовый менеджмент ФКС изменения
ФКС изменения St. Valentine’s day
St. Valentine’s day Тема: Фондовая биржа План: Фондовая биржа. Внебиржевой рынок ценных бумаг.
Тема: Фондовая биржа План: Фондовая биржа. Внебиржевой рынок ценных бумаг. Задача лінійного програмування та методи її розв’язування(Лекція 3)
Задача лінійного програмування та методи її розв’язування(Лекція 3) Презентация на тему "Фармакологическая стратегия клеточных технологий" - скачать презентации по Медицине
Презентация на тему "Фармакологическая стратегия клеточных технологий" - скачать презентации по Медицине Сайт компании «Безант» (для оптового отдела)
Сайт компании «Безант» (для оптового отдела) Типовые соединения, применяемые в электроустановках. Методы и средства контроля размеров и качества сборки
Типовые соединения, применяемые в электроустановках. Методы и средства контроля размеров и качества сборки Определение предмета статистики в широком и узком смысле. Система правовой статистики
Определение предмета статистики в широком и узком смысле. Система правовой статистики Творчество Леонардо да Винчи
Творчество Леонардо да Винчи Язык, речь и общество
Язык, речь и общество Деятельность органов внутренних дел советского государства в 1925-1941 гг
Деятельность органов внутренних дел советского государства в 1925-1941 гг Фонетические чтения памяти учителей. Заседание кафедры фонетики 26 декабря 2018 г. Гордина
Фонетические чтения памяти учителей. Заседание кафедры фонетики 26 декабря 2018 г. Гордина Деловая оценка и аттестация персонала Тема 8
Деловая оценка и аттестация персонала Тема 8  5 новых правил. Правило 2: Пассивная игра
5 новых правил. Правило 2: Пассивная игра Занимательная математика - презентация для начальной школы__________________________________________________________________________________________________________________
Занимательная математика - презентация для начальной школы__________________________________________________________________________________________________________________ Массивы. Реализация в библиотеке С++
Массивы. Реализация в библиотеке С++ урок 11 презентация к уроку - презентация для начальной школы_
урок 11 презентация к уроку - презентация для начальной школы_ Алексей Викторович Щусев
Алексей Викторович Щусев Пятно как средство выражения. Композиция как ритм пятен
Пятно как средство выражения. Композиция как ритм пятен Введение в Python
Введение в Python Пример программы оформления договора страхования на портале продаж и на сайте компании © ООО «Капитал Лайф Страхование Жизни
Пример программы оформления договора страхования на портале продаж и на сайте компании © ООО «Капитал Лайф Страхование Жизни Педагогическая социальная психология Тема 1. Предметная область педагогической социальной психологии
Педагогическая социальная психология Тема 1. Предметная область педагогической социальной психологии