Содержание
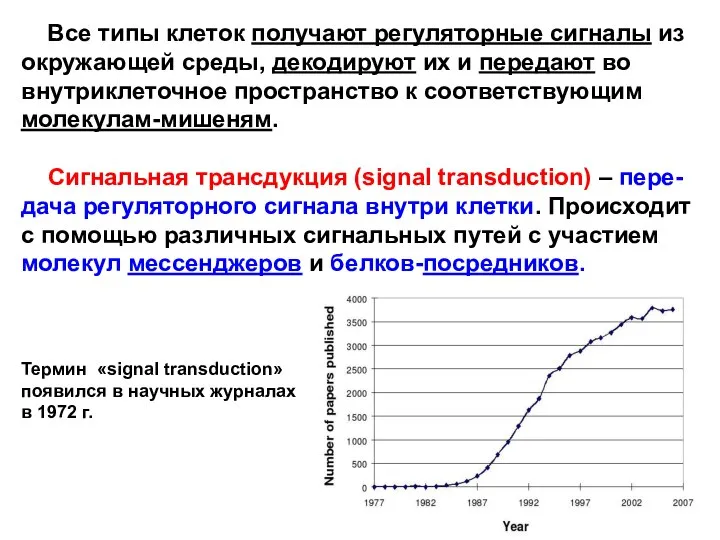
- 2. Все типы клеток получают регуляторные сигналы из окружающей среды, декодируют их и передают во внутриклеточное пространство
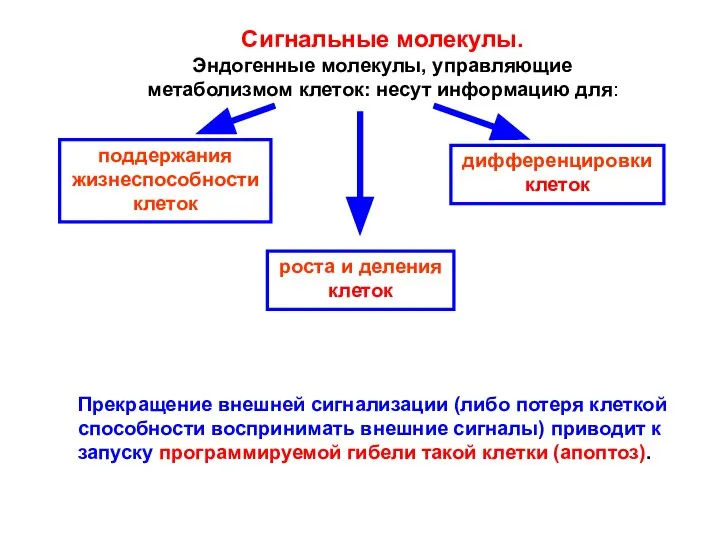
- 3. Сигнальные молекулы. Эндогенные молекулы, управляющие метаболизмом клеток: несут информацию для: поддержания жизнеспособности клеток роста и деления
- 4. Регуляторные (управляющие) сигналы поступают в двух направлениях: 1. Снаружи ? внутрь. Метаболизм каждого типа клеток определяет
- 5. Каждый тип клеток имеет специфический набор (комплект, паттерн) рецепторов. Это даёт возмож-ность каждому типу клеток специфически
- 6. Внеклеточные сигнальные молекулы (первичные мессенджеры) действуют как на коротких, так и на длинных дистанциях: Короткие дистанции:
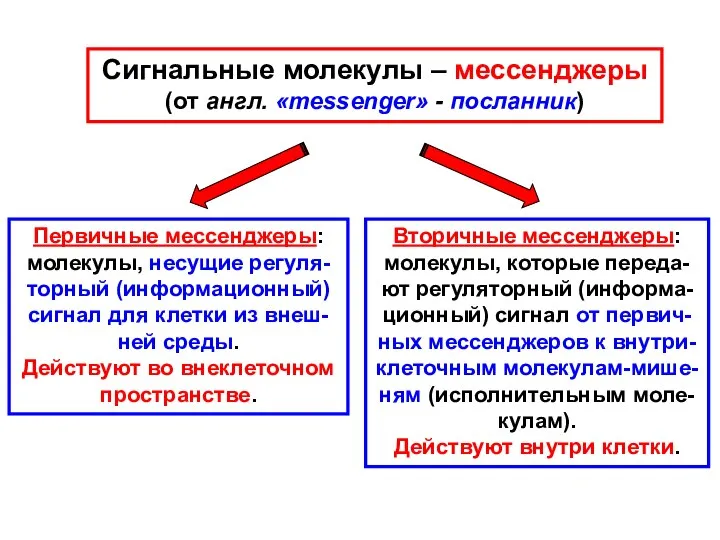
- 7. Сигнальные молекулы – мессенджеры (от англ. «messenger» - посланник) Первичные мессенджеры: молекулы, несущие регуля- торный (информационный)
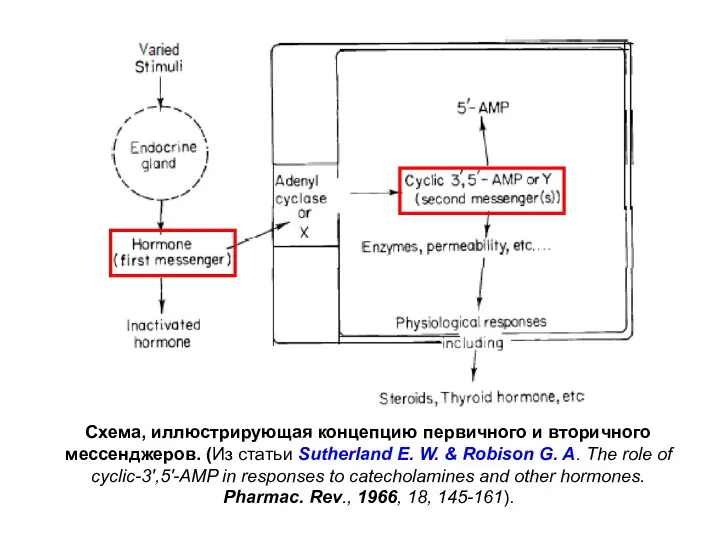
- 8. Эрл Уилбур Сазерленд (Earl Wilbur Sutherland) 1915-1974 Концепция первичных и вторичных мессенджеров была сформулирована в первой
- 9. Схема, иллюстрирующая концепцию первичного и вторичного мессенджеров. (Из статьи Sutherland E. W. & Robison G. A.
- 10. Первичные мессенджеры – группа эндогенных сигнальных биомолекул (лигандов), имеющих различ-ное химическое строение, действующие на клетку путем
- 11. 2. Факторы роста. Несут митогенный сигнал - стиму-лируют митоз и деление клеток. Для факторов роста у
- 12. 4. Нейромедиаторы (нейротрансмиттеры) . Их выде- ление и связывание происходит внутри синаптической щели. Эффект медиатора (возбуждающий
- 13. Вторичные мессенджеры – малые гидрофильные молекулы, быстро и в больших количествах синтези-руются внутри клетки в ответ
- 14. Семейство вторичных мессенджеров 1. цАМФ. Синтезируется с участием аденилатцикла-зы из АТФ. Синтез происходит быстро, но непродол-жительно.
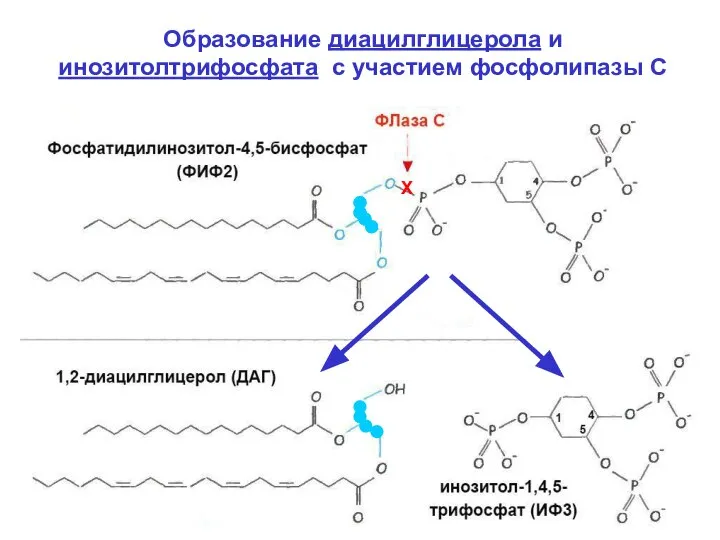
- 15. 3. Диацилглицерол (ДАГ). Является первым продук- том действия фосфолипазы С (ФЛазы С) на мембран- ный (минорный)
- 16. Образование диацилглицерола и инозитолтрифосфата с участием фосфолипазы С Х
- 17. 5. Ионы Са2+. В цитоплазме нестимулированной клетке [Ca2+] = 10-7 М. Во всех клетках повышение [Ca2+]
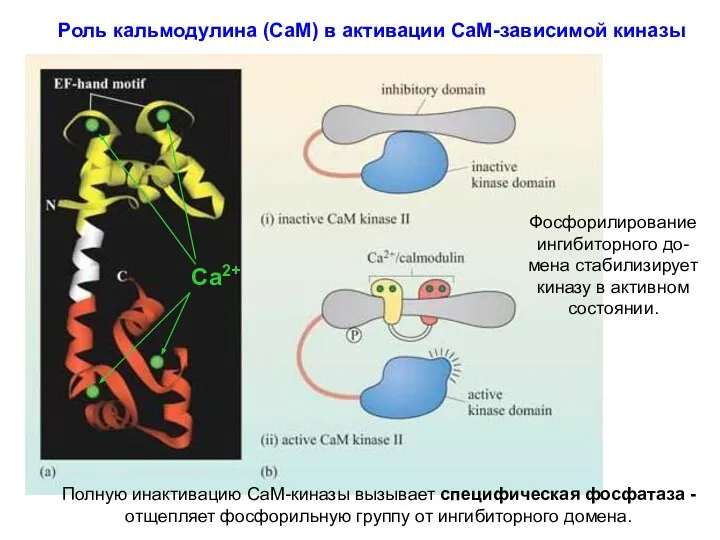
- 18. Роль кальмодулина (СаМ) в активации СаМ-зависимой киназы Фосфорилирование ингибиторного до-мена стабилизирует киназу в активном состоянии. Полную
- 19. 6. Оксид азота (NO). Это газообразное соединение, являющееся свободным радикалом (имеет неспарен- ный электрон), что придает
- 20. Мишень NO - растворимая (цитоплазматическая) гуанилатциклаза. Необычность этого фермента: он катализирует образование вторичного мессенджера – цГМФ,
- 21. I. Основные структурные элементы мембранных рецепторов (рецепторов клеточной поверхности Рецепторы - гликопротеиды. Распознав специфический лиганд (первичный
- 22. Классификация рецепторов клеточной поверхности (рецепторов клеточной мембраны) Рецепторы, сопряженные с G белками (G-protein coupled receptors –
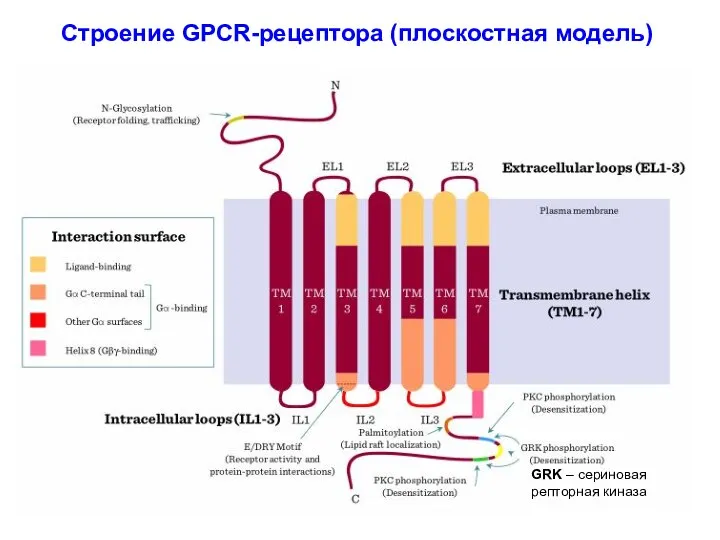
- 23. 1. Рецепторы, сопряженные с G белками (G-protein coupled receptors – GPCR) или семиспиральные рецепторы. Образованы одной
- 24. Строение GPCR-рецептора (плоскостная модель) GRK – сериновая репторная киназа
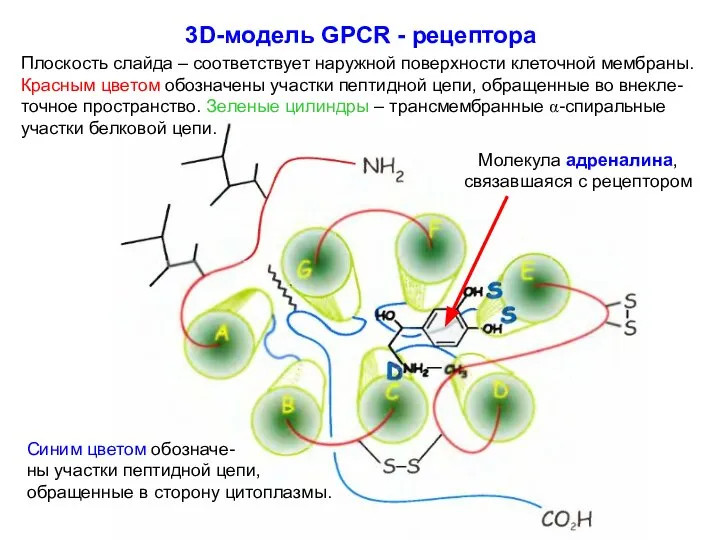
- 25. 3D-модель GPCR - рецептора Плоскость слайда – соответствует наружной поверхности клеточной мембраны. Красным цветом обозначены участки
- 26. 2. Каталитические рецепторы – обладают собственной тирозин- или серин/треонин-протеинкиназной актив- ностью (рецептор-ассоциированные киназы) и гуа- нилатциклазной
- 27. 2.а. Рецепторы с тирозинкиназной активностью. Важнейшие лиганды: инсулин и различные факторы роста. Характерное проявление их активации
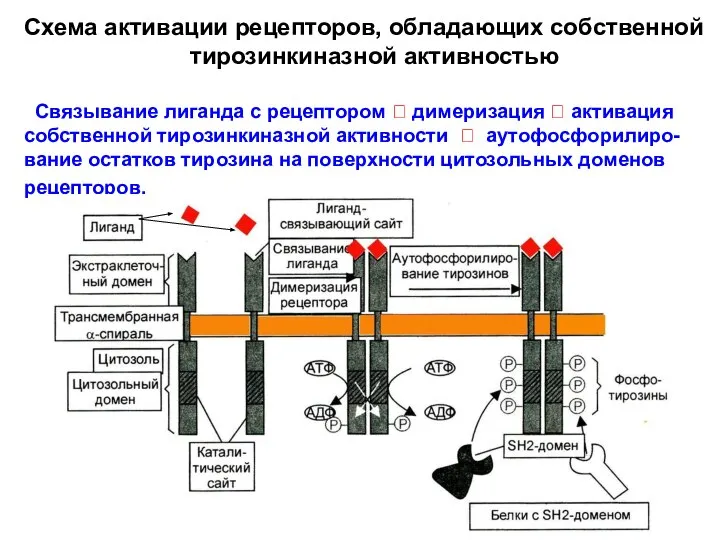
- 28. Схема активации рецепторов, обладающих собственной тирозинкиназной активностью Связывание лиганда с рецептором ? димеризация ? активация собственной
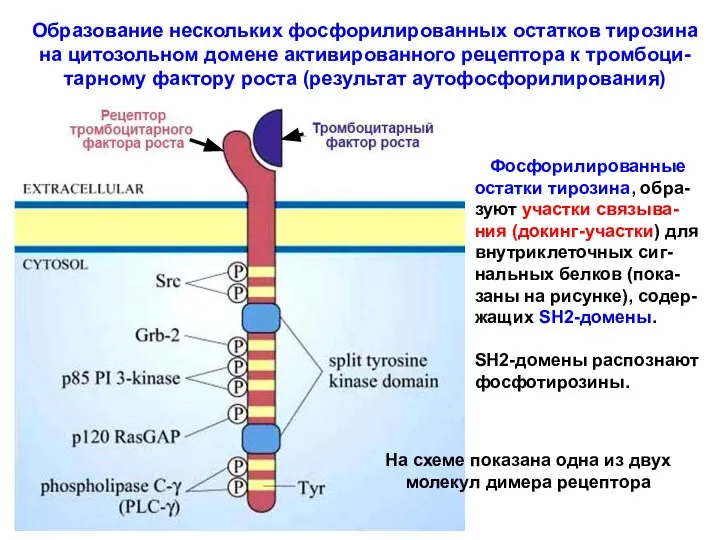
- 29. Образование нескольких фосфорилированных остатков тирозина на цитозольном домене активированного рецептора к тромбоци- тарному фактору роста (результат
- 30. Пример гетеродимера: классический рецептор к фактору роста эпидермиса (ФРЭ) + его разновидность (ErbB-3) = ФРЭ +
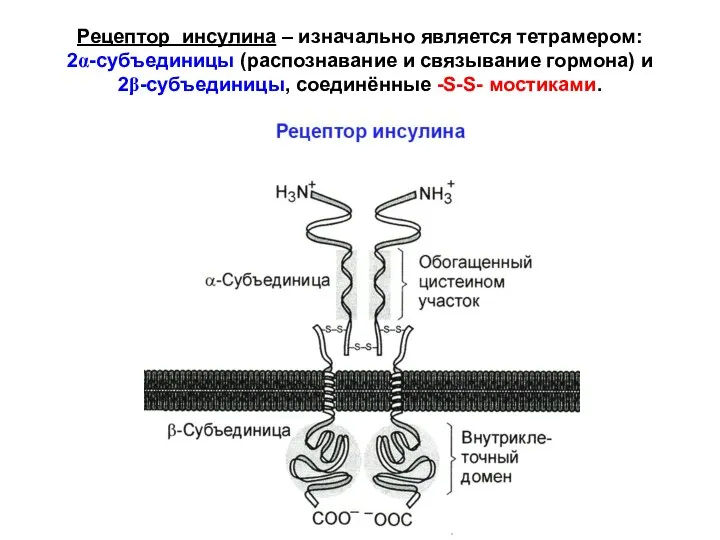
- 31. Рецептор инсулина – изначально является тетрамером: 2α-субъединицы (распознавание и связывание гормона) и 2β-субъединицы, соединённые -S-S- мостиками.
- 32. 2.б. Рецепторные гуанилатциклазы (ГЦ) – катализируют синтез вторичного мессенджера цГМФ (гуанозин-3’5’-монофос-фата) Рецептор локализован в цитоплазматической мембране.
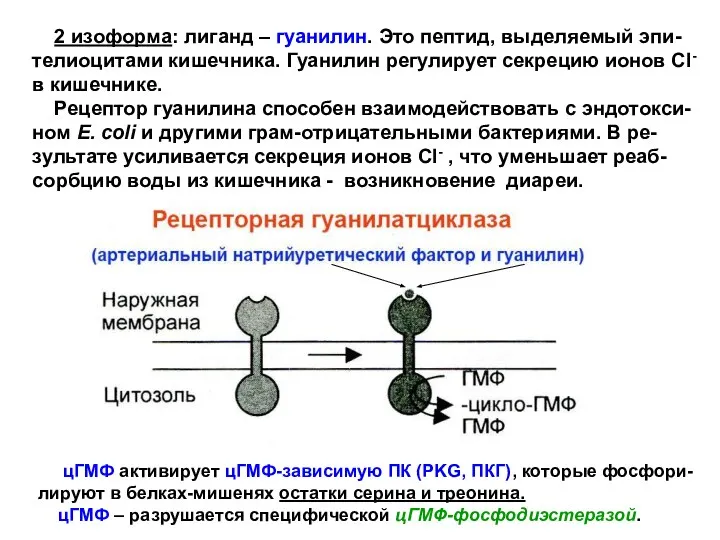
- 33. 2 изоформа: лиганд – гуанилин. Это пептид, выделяемый эпи-телиоцитами кишечника. Гуанилин регулирует секрецию ионов Cl- в
- 34. 3. Рецепторы не каталитические – после активации лигандом приобретают способность взаимодейст- вовать с цитозольными тирозиновыми протеин-
- 35. JAK действуют посредством транскрипционных факторов: STAT - signal transducers and activation transcription ). Неактив-ный STAT находится
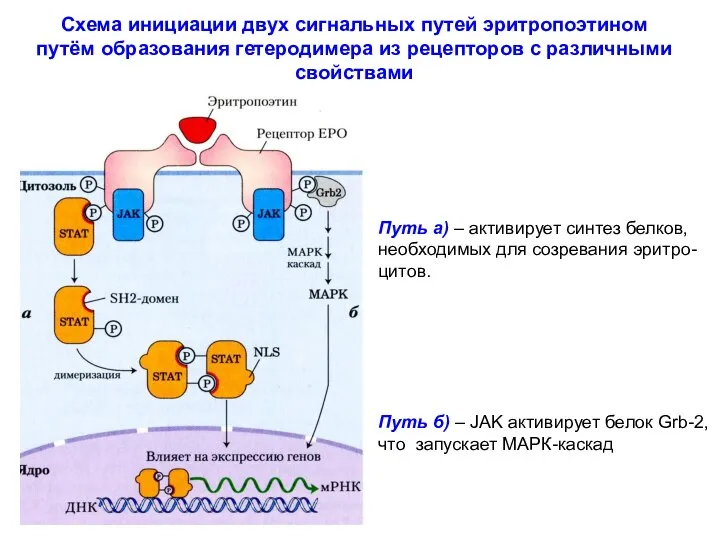
- 36. Схема инициации двух сигнальных путей эритропоэтином путём образования гетеродимера из рецепторов с различными свойствами Путь а)
- 37. 4. Регулируемые ионные каналы (лиганд-активируе- мые ионные каналы или каналы, сопряженные с ре- цептором). Типичный пример:
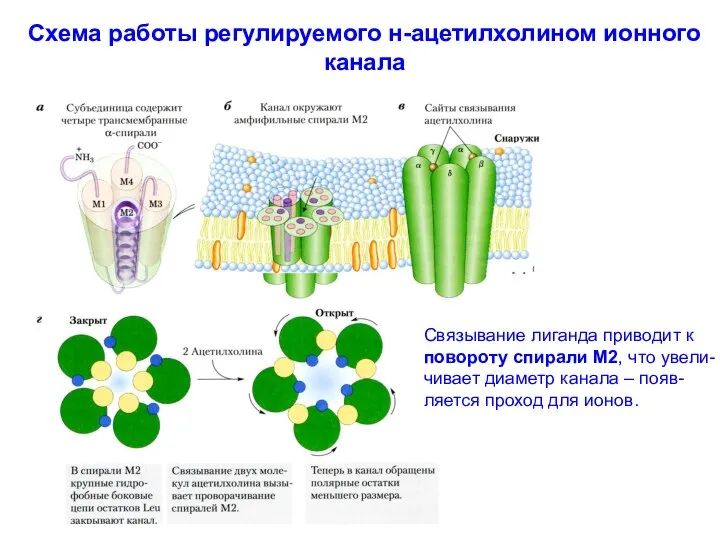
- 38. Схема работы регулируемого н-ацетилхолином ионного канала Связывание лиганда приводит к повороту спирали М2, что увели- чивает
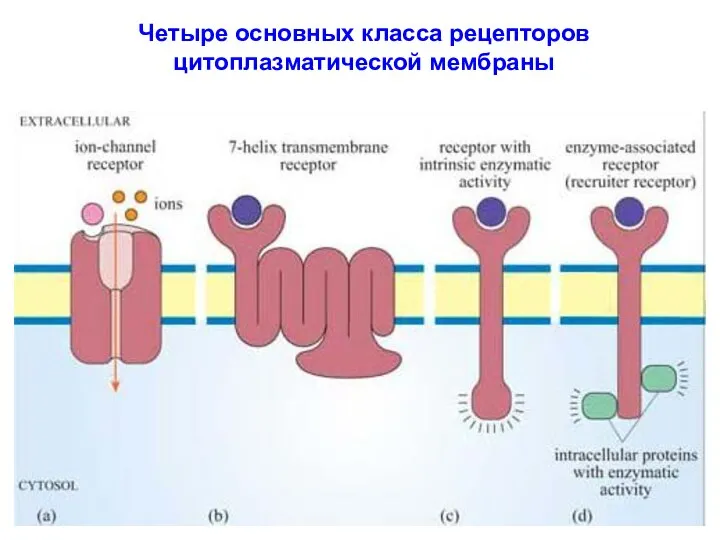
- 39. Четыре основных класса рецепторов цитоплазматической мембраны
- 40. Основные механизмы активации мембранных рецепторов Конформационная перестройка (рецепторы-ионные каналы и GPCR); Димеризация (рецепторы с собственной ферментативной
- 41. II. Внутриклеточные рецепторы Связывают малые, липофильные молекулы, которые легко преодале-вают барьер цитоплазматической мембраны: стероидные и тиреидные
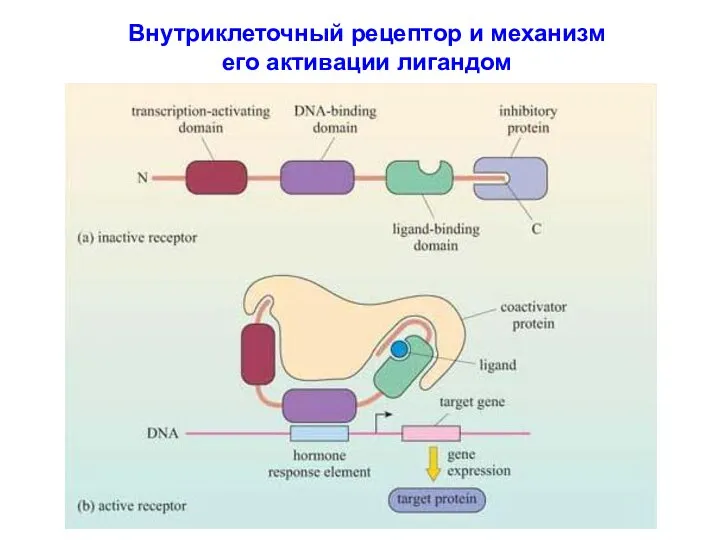
- 42. Внутриклеточный рецептор и механизм его активации лигандом
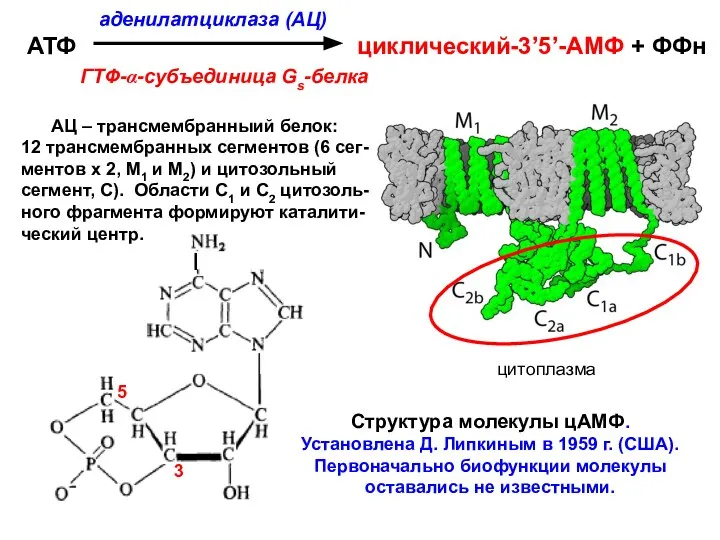
- 43. ТРАНСДУКЦИЯ СИГНАЛА ВНУТРИ КЛЕТКИ ПОСРЕДСТВОМ ВТОРИЧНОГО МЕССЕНДЖЕРА - цАМФ Гормоны, увеличивающие внутриклеточную концентрацию цАМФ: адреналин (мышцы)
- 44. α-субъединица в составе G-белков содержит нуклеотид-свя-зы-вающий сайт для гуаниновых нуклеотидов (ГДФ/ГТФ). Активация Gs-белка состоит в замене
- 45. Структура молекулы цАМФ. Установлена Д. Липкиным в 1959 г. (США). Первоначально биофункции молекулы оставались не известными.
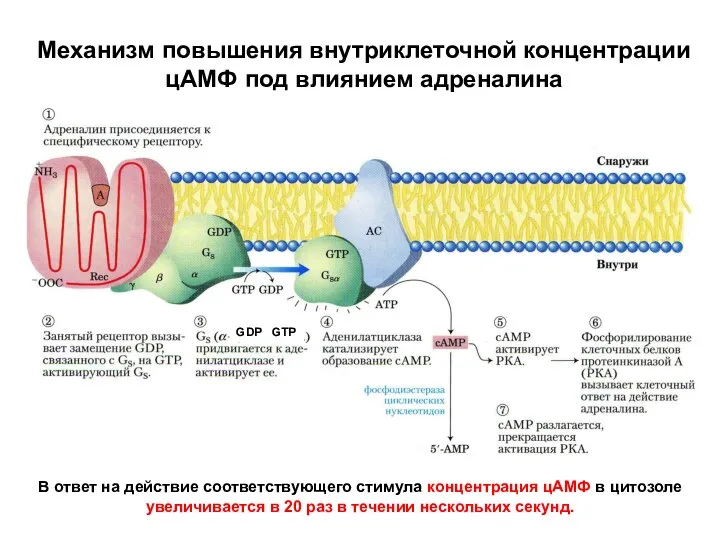
- 46. Механизм повышения внутриклеточной концентрации цАМФ под влиянием адреналина GDP GTP В ответ на действие соответствующего стимула
- 47. Строение и функционирование ПКА Молекула ПКА состоит из 2 регуляторных (R) и 2 каталитичес-ких (C) субъединиц.
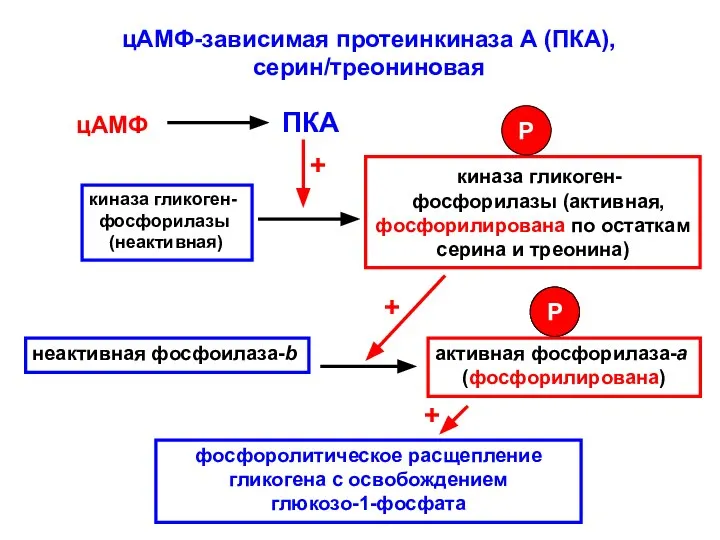
- 48. цАМФ-зависимая протеинкиназа А (ПКА), серин/треониновая цАМФ ПКА киназа гликоген- фосфорилазы (неактивная) киназа гликоген- фосфорилазы (активная, фосфорилирована
- 49. Белки, заякоривающие протеинкиназу А (AKAP – A kinase anchoring proteins). Эти белки обеспечивают физическую связь между
- 50. В клетках-мишенях каждого типа экспрессируется собствен-ный набор протеинкиназ А и киназа-активируемых путей. Одна система передачи информации
- 51. Усиление сигнала от гормонов, действующих посредством вторичного мессенджера цАМФ. 1 молекула гормона активирует 1 молекулу РЕЦЕПТОРА,
- 52. Механизмы прекращения сигнализации посредством рецептора и синтеза цАМФ: Включение собственной ГТФазной активности α-субъединицы, наступает через несколько
- 53. 4. Сама цАМФ разрушается с участием специфической фосфоди- эстеразы: фосфодиэстераза цАМФ АМФ (лишена свойств вторичного мессенджера)
- 54. Участие цАМФ в регулировании транскрипции белков. цАМФ способна имитировать действие стероидных и тиреоид-ных гормонов, тем самым,
- 56. Скачать презентацию










![5. Ионы Са2+. В цитоплазме нестимулированной клетке [Ca2+] = 10-7 М.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302968/slide-16.jpg)























 Авангардизм в натюрморте настроения
Авангардизм в натюрморте настроения Софийские соборы Киева и Новгорода
Софийские соборы Киева и Новгорода Состав слова - презентация для начальной школы_
Состав слова - презентация для начальной школы_ Виды, разрезы, сечения. ГОСТ 2.305-2008
Виды, разрезы, сечения. ГОСТ 2.305-2008 Обеспечение общественного порядка и противодействие преступности
Обеспечение общественного порядка и противодействие преступности Многогранники и их виды. Графические модели многогранников. (Лекция 5)
Многогранники и их виды. Графические модели многогранников. (Лекция 5) Восприятие русской аудиторией образа женщины-воина в современной японской массовой культуре
Восприятие русской аудиторией образа женщины-воина в современной японской массовой культуре 10 занятие_стом.ppt
10 занятие_стом.ppt Презентация на тему "ЛЕКАРСТВЕННЫЕ СРЕДСТВА ВЛИЯЮЩИЕ НА ФУНКЦИЮ ОРГАНОВ ПИЩЕВАРЕНИЯ" - скачать презентации по Медицине
Презентация на тему "ЛЕКАРСТВЕННЫЕ СРЕДСТВА ВЛИЯЮЩИЕ НА ФУНКЦИЮ ОРГАНОВ ПИЩЕВАРЕНИЯ" - скачать презентации по Медицине Презентация "Семь чудес света" - скачать презентации по МХК
Презентация "Семь чудес света" - скачать презентации по МХК Футбольная форма и инвентарь
Футбольная форма и инвентарь ЧРЕЗВЫЧАЙНЫЕ СИТУАЦИИ И МЕТОДЫ ЗАЩИТЫ В УСЛОВИЯХ ИХ РЕАЛИЗАЦИИ
ЧРЕЗВЫЧАЙНЫЕ СИТУАЦИИ И МЕТОДЫ ЗАЩИТЫ В УСЛОВИЯХ ИХ РЕАЛИЗАЦИИ Инфаркт миокарда
Инфаркт миокарда Нарышкинский детский сад «Солнышко».
Нарышкинский детский сад «Солнышко». Сommunication
Сommunication  Деятельность П.А.Сорокина Выполнили: Стародворов Вадим Ращупкин Артем
Деятельность П.А.Сорокина Выполнили: Стародворов Вадим Ращупкин Артем Циркуляция
Циркуляция День Святого Валентина
День Святого Валентина Бутик дизайнерской одежды “Salsa”. Бизнес-проект
Бутик дизайнерской одежды “Salsa”. Бизнес-проект Три медведя
Три медведя  ГОСУДАРСТВЕННЫЕ ЦЕННЫЕ БУМАГИ I. Общая характеристика II. Виды государственных ценных бумаг III. Ценные бумаги региональных ор
ГОСУДАРСТВЕННЫЕ ЦЕННЫЕ БУМАГИ I. Общая характеристика II. Виды государственных ценных бумаг III. Ценные бумаги региональных ор Расчет оборудования для транспортировки, питатели, дозаторы
Расчет оборудования для транспортировки, питатели, дозаторы Ми проти насильства та жорстокости
Ми проти насильства та жорстокости Турнир по теннису
Турнир по теннису Без названия
Без названия Обереги земли Тасу Ява в наше время
Обереги земли Тасу Ява в наше время Параметры зубошевинговальных станков
Параметры зубошевинговальных станков Инвестиционный проект строительства административного здания
Инвестиционный проект строительства административного здания