Содержание
- 2. Адсорбція – концентрування речовини на поверхні розділу фаз. Абсорбція – поглинання речовини, що веде до її
- 3. ФІЗИЧНА І ХІМІЧНА АДСОРБЦІЯ Фізична адсорбція – зв’язування молекул на межі розділу фаз за рахунок “слабких”
- 4. Характеристики зразку: - питома площа поверхні (м2/г) - об’єм пор (см3/г) - енергія адсорбції певного субстрату
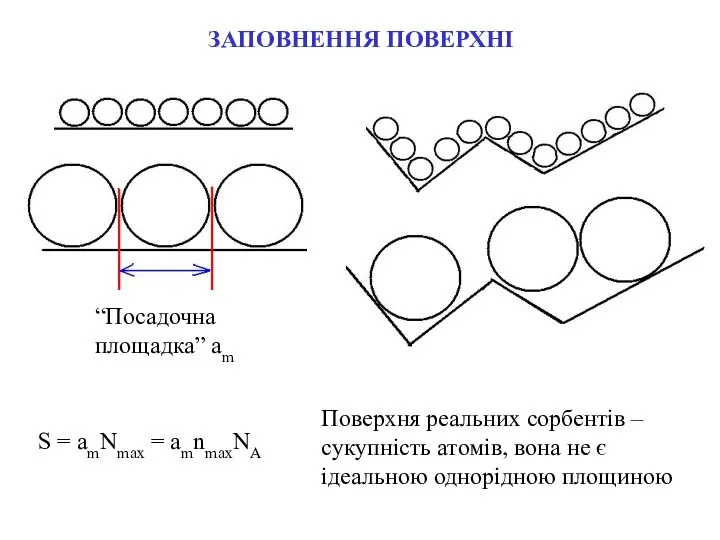
- 5. ЗАПОВНЕННЯ ПОВЕРХНІ “Посадочна площадка” am S = amNmax = amnmaxNA Поверхня реальних сорбентів – сукупність атомів,
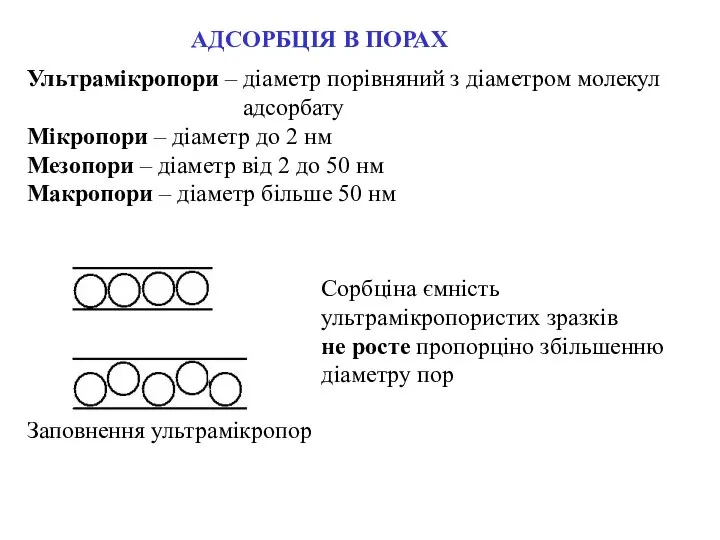
- 6. АДСОРБЦІЯ В ПОРАХ Ультрамікропори – діаметр порівняний з діаметром молекул адсорбату Мікропори – діаметр до 2
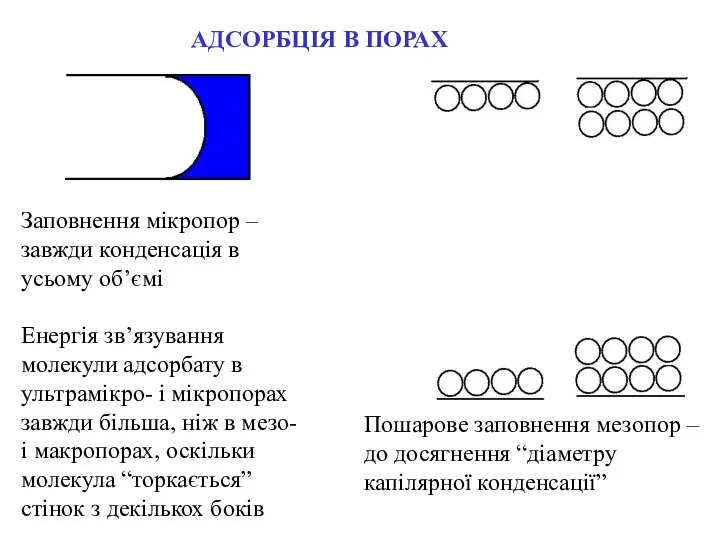
- 7. Пошарове заповнення мезопор – до досягнення “діаметру капілярної конденсації” АДСОРБЦІЯ В ПОРАХ Заповнення мікропор – завжди
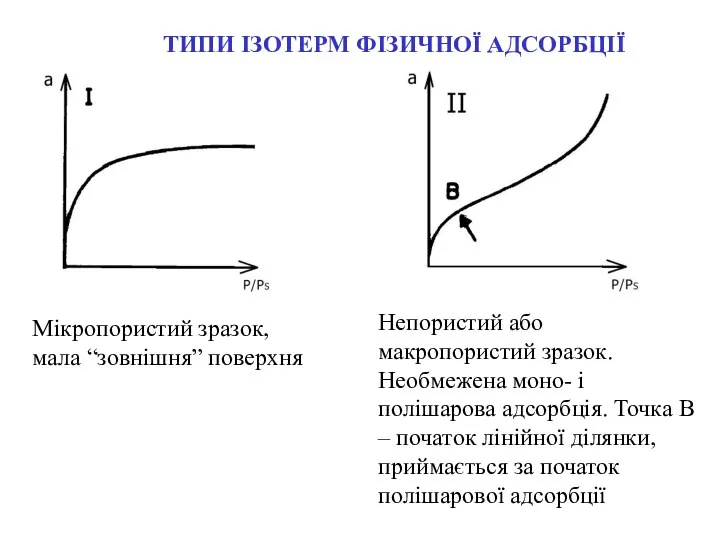
- 8. ТИПИ ІЗОТЕРМ ФІЗИЧНОЇ АДСОРБЦІЇ Мікропористий зразок, мала “зовнішня” поверхня Непористий або макропористий зразок. Необмежена моно- і
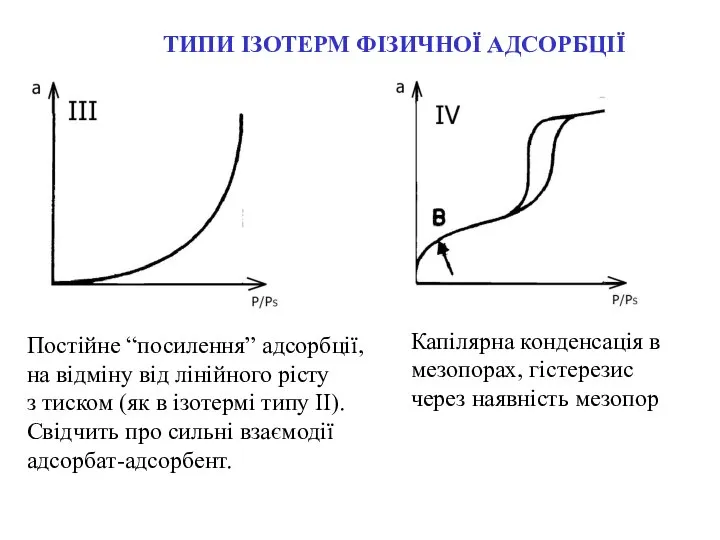
- 9. ТИПИ ІЗОТЕРМ ФІЗИЧНОЇ АДСОРБЦІЇ Постійне “посилення” адсорбції, на відміну від лінійного рісту з тиском (як в
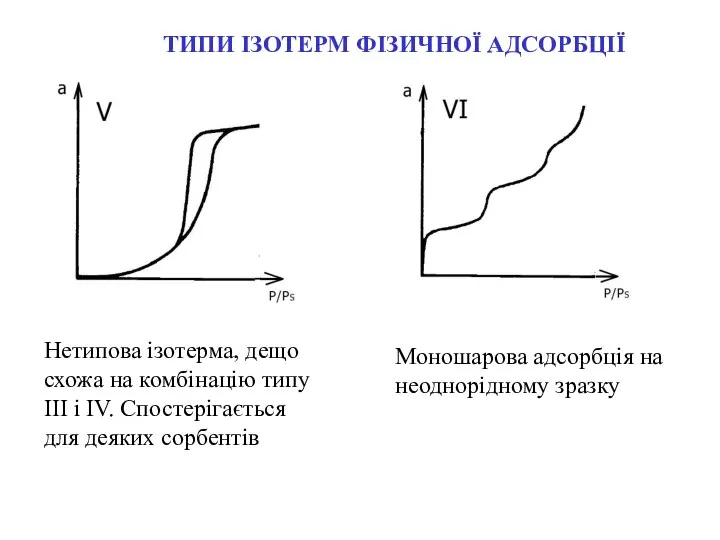
- 10. ТИПИ ІЗОТЕРМ ФІЗИЧНОЇ АДСОРБЦІЇ Нетипова ізотерма, дещо схожа на комбінацію типу ІІІ і IV. Спостерігається для
- 11. ВИЗНАЧЕННЯ ПЛОЩІ ПОВЕРХНІ Модель Ленгмюра: вважається, що заповнення моношарове Модель Брунауера-Емметта-Теллера (БЕТ): na – кількість адсорбату,
- 12. ВИЗНАЧЕННЯ ОБ’ЄМУ ПОР
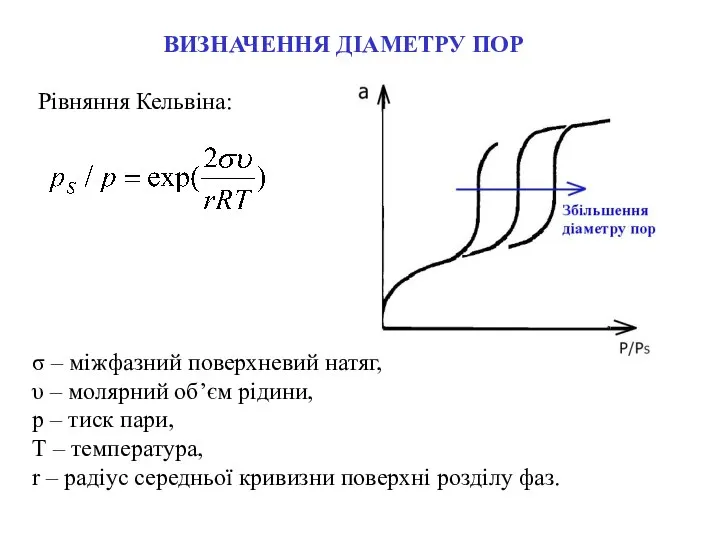
- 13. Рівняння Кельвіна: ВИЗНАЧЕННЯ ДІАМЕТРУ ПОР σ – міжфазний поверхневий натяг, υ – молярний об’єм рідини, р
- 14. 1 – гачок, 2 - скляна ампула на шліфу, 3,4 - відростки для відкачування повітря та
- 15. Сорбція N2 на Co3O4 і на композиті Co3O4/силікагель Y. Wang, C.-M. Yang, W. Schmidt, B. Spliethoff,
- 16. Ізотерми сорбції і десорбції N2 при 77 К (a) вихідної матриці КІТ-6 (b) мезопористого композиту Cr2O3/KIT-6,
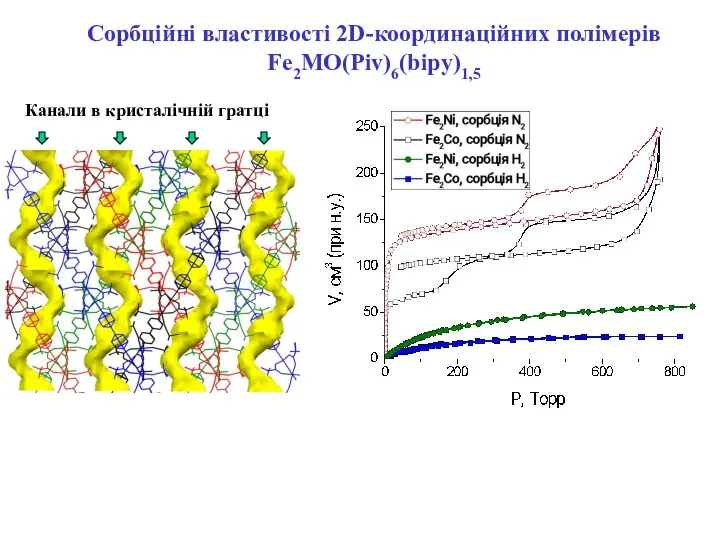
- 17. Канали в кристалічній гратці Сорбційні властивості 2D-координаційних полімерів Fe2MO(Piv)6(bipy)1,5
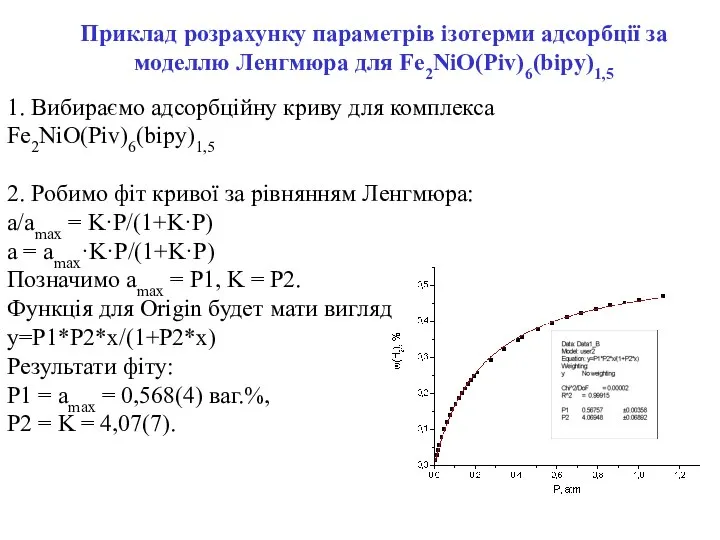
- 18. 1. Вибираємо адсорбційну криву для комплекса Fe2NiO(Piv)6(bipy)1,5 2. Робимо фіт кривої за рівнянням Ленгмюра: a/amax =
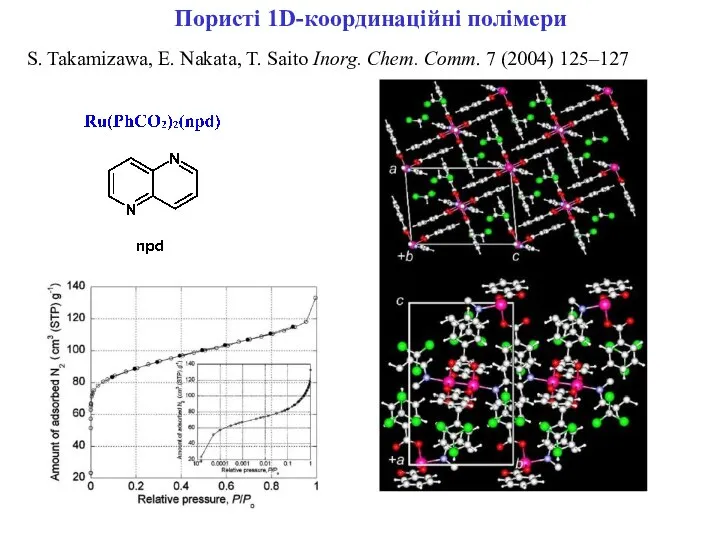
- 19. Пористі 1D-координаційні полімери S. Takamizawa, E. Nakata, T. Saito Inorg. Chem. Comm. 7 (2004) 125–127
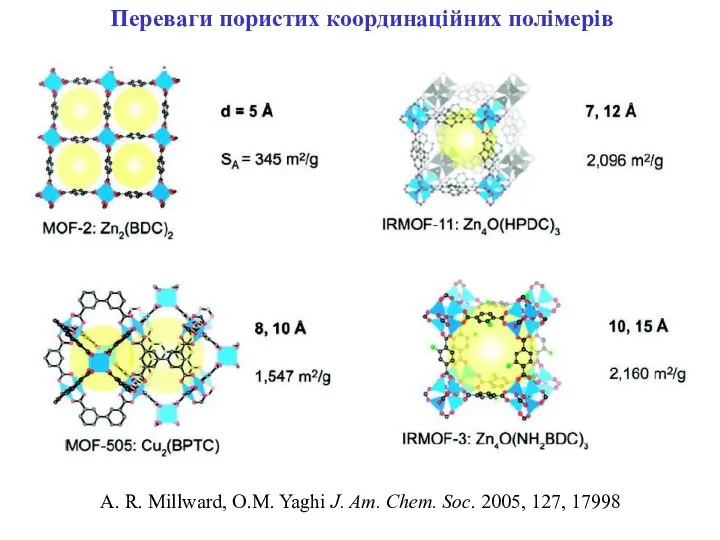
- 20. Переваги пористих координаційних полімерів A. R. Millward, O.M. Yaghi J. Am. Chem. Soc. 2005, 127, 17998
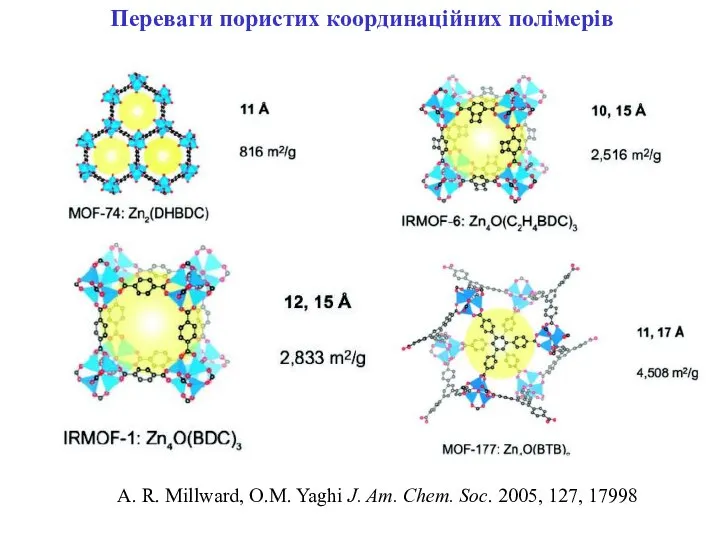
- 21. Переваги пористих координаційних полімерів A. R. Millward, O.M. Yaghi J. Am. Chem. Soc. 2005, 127, 17998
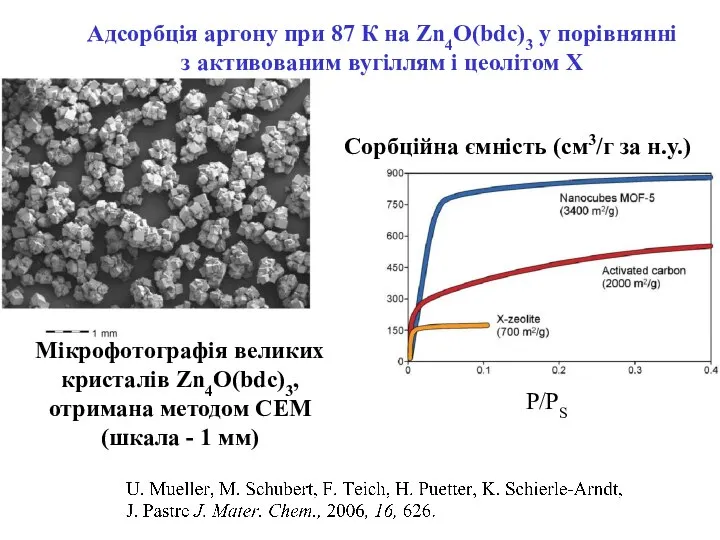
- 22. Мікрофотографія великих кристалів Zn4O(bdc)3, отримана методом СЕМ (шкала - 1 мм) Адсорбція аргону при 87 К
- 23. Порівняння поглинання пропану порожнім контейнером і контейнером з Zn4O(bdc)3. Поглинання С3Н8 (г на 1 літр контейнеру)
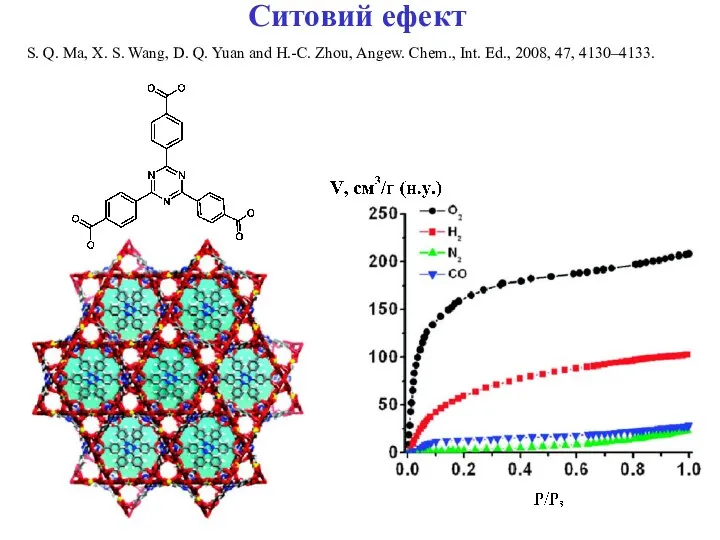
- 24. Ситовий ефект S. Q. Ma, X. S. Wang, D. Q. Yuan and H.-C. Zhou, Angew. Chem.,
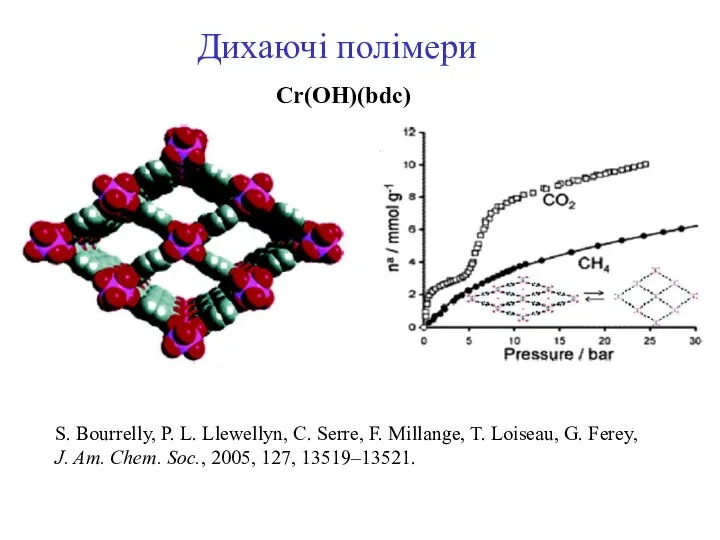
- 25. Дихаючі полімери Cr(OH)(bdc) S. Bourrelly, P. L. Llewellyn, C. Serre, F. Millange, T. Loiseau, G. Ferey,
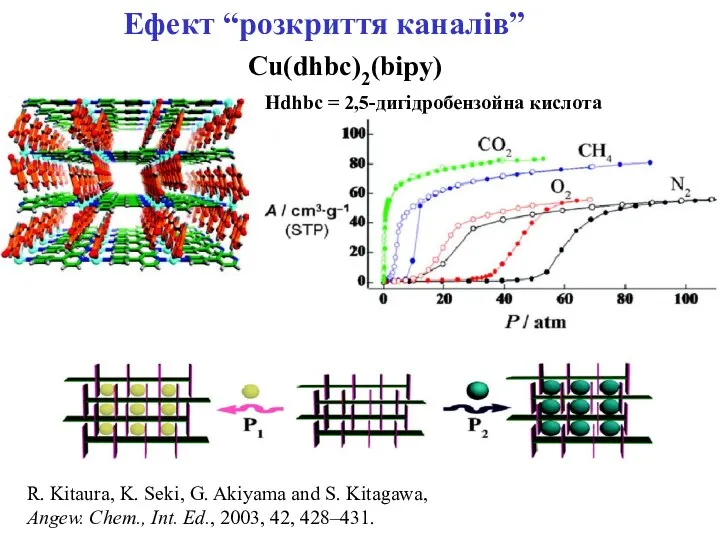
- 26. Ефект “розкриття каналів” Cu(dhbc)2(bipy) Hdhbc = 2,5-дигідробензойна кислота R. Kitaura, K. Seki, G. Akiyama and S.
- 28. Скачать презентацию









 Чертова Ксения 9м2 «Классика в современной обработке»
Чертова Ксения 9м2 «Классика в современной обработке» Ускорение оборачиваемости запасов
Ускорение оборачиваемости запасов  Костюмированные шоу, как средство формирования культуры праздника
Костюмированные шоу, как средство формирования культуры праздника Политика ЕС в области железнодорожного транспорта Петруша
Политика ЕС в области железнодорожного транспорта Петруша Устройства входящие в состав системного блока
Устройства входящие в состав системного блока Инженерные изыскания
Инженерные изыскания Работа Мастер-класс модели растений
Работа Мастер-класс модели растений Бюджет, бюджетное устройство. Бюджетная система РФ.
Бюджет, бюджетное устройство. Бюджетная система РФ.  буква ц - презентация для начальной школы
буква ц - презентация для начальной школы Принципи побудови та методи фізичного виховання. Ключові особливості методики вдосконалення фізичних якостей: сила, швидкість
Принципи побудови та методи фізичного виховання. Ключові особливості методики вдосконалення фізичних якостей: сила, швидкість Introducing the B76CNC3 S Line
Introducing the B76CNC3 S Line 79842
79842 Форменная одежда - мужчин сотрудников ФПС ГПС по нормам проекта постановления Правительства РФ «О вещевом обеспечении в ФПС ГПС»
Форменная одежда - мужчин сотрудников ФПС ГПС по нормам проекта постановления Правительства РФ «О вещевом обеспечении в ФПС ГПС» Масленица
Масленица Ликвидация колей на автомобильных дорогах
Ликвидация колей на автомобильных дорогах Научные школы и теории социальной психологии 3
Научные школы и теории социальной психологии 3 Устойчивость ландшафтов
Устойчивость ландшафтов Презентация на тему "Инновационные медицинские образовательные программы" - скачать презентации по Медицине
Презентация на тему "Инновационные медицинские образовательные программы" - скачать презентации по Медицине Выполнила: учитель обществоведения высшей квалификационной категории Сорокина О.В. Глобализация
Выполнила: учитель обществоведения высшей квалификационной категории Сорокина О.В. Глобализация  Организационная структура ВС РФ
Организационная структура ВС РФ Гидрологические факторы деградации почв и способ их защиты
Гидрологические факторы деградации почв и способ их защиты  Адаптивный спорт
Адаптивный спорт Творческий проект «Умный дом»
Творческий проект «Умный дом» Здоровы ли мы?
Здоровы ли мы? Презентация Правоохранительная деятельность таможенных органов
Презентация Правоохранительная деятельность таможенных органов  Культура России 17 века
Культура России 17 века Рынок труда и безработица
Рынок труда и безработица Тема 5. Маркетинговая информационная система Дисциплина «Основы маркетинга»
Тема 5. Маркетинговая информационная система Дисциплина «Основы маркетинга»