Содержание
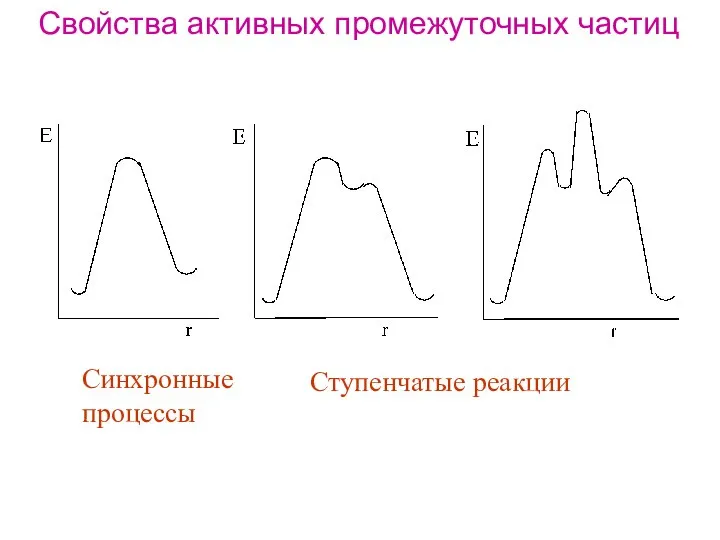
- 2. Свойства активных промежуточных частиц Синхронные процессы Ступенчатые реакции
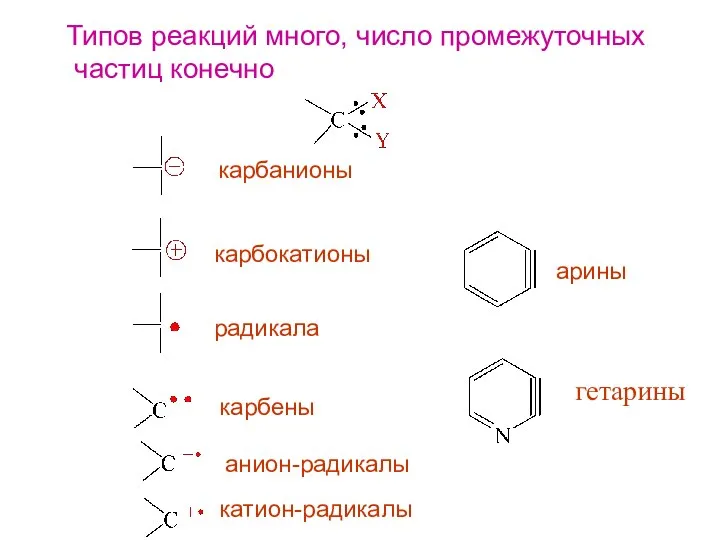
- 3. Типов реакций много, число промежуточных частиц конечно карбанионы карбокатионы радикала карбены анион-радикалы катион-радикалы арины гетарины
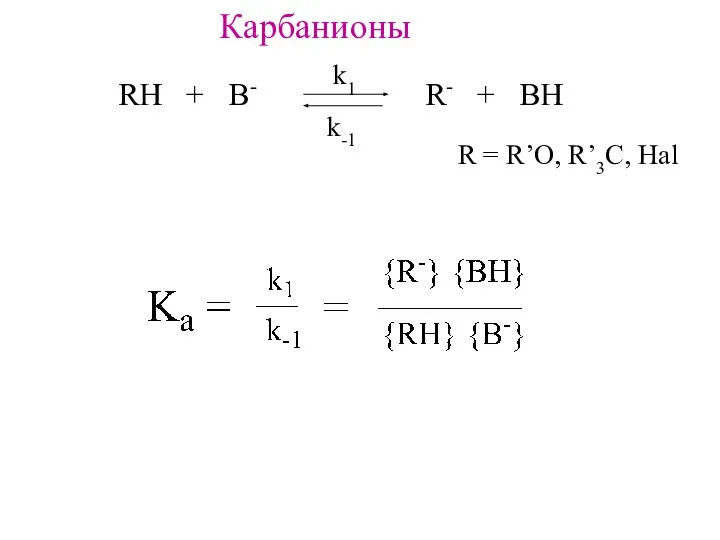
- 4. Карбанионы RH + B- R- + BH k1 k-1 R = R’O, R’3C, Hal
- 5. Кислотность в газовой фазе Кебарле, 1976 г. (ион-циклотронный резонанс) = мера кислотности энергия связи R-H cродство
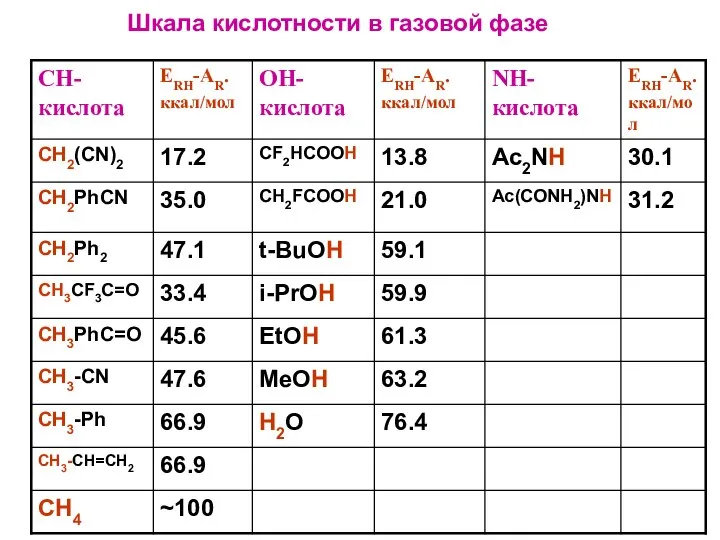
- 6. Шкала кислотности в газовой фазе
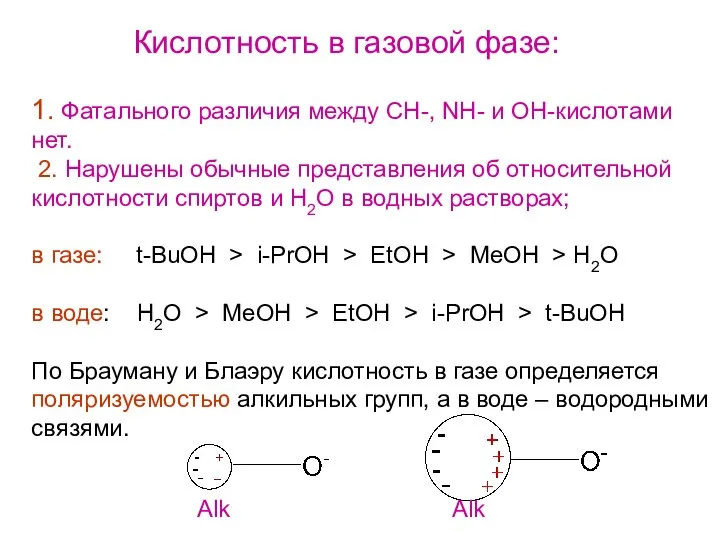
- 7. Кислотность в газовой фазе: 1. Фатального различия между СН-, NH- и OH-кислотами нет. 2. Нарушены обычные
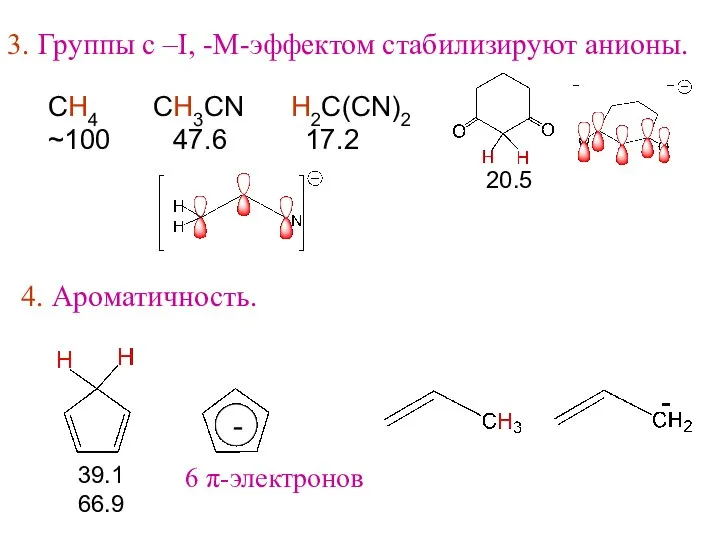
- 8. 3. Группы с –I, -M-эффектом стабилизируют анионы. СН4 СH3CN H2C(CN)2 ~100 47.6 17.2 20.5 4. Ароматичность.
- 9. Кислотность в растворах Равновесная кислотность: RH R- + H+ Методы: спектрофотометрия, ЯМР, ИКС и др. Предел
- 10. Ступенчатый метод Мак-Ивен, 1936 г. ΔPKa
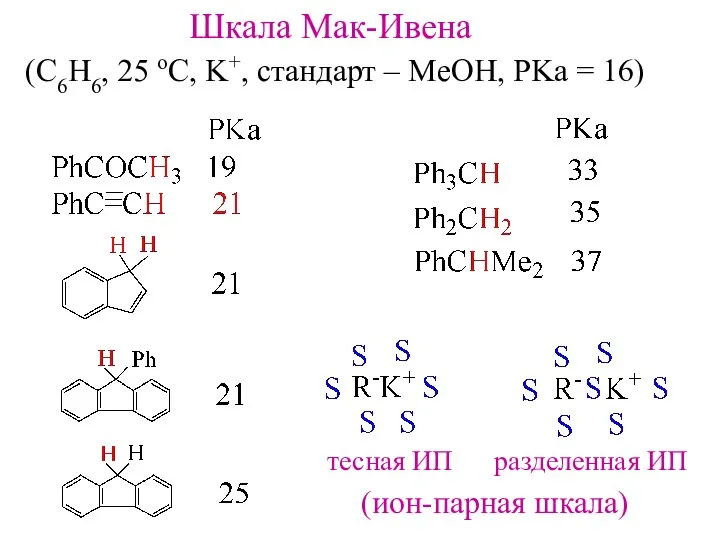
- 11. Шкала Мак-Ивена (C6H6, 25 oC, K+, стандарт – MeOH, PKa = 16) тесная ИП разделенная ИП
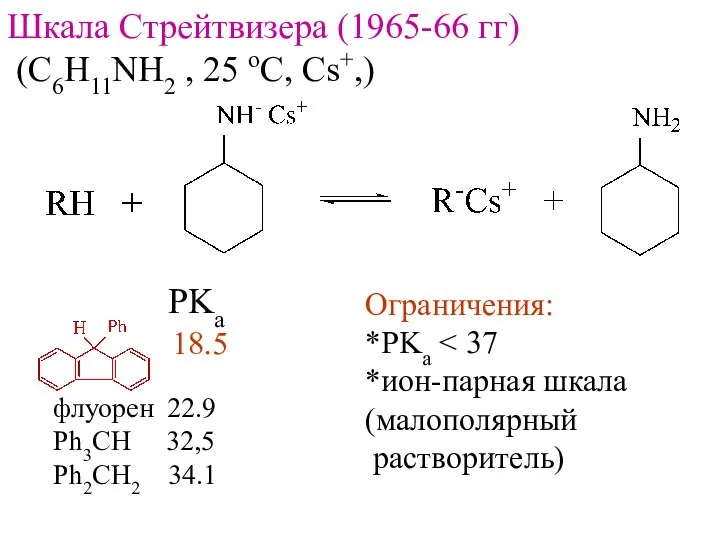
- 12. Шкала Стрейтвизера (1965-66 гг) (C6H11NH2 , 25 oC, Cs+,) PKa 18.5 флуорен 22.9 Ph3CH 32,5 Ph2CH2
- 13. Соотношение Бренстеда lgka = α lgKa + β ka – константа скорости Ka – константа равновесия
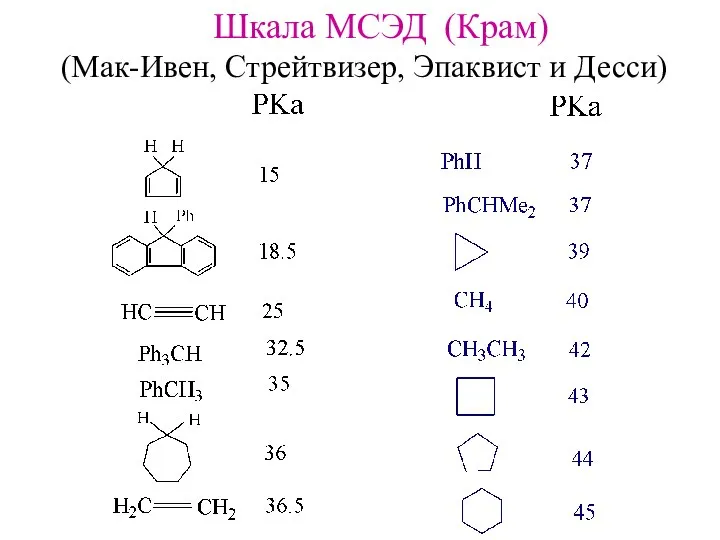
- 14. Шкала МСЭД (Крам) (Мак-Ивен, Стрейтвизер, Эпаквист и Десси)
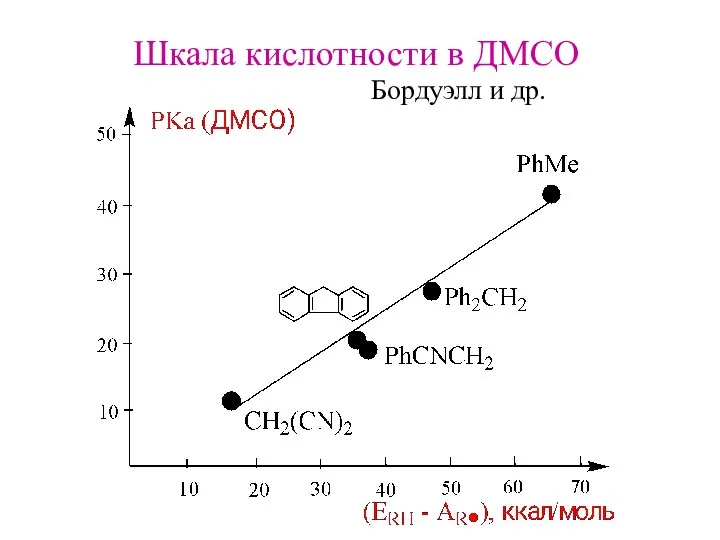
- 15. Шкала кислотности в ДМСО Бордуэлл и др.
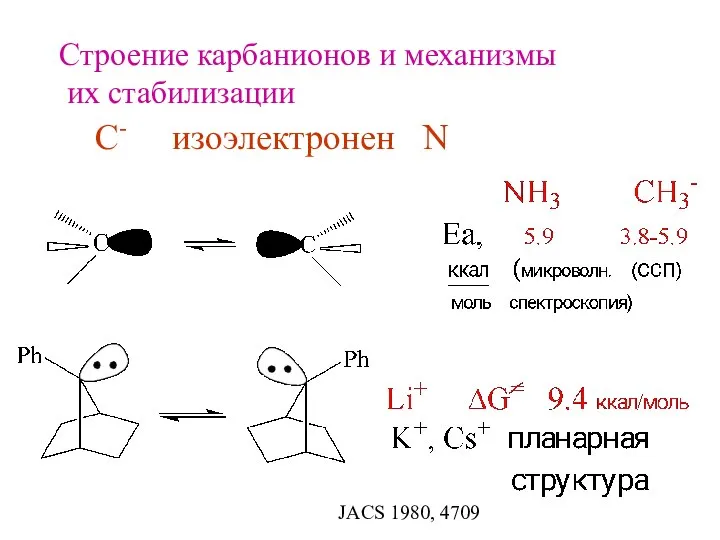
- 16. Строение карбанионов и механизмы их стабилизации С- изоэлектронен N JACS 1980, 4709
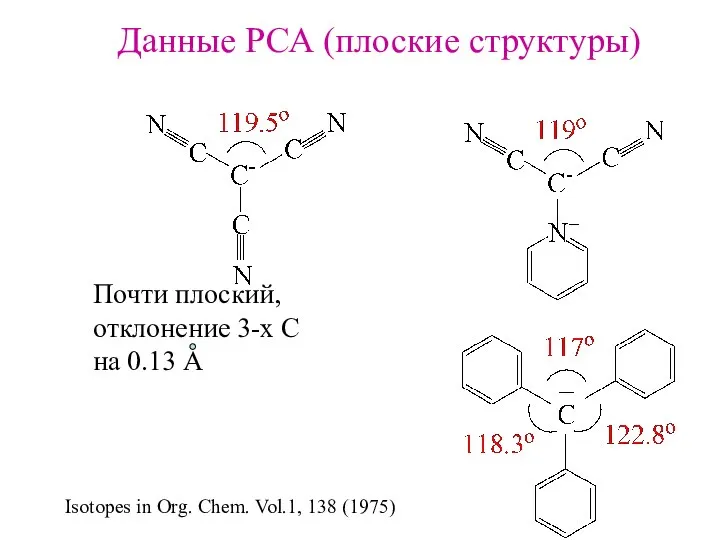
- 17. Данные РСА (плоские структуры) Isotopes in Org. Chem. Vol.1, 138 (1975) Почти плоский, отклонение 3-х С
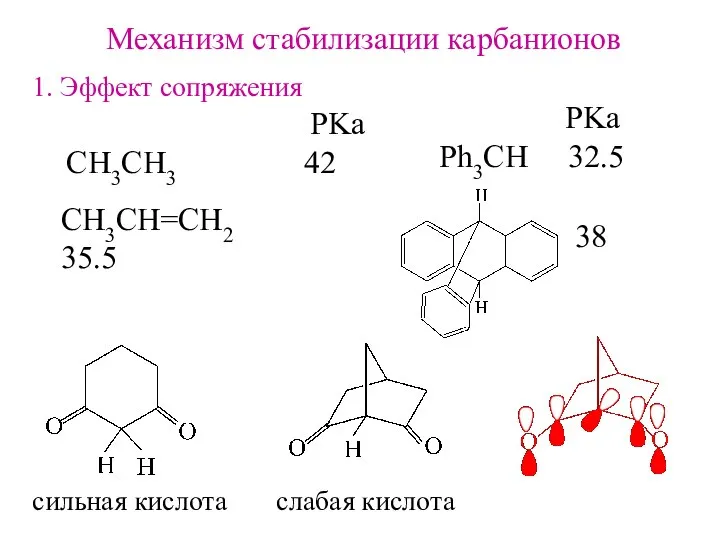
- 18. Механизм стабилизации карбанионов 1. Эффект сопряжения СH3CH3 42 CH3CH=CH2 35.5 PKa Ph3CH 32.5 PKa 38 сильная
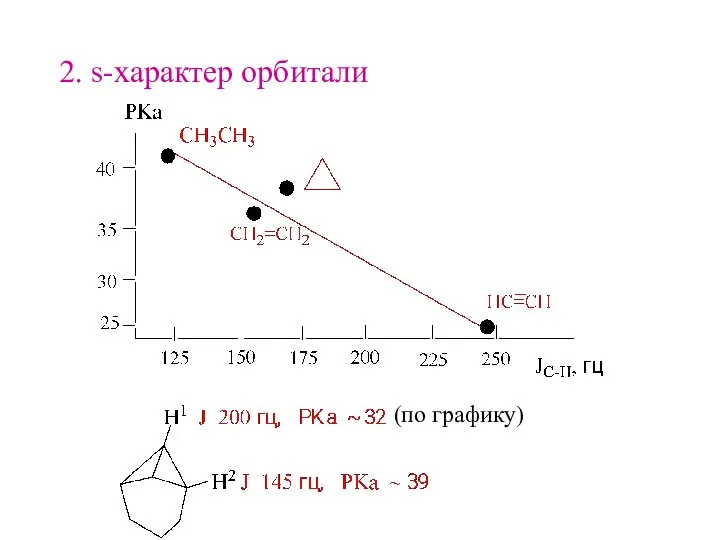
- 19. 2. s-характер орбитали (по графику)
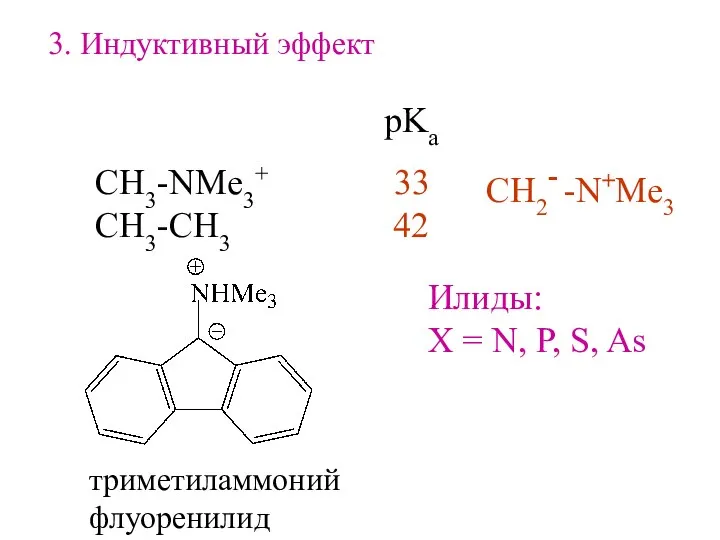
- 20. 3. Индуктивный эффект СH3-NMe3+ 33 CH3-CH3 42 pKa CH2- -N+Me3 Илиды: X = N, P, S,
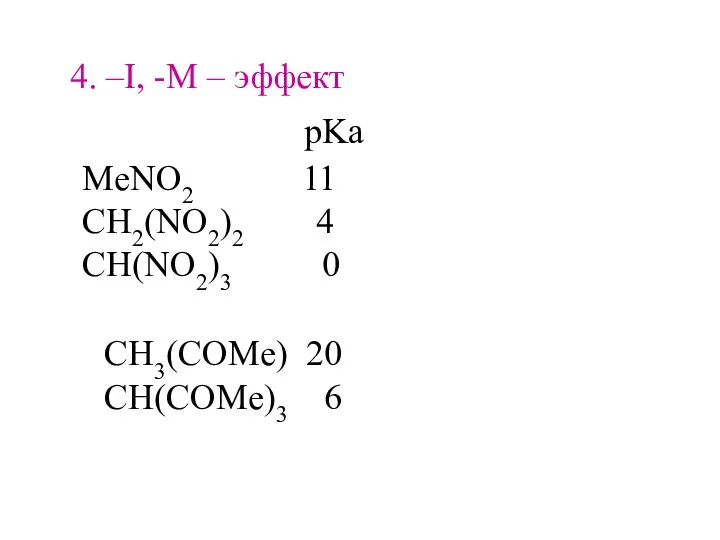
- 21. 4. –I, -M – эффект MeNO2 11 CH2(NO2)2 4 CH(NO2)3 0 pKa CH3(COMe) 20 CH(COMe)3 6
- 23. Скачать презентацию




 Положение о проведении республиканского конкурса на лучшее оформление объектов нематериального культурного наследия
Положение о проведении республиканского конкурса на лучшее оформление объектов нематериального культурного наследия Accelerating Implementation Methodology (AIM)
Accelerating Implementation Methodology (AIM) 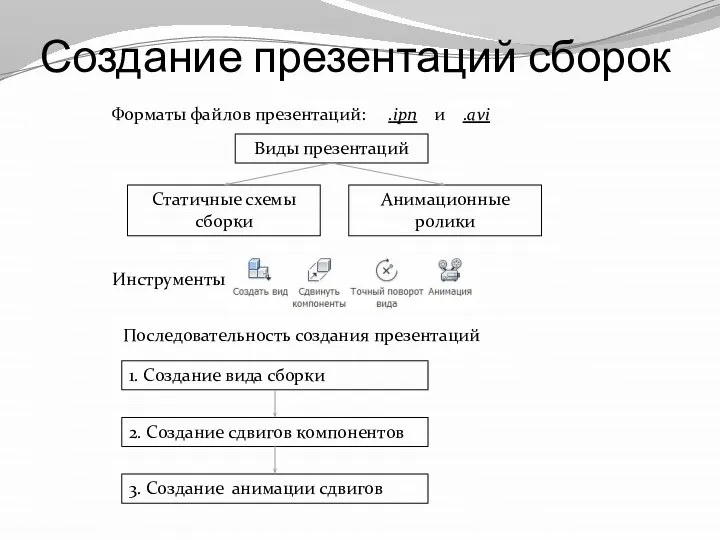 Создание сборок САПР
Создание сборок САПР  Նպատակների դուրս բերում
Նպատակների դուրս բերում Оценка конкурентоспособности коммерческого банка
Оценка конкурентоспособности коммерческого банка  Обыкновенное чудо – люди России
Обыкновенное чудо – люди России Историко-культурные основы религиозного экстремизма. Сущность, задачи и направления специальной пропаганды
Историко-культурные основы религиозного экстремизма. Сущность, задачи и направления специальной пропаганды Виды гимнастики
Виды гимнастики ценовая и неценовая конкуренция сущность и перспективы
ценовая и неценовая конкуренция сущность и перспективы Табель о рангах Подготовила Самосват Наталья, Ю-103
Табель о рангах Подготовила Самосват Наталья, Ю-103 Java GUI (AWT, Swing)
Java GUI (AWT, Swing) Презентация Федеральные налоги во Франции
Презентация Федеральные налоги во Франции «Учебная мотивация»
«Учебная мотивация» Методичні поради щодо підготовки до ЗНО-2015 з української мови і літератури
Методичні поради щодо підготовки до ЗНО-2015 з української мови і літератури Устройства памяти компьютера
Устройства памяти компьютера Презентация ШОКОЛАД
Презентация ШОКОЛАД Контекстная реклама Яндекс.Директ и Google Adwords
Контекстная реклама Яндекс.Директ и Google Adwords Признаки весны - презентация для начальной школы
Признаки весны - презентация для начальной школы Рыночная экономика Цель – изучить понятия деньги, функции денег, виды денег, денежная масса, разделение труда, специализация, основы рыночной экономики, спрос, предложение для: • освоения системы знаний об экономической деятельности и об экономик
Рыночная экономика Цель – изучить понятия деньги, функции денег, виды денег, денежная масса, разделение труда, специализация, основы рыночной экономики, спрос, предложение для: • освоения системы знаний об экономической деятельности и об экономик Дороманская культура Каролингское возрождение. Архитектура, мозаичный и фресковый декор. Капелла Карла Великого в Ахене. Базилик
Дороманская культура Каролингское возрождение. Архитектура, мозаичный и фресковый декор. Капелла Карла Великого в Ахене. Базилик Проявление терроризма против политической деятельности
Проявление терроризма против политической деятельности Компомеры
Компомеры Презентация на тему "Методы воспитания" - скачать презентации по Педагогике
Презентация на тему "Методы воспитания" - скачать презентации по Педагогике PoU_2
PoU_2 Виды спортивного туризма в России и СНГ
Виды спортивного туризма в России и СНГ Прилади спін-хвильової електроніки
Прилади спін-хвильової електроніки Презентация Участие Российской Федерации в международных соглашениях по интеллектуальной собственности
Презентация Участие Российской Федерации в международных соглашениях по интеллектуальной собственности Новейшие нормативные документы Русской Православной Церкви. Поместный собор
Новейшие нормативные документы Русской Православной Церкви. Поместный собор