Содержание
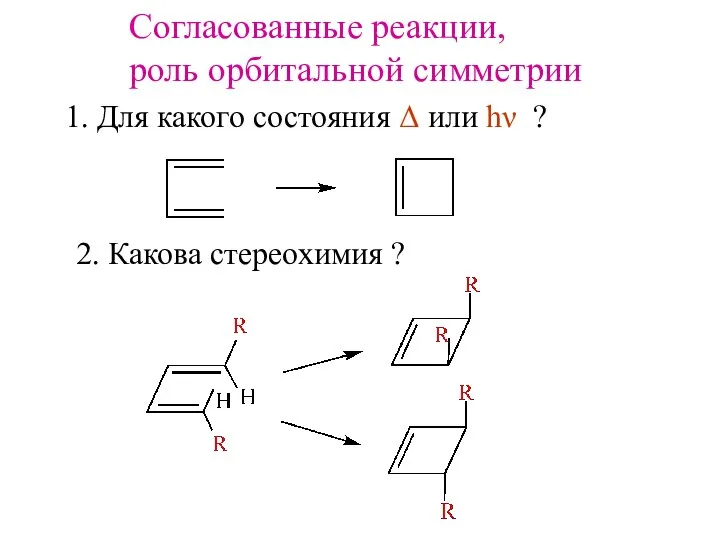
- 2. Согласованные реакции, роль орбитальной симметрии 1. Для какого состояния Δ или hν ? 2. Какова стереохимия
- 3. 1917 – 1979 гг. Национальная научная медаль СШАНациональная научная медаль США (1964) Нобелевская премия по химииНобелевская
- 4. The Nobel Prizes 1981 * Родился в 1937г. (Zloczov, Poland) Roald Hoffmann *1955 г. учеба в
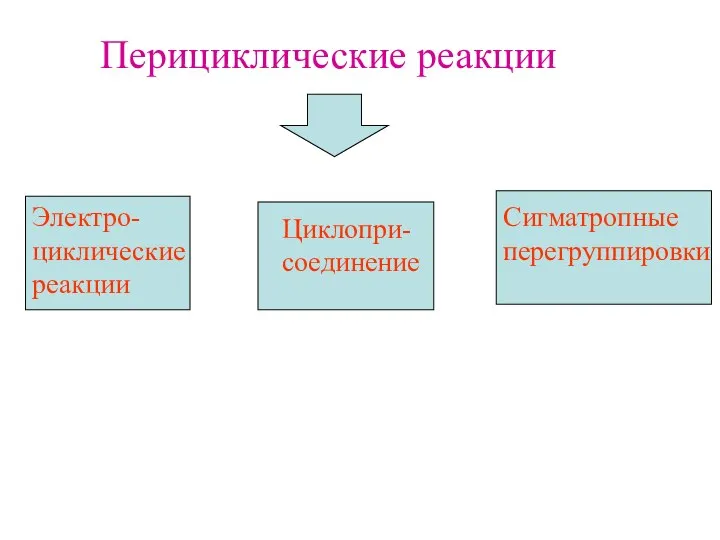
- 5. Перициклические реакции Электро- циклические реакции Циклопри- соединение Сигматропные перегруппировки
- 6. 1965 г. R. Woodward, R. Hoffmann Если есть соответствие симметрии исходного и конечного состояний, то реакция
- 7. дисвращательный путь симметрия МО относительно плоскости Термически запрещен!
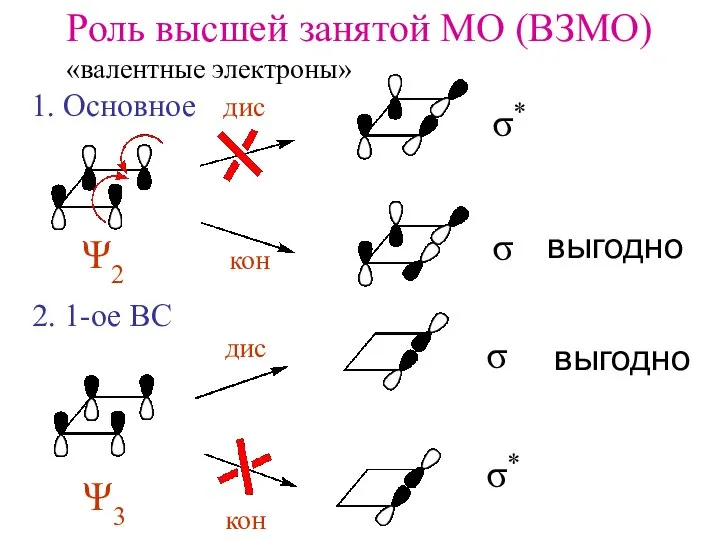
- 8. Роль высшей занятой МО (ВЗМО) «валентные электроны» дис кон кон дис Ψ2 Ψ3 1. Основное 2.
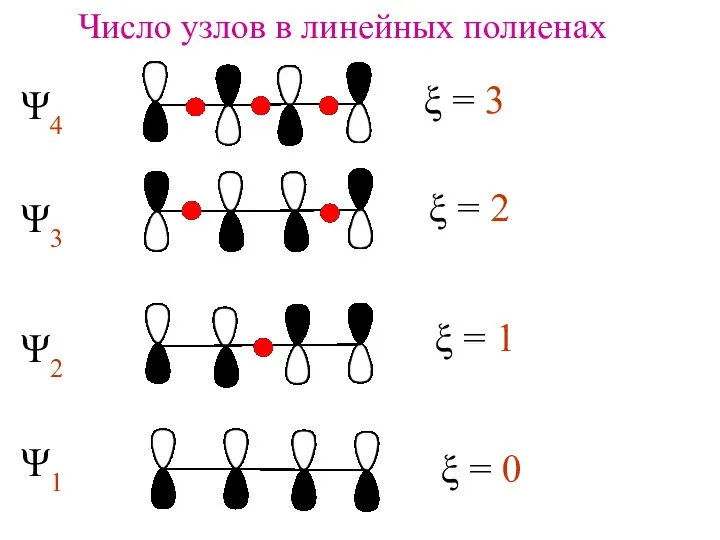
- 9. Число узлов в линейных полиенах ξ = 3 ξ = 2 ξ = 1 ξ =
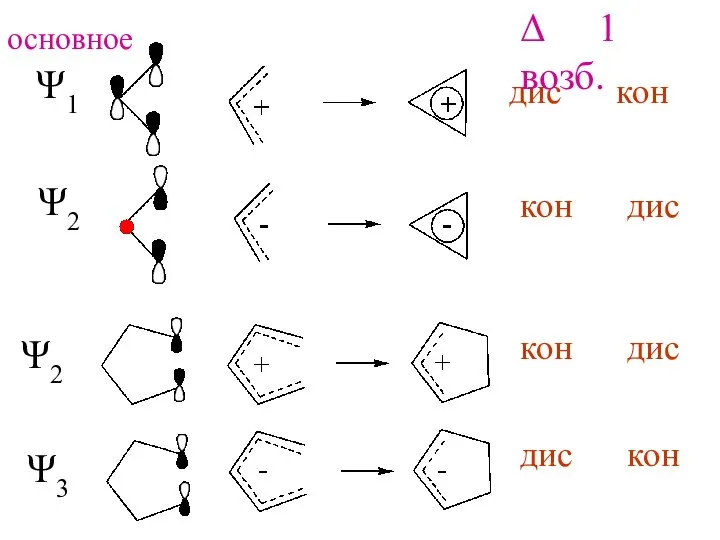
- 10. Роль ВЗМО Реакция Δ 1 возб. кон дис дис кон основное состояние
- 11. Ψ1 Ψ2 Ψ2 Ψ3 дис кон кон дис кон дис дис кон Δ 1 возб. основное
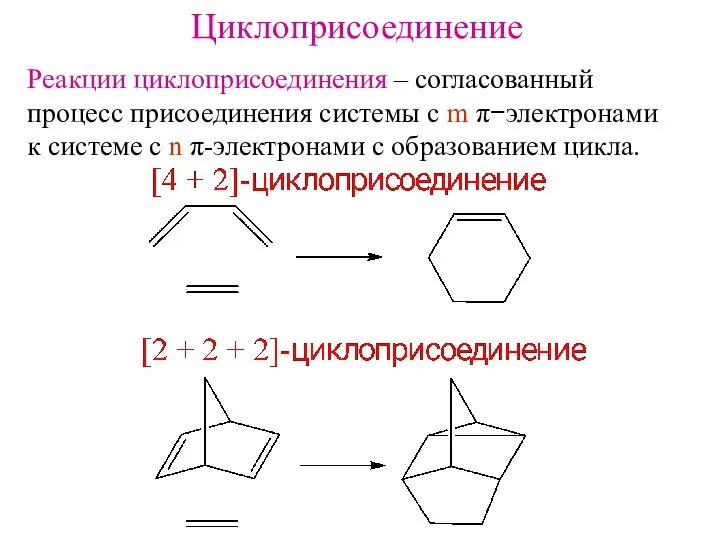
- 12. Циклоприсоединение Реакции циклоприсоединения – согласованный процесс присоединения системы с m π−электронами к системе с n π-электронами
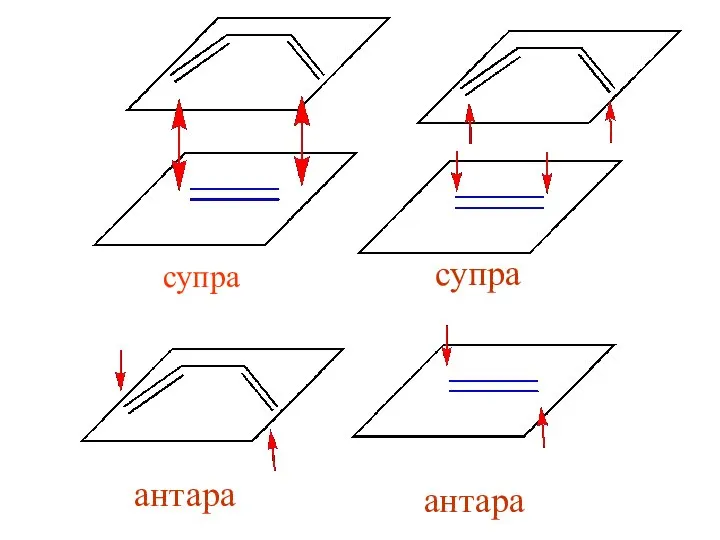
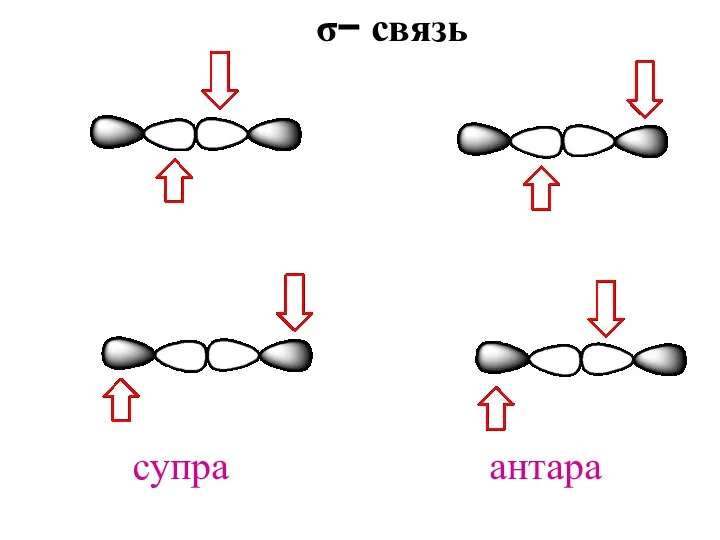
- 13. супра антара антара супра
- 14. Общее правило для перициклических реакций Перициклическая реакция разрешена по симметрии в основном состоянии, если общее число
- 15. π2S + π2S π4S + π2S (4q + 2)S 2 1 (4q)a 0 0 число компонент
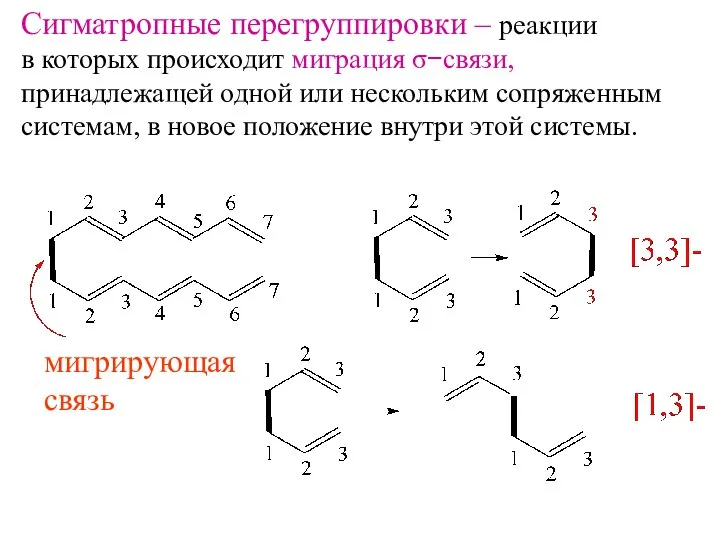
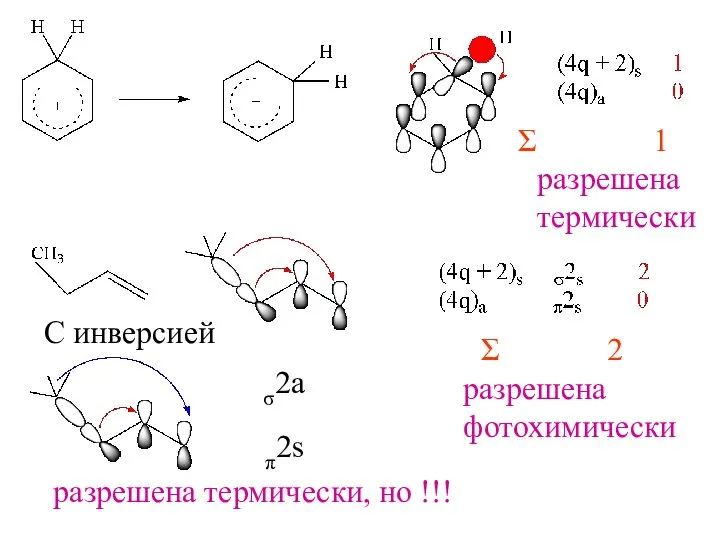
- 16. Сигматропные перегруппировки – реакции в которых происходит миграция σ−связи, принадлежащей одной или нескольким сопряженным системам, в
- 17. супра антара σ− связь
- 18. 1 разрешена термически 2 разрешена фотохимически С инверсией σ2a π2s разрешена термически, но !!!
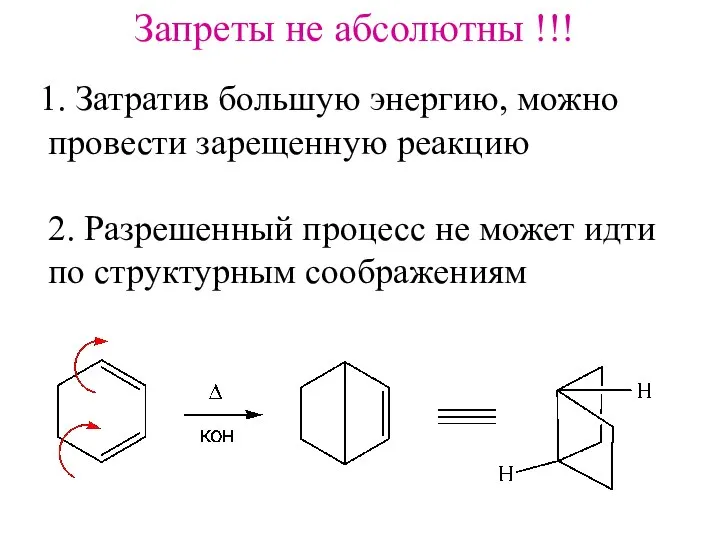
- 19. Запреты не абсолютны !!! Затратив большую энергию, можно провести зарещенную реакцию 2. Разрешенный процесс не может
- 21. Скачать презентацию







 ДОХОДНЫЙ ПОДХОД К ОЦЕНКЕ СТОИМОСТИ МАШИН, ОБОРУДОВАНИЯ И ТРАНСПОРТНЫХ СРЕДСТВ
ДОХОДНЫЙ ПОДХОД К ОЦЕНКЕ СТОИМОСТИ МАШИН, ОБОРУДОВАНИЯ И ТРАНСПОРТНЫХ СРЕДСТВ Педагогические Looки. Одежда
Педагогические Looки. Одежда Коллекция VIDIMA Wave
Коллекция VIDIMA Wave Правовая охрана объектов промышленной собственности
Правовая охрана объектов промышленной собственности Музеи. Парки. Усадьбы
Музеи. Парки. Усадьбы Основные понятия программирования
Основные понятия программирования Ожирение К.Л.Райхельсон СЗГМУ им. И.И.Мечникова
Ожирение К.Л.Райхельсон СЗГМУ им. И.И.Мечникова  Политическая элита
Политическая элита Тест Выполнили: Фунтикова Виктория Хропина Ольга
Тест Выполнили: Фунтикова Виктория Хропина Ольга Прочитай! Не пожалеешь! «Рассказы» К.Д.Ушинский Воспитатель ГПД НОУ «Православная гимназия», г.Братск Анкушева М. Я.
Прочитай! Не пожалеешь! «Рассказы» К.Д.Ушинский Воспитатель ГПД НОУ «Православная гимназия», г.Братск Анкушева М. Я.  Донские сказки
Донские сказки Анализ туристского потенциала Республики Тыва
Анализ туристского потенциала Республики Тыва Цели и задачи коммуникационного менеджмента
Цели и задачи коммуникационного менеджмента  Основы объектно-ориентированного представления программных систем
Основы объектно-ориентированного представления программных систем  Служебный этикет
Служебный этикет Ренессанс и Реформация: в поисках новой личности.
Ренессанс и Реформация: в поисках новой личности. Техническое регулирование: институциональный анализ П.В. Крючкова, д.э.н., зав.сектором Фонда «Бюро экономического анализа»
Техническое регулирование: институциональный анализ П.В. Крючкова, д.э.н., зав.сектором Фонда «Бюро экономического анализа»  Эпоха возрождения
Эпоха возрождения Технология педагогического общения Подготовила и составила студентка 11б/ф группы 1курса факультета иностранных языков ПГСГА Кур
Технология педагогического общения Подготовила и составила студентка 11б/ф группы 1курса факультета иностранных языков ПГСГА Кур Презентация "Путешествие от барокко к классицизму 2" - скачать презентации по МХК
Презентация "Путешествие от барокко к классицизму 2" - скачать презентации по МХК Модели развития бухгалтерского учета в разных странах
Модели развития бухгалтерского учета в разных странах Data Types and Operators (Java, Lecture 04)
Data Types and Operators (Java, Lecture 04) Traditions in Northern Ireland
Traditions in Northern Ireland Эпоха Возрождения в Италии
Эпоха Возрождения в Италии Иудаизм.Время возникновения
Иудаизм.Время возникновения Родительское собрание: как сделать его интересным.
Родительское собрание: как сделать его интересным. Облік у зарубіжних країнах
Облік у зарубіжних країнах Волоконно-оптические элементы
Волоконно-оптические элементы