Содержание
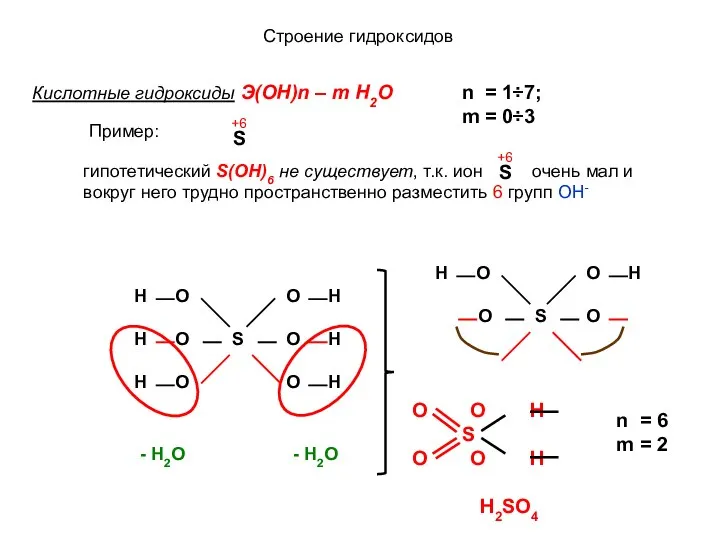
- 2. Строение гидроксидов Кислотные гидроксиды Э(ОН)n – m H2O n = 1÷7; m = 0÷3 Н2SO4 n
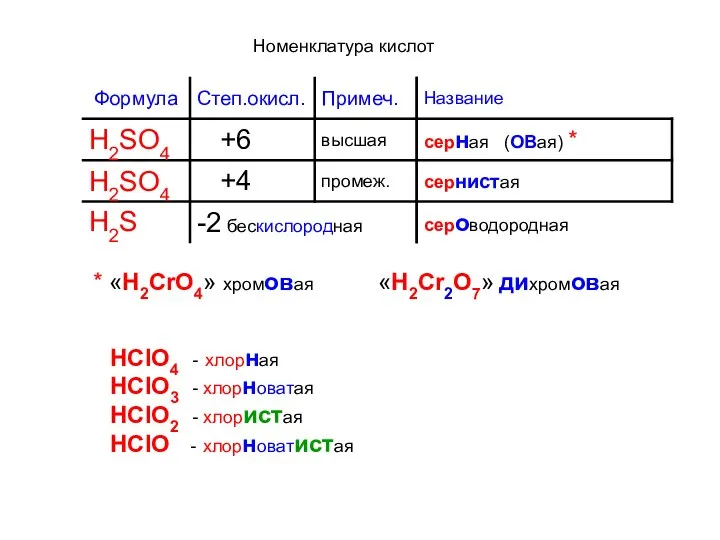
- 3. Номенклатура кислот * «H2CrO4» хромовая «H2Cr2O7» дихромовая HClO4 - хлорная HClO3 - хлорноватая HClO2 - хлористая
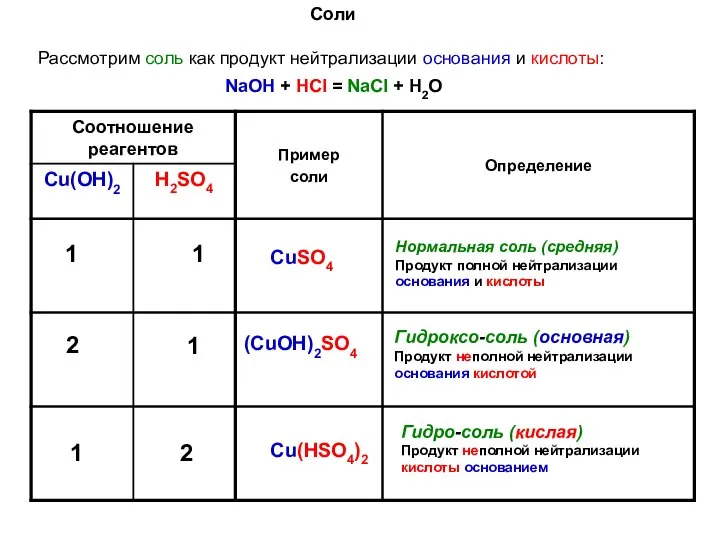
- 4. Соли Рассмотрим соль как продукт нейтрализации основания и кислоты: NaOH + HCl = NaCl + H2O
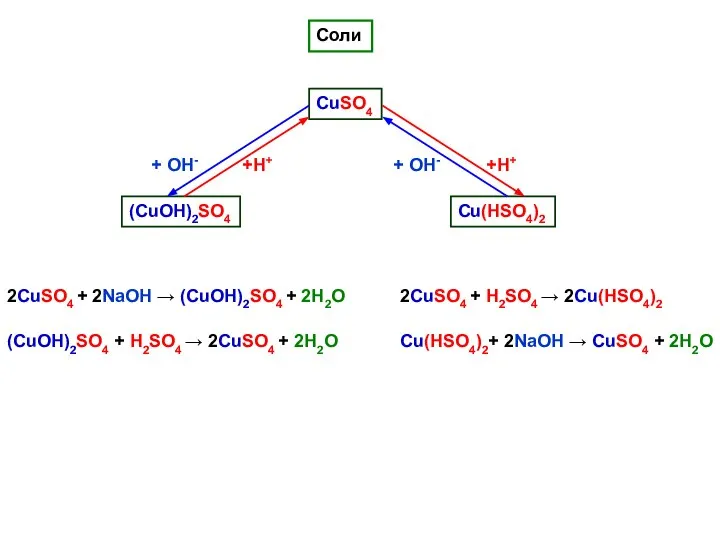
- 5. Соли CuSO4 (CuОН)2SO4 Cu(НSO4)2 2CuSO4 + 2NaOH → (CuОН)2SO4 + 2H2O (CuОН)2SO4 + Н2SO4 → 2CuSO4
- 6. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Все химические реакции можно разделить на несколько видов – соединения, замещения, обмена, разложения и
- 7. Окислительно-восстановительные реакции с изменением степени окисления атомов входящих в состав реагентов, в результате перераспределения электронов Законы
- 8. Окислительно-восстановительные реакции (ОВР) В ОВР следует различать два типа реагентов: 1). Окислители- это такие вещества (атомы,
- 9. ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ПРОДУКТЫ ИХ ВОССТАНОВЛЕНИЯ Простые вещества, образованные атомами элементов с высокой электроотрицательностью F2 +2е-
- 10. ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ПРОДУКТЫ ИХ ВОССТАНОВЛЕНИЯ в) MnO4− MnO4− +5е- ⎯⎯→ Mn2+ (в кислой среде) +3е-
- 11. ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ПРОДУКТЫ ИХ ВОССТАНОВЛЕНИЯ 3. Ионы и оксиды металлов, содержащие элементы в высоких степенях
- 12. ТИПИЧНЫЕ ВОССТАНОВИТЕЛИ И ПРОДУКТЫ ИХ ОКИСЛЕНИЯ Простые вещества, образованные атомами элементов с низкой электроотрицательностью а) Большинство
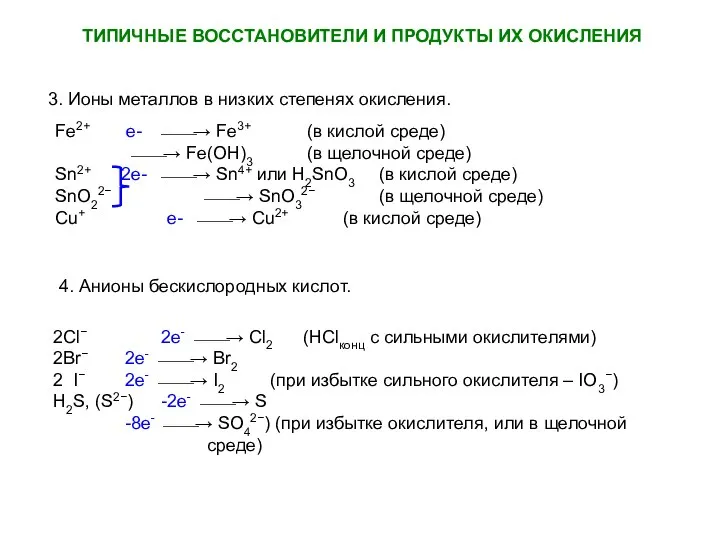
- 13. ТИПИЧНЫЕ ВОССТАНОВИТЕЛИ И ПРОДУКТЫ ИХ ОКИСЛЕНИЯ 3. Ионы металлов в низких степенях окисления. 4. Анионы бескислородных
- 14. ВЕЩЕСТВА С ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ ДВОЙСТВЕННОСТЬЮ Ряд веществ, имеющих элементы в промежуточных степенях окисления, могут участвовать в реакции
- 15. ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ реакциями сопропорционирования реакциями диспропорционирования Cl2 + щёлочь ⎯⎯→ Cl− + ClO− (на холоду)
- 16. Метод ионно-электронного баланса Метод применим для ОВР в водных растворах и учитывает существующие в них молекулы
- 17. Метод ионно-электронного баланса Алгоритм определения стехиометрических коэффициентов 1. Определение элементов (атомы, ионы), степени окисления которых изменяются
- 18. Примеры K2Cr2O7 + Na2SO3 + HNO3 = Cr(NO3)3 + Na2SO4 + KNO3 + H2O 1. Определение
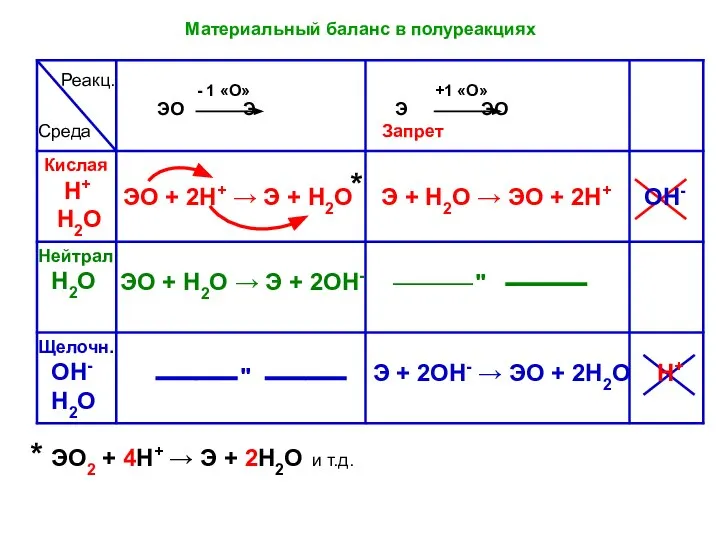
- 19. Среда Запрет * ЭО2 + 4Н+ → Э + 2Н2О и т.д. ЭО + Н2О →
- 21. Скачать презентацию












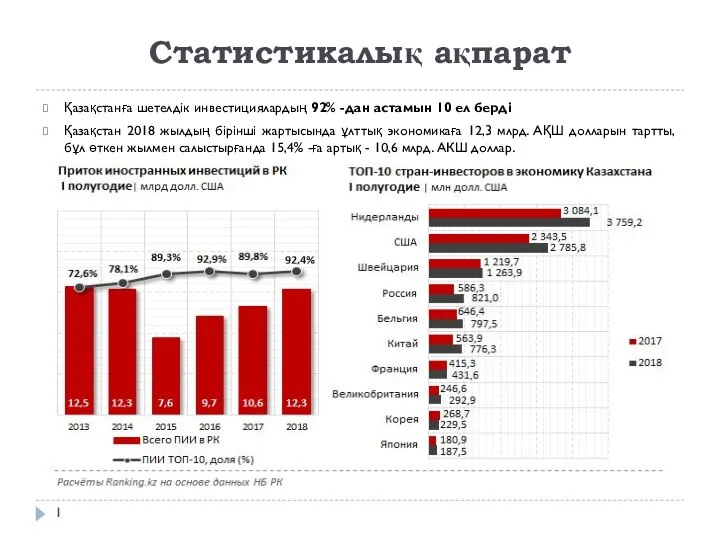 Статистикалық ақпарат
Статистикалық ақпарат Пионерская организация
Пионерская организация Проектирования системы пожарной сигнализации и оповещения о пожаре
Проектирования системы пожарной сигнализации и оповещения о пожаре Автор: Кулакова Наталья Ивановна, учитель начальных классов 2015 год
Автор: Кулакова Наталья Ивановна, учитель начальных классов 2015 год  Особые экономические зоны России (ОЭЗ России) Подготовила студентка Житкова Екатерина 1 курса экономического фак
Особые экономические зоны России (ОЭЗ России) Подготовила студентка Житкова Екатерина 1 курса экономического фак Информационно-правовой портал Гарант. РУ
Информационно-правовой портал Гарант. РУ Связь времен в народном искусстве
Связь времен в народном искусстве МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «ГИМНАЗИЯ №2 г. ВЛАДИВОСТОКА»
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «ГИМНАЗИЯ №2 г. ВЛАДИВОСТОКА» Бизнес-план по развитию крестьянского (фермерского) хозяйства начинающего фермера
Бизнес-план по развитию крестьянского (фермерского) хозяйства начинающего фермера ЛЕКЦИЯ № 3 АБСОЛЮТНЫЕ И ОТНОСИТЕЛЬНЫЕ ВЕЛИЧИНЫ В СТАТИСТИКЕ
ЛЕКЦИЯ № 3 АБСОЛЮТНЫЕ И ОТНОСИТЕЛЬНЫЕ ВЕЛИЧИНЫ В СТАТИСТИКЕ  Родительское собрание Воспитаем вместе Первое родительское собрание Учитель: Моисеева Ирина Александровна
Родительское собрание Воспитаем вместе Первое родительское собрание Учитель: Моисеева Ирина Александровна Проводы Масленицы
Проводы Масленицы Борьба греко-римская
Борьба греко-римская Православный компонент при изучении предмета "Основы духовно-нравственной культуры народов России"
Православный компонент при изучении предмета "Основы духовно-нравственной культуры народов России" Стандарты телефонного общения. Билайн
Стандарты телефонного общения. Билайн Керечан Ганна Іванівна - презентация для начальной школы
Керечан Ганна Іванівна - презентация для начальной школы Латинский язык 8
Латинский язык 8 СТО-ның міндеттері
СТО-ның міндеттері Парные согласные 2 класс - презентация_
Парные согласные 2 класс - презентация_ Отказ от использования гермоконтейнера
Отказ от использования гермоконтейнера Строение вируса гепатита В
Строение вируса гепатита В ДЕЛОВАЯ ПЕРЕПИСКА ЯЗЫК И СТИЛЬ
ДЕЛОВАЯ ПЕРЕПИСКА ЯЗЫК И СТИЛЬ «Стресс в подростковом возрасте»
«Стресс в подростковом возрасте» Книга и творчество Презентация к библиотечному уроку по теме «Художники-иллюстраторы» для 3 класса
Книга и творчество Презентация к библиотечному уроку по теме «Художники-иллюстраторы» для 3 класса План работы молодежного общественного совета при избирательной комиссии Краснодарского края
План работы молодежного общественного совета при избирательной комиссии Краснодарского края Технология несъемной опалубки
Технология несъемной опалубки Средства наблюдения
Средства наблюдения Контроллер клавиатуры
Контроллер клавиатуры