Содержание
- 2. Значение ферментов Любая реакция в организме катализируется ферментами Любая живая клетка содержит набор ферментов «Медицина говорит
- 3. Доказательство белковой природы ферментов Все выделенные ферменты являются белками При гидролизе ферментов образуются аминокислоты Специфичность действия
- 4. Структурная организация фермента Простые ферменты - трипсин, химотрипсин и т.д. Сложные ферменты – содержат белковую часть
- 5. Структура фермента Первичная структура (1о) - последовательность аминокислот соединенных пептидной связью Вторичная структура (2о) - α−спираль
- 6. Активный центр фермента Активный центр - это несколько аминокислотных остатков, которые в ходе ферментативного катализа реагируют
- 7. Локализация ферментов в клетке Компартменты - места локализации ферментов в клетке. Ядро - репликация/синтез ДНК, синтез
- 8. Изоферменты Изоферменты - множественные молекулярные формы данной особи, катализирующие одну и туже реакцию, но отличающиеся друг
- 9. Отличие ферментов от неорганических катализаторов Высокая молекулярная активность ферментов Специфичность: - абсолютная, - относительная.
- 10. Виды специфичности Абсолютная специфичность - один фермент имеет один субстрат. Объясняет теория Фишера («ключ-замок»). Относительная специфичность
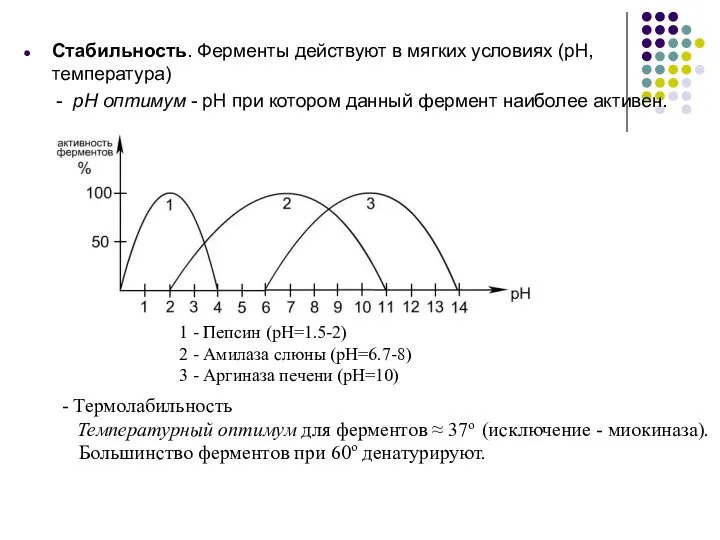
- 11. Стабильность. Ферменты действуют в мягких условиях (pH, температура) - pH оптимум - pH при котором данный
- 12. Энзимы в медицине Энзимопатология - изучает заболевания, связанные с нарушением действия ферментов (энзимопатия). Энзимопатии: - наследственная
- 13. Энзимодиагностика - определение активности фермента. Чтобы повысить эффективность диагностики заболеваний надо изучать: 1. Активность нескольких ферментов
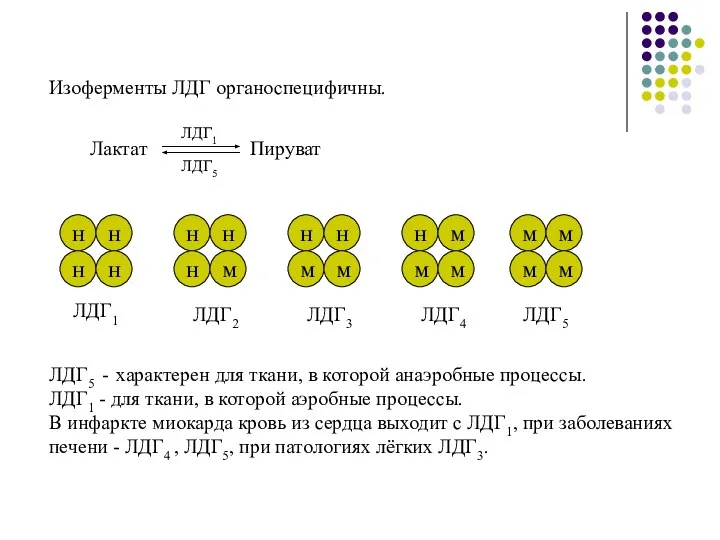
- 14. Изоферменты ЛДГ органоспецифичны. ЛДГ1 ЛДГ2 ЛДГ3 ЛДГ4 ЛДГ5 ЛДГ5 - характерен для ткани, в которой анаэробные
- 15. Креатинфосфокиназа (КФК) Изофермент BB - ткани мозга, MM - скелетные мышцы, MB - миокард. При инфаркте
- 16. АСТ и АЛТ АСТ - имеет двойную локализацию (митохондрии и цитоплазма) АЛТ - локализуется только в
- 17. Активность щелочной фосфатазы увеличивается при рахите, механической желтухе и патологии костной ткани. Активность кислой фосфатазы увеличивается
- 18. Острый панкреатит Увеличена активность: - амилаза крови и мочи, - липаза, - фосфолипаза, - трипсин, -
- 19. Мультиферментные комплексы Мультиферментный комплекс - это комплекс, в котором принимают участие несколько ферментов, при этом продукт
- 21. Скачать презентацию
















 Формирование руководителем образовательного учреждения творческого потенциала педагога в профессиональной деятельности
Формирование руководителем образовательного учреждения творческого потенциала педагога в профессиональной деятельности ПРОГРАММА ПАТРИОТИЧЕСКОГО ВОСПИТАНИЯ ШКОЛЬНИКОВ
ПРОГРАММА ПАТРИОТИЧЕСКОГО ВОСПИТАНИЯ ШКОЛЬНИКОВ Народные праздничные обряды. Свадьба коми
Народные праздничные обряды. Свадьба коми Портфоліо Свищо Андрія Андрійовича учителя інформатики та фізики Олешницької загальноосвітньої школи І-ІІІ ступенів
Портфоліо Свищо Андрія Андрійовича учителя інформатики та фізики Олешницької загальноосвітньої школи І-ІІІ ступенів Камерная нагревательная печь фирмы Bosio в кузнечно-прессовом цехе
Камерная нагревательная печь фирмы Bosio в кузнечно-прессовом цехе Живое кино 2019
Живое кино 2019 Параметры и характеристики приемных устройств
Параметры и характеристики приемных устройств Топ-10: Әлемдегі ең жас Президенттер, Премьер-министрлер, Депутаттар
Топ-10: Әлемдегі ең жас Президенттер, Премьер-министрлер, Депутаттар Informatika2.ppt
Informatika2.ppt Биос - его структура и роль в компьютере. Автопроверка компьютера на разных стадиях его работы
Биос - его структура и роль в компьютере. Автопроверка компьютера на разных стадиях его работы Проблемы развития сестричества в настоящее время и пути их решения
Проблемы развития сестричества в настоящее время и пути их решения Выветривание
Выветривание Методы структурированной оценки: SWOT анализ, концептуальная карта, цветовое голосование Вадим Маршаков Екатерина Кузнецова Ю
Методы структурированной оценки: SWOT анализ, концептуальная карта, цветовое голосование Вадим Маршаков Екатерина Кузнецова Ю Программирование на языке C++
Программирование на языке C++ Ағатайым сені сағындым
Ағатайым сені сағындым Проект – презентация «Школьная раздевалка»
Проект – презентация «Школьная раздевалка» Резьбовые соединения. Образование резьбы
Резьбовые соединения. Образование резьбы Достижения и противоречия индустриальной цивилизации
Достижения и противоречия индустриальной цивилизации  Презентация учителя истории МОУ «СОШ №105» Сидоровой Е.Ю.
Презентация учителя истории МОУ «СОШ №105» Сидоровой Е.Ю. Презентация "Скульптура Древней Греции" - скачать презентации по МХК
Презентация "Скульптура Древней Греции" - скачать презентации по МХК Распределенные вычислительные системы
Распределенные вычислительные системы Электрический ток
Электрический ток Язык программирования Python
Язык программирования Python Оператор ветвления Switch
Оператор ветвления Switch От Йосиф Христофоров Хинов, Виолина Дин Нгуен и Сияна Тринх Нгуен Специалност – ИТ 40 Група
От Йосиф Христофоров Хинов, Виолина Дин Нгуен и Сияна Тринх Нгуен Специалност – ИТ 40 Група Особенности управления командой как человеческим ресурсом. Тема 2
Особенности управления командой как человеческим ресурсом. Тема 2 Инвестиционное предложение
Инвестиционное предложение Reikartz Hotel Group
Reikartz Hotel Group