Содержание
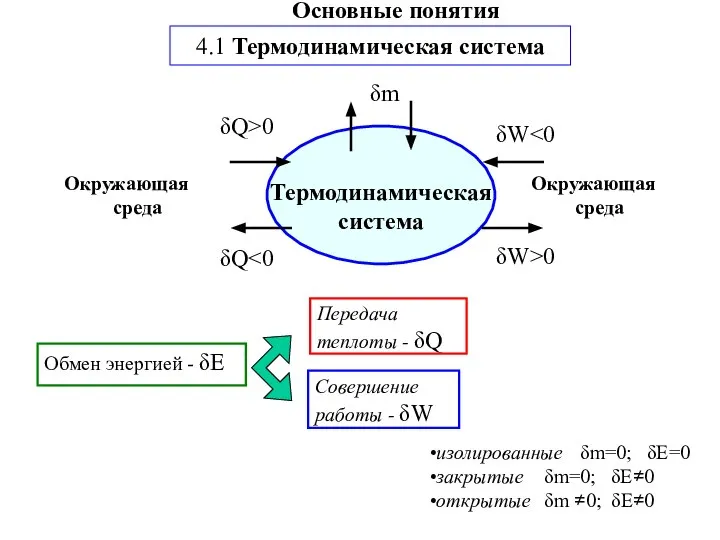
- 2. Передача теплоты - δQ Совершение работы - δW изолированные δm=0; δE=0 закрытые δm=0; δE≠0 открытые δm
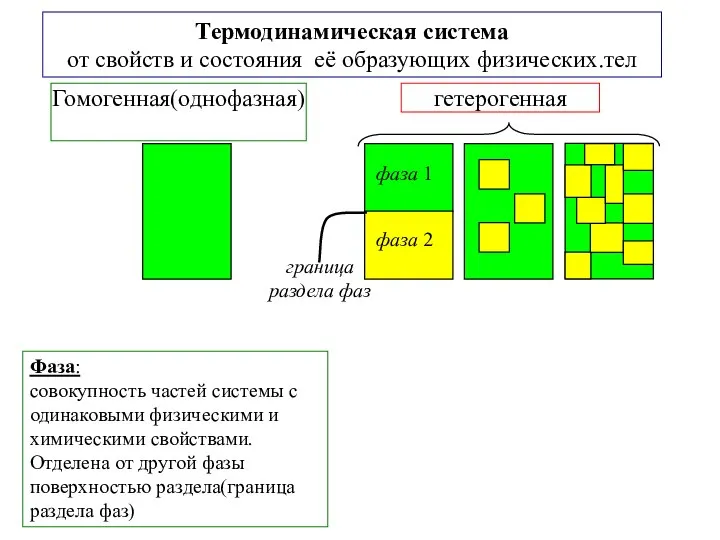
- 3. Фаза: совокупность частей системы с одинаковыми физическими и химическими свойствами. Отделена от другой фазы поверхностью раздела(граница
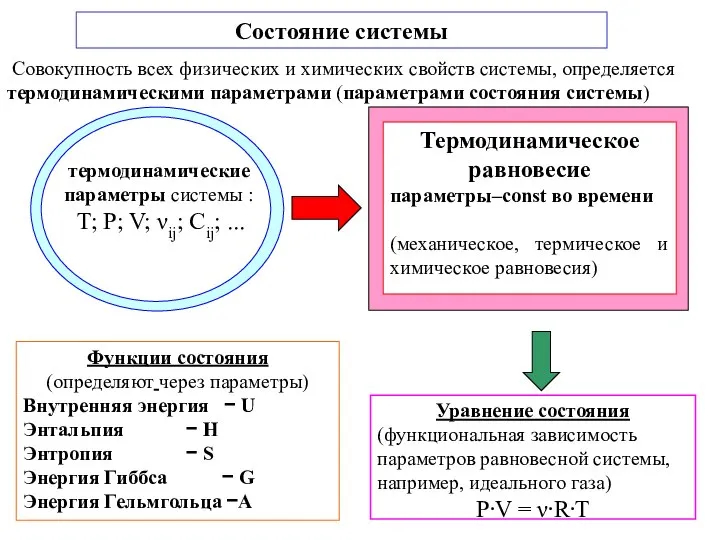
- 4. Функции состояния (определяют через параметры) Внутренняя энергия − U Энтальпия − H Энтропия − S Энергия
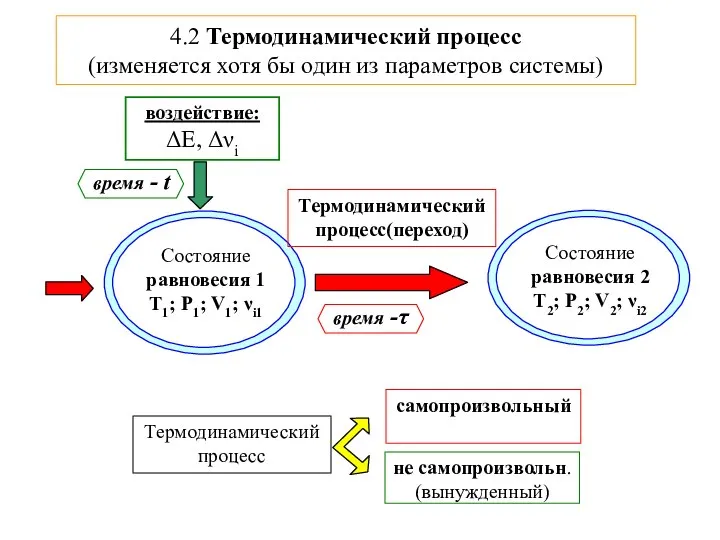
- 5. 4.2 Термодинамический процесс (изменяется хотя бы один из параметров системы)
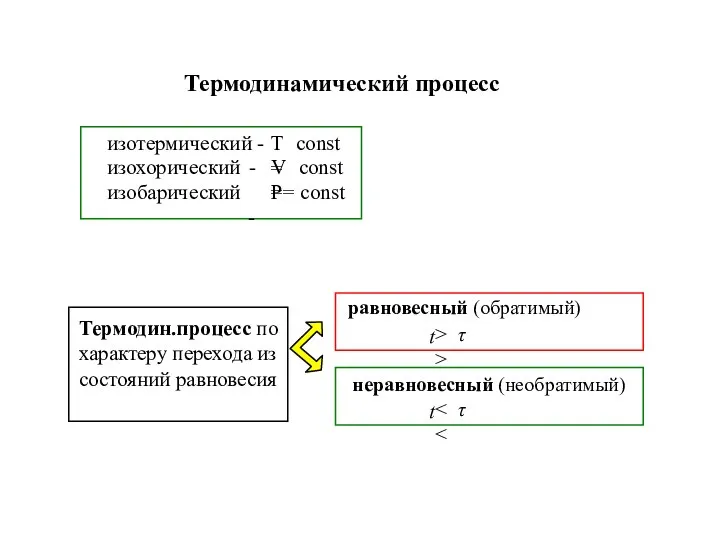
- 6. Термодинамический процесс
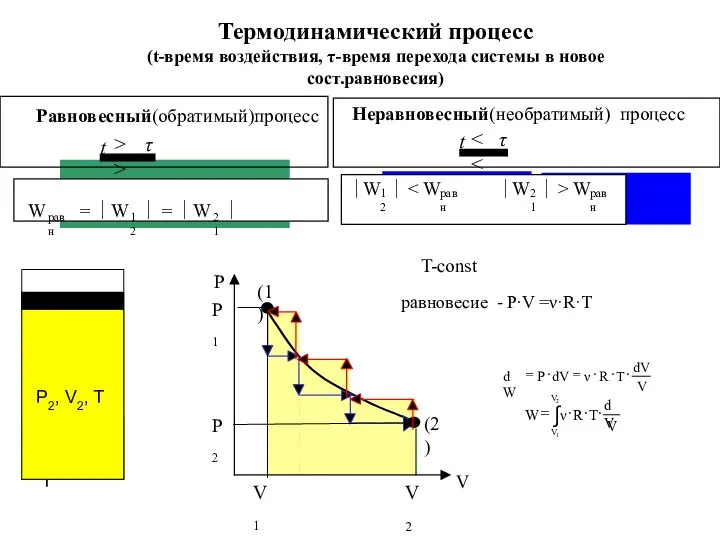
- 7. T-const Термодинамический процесс (t-время воздействия, τ-время перехода системы в новое сост.равновесия) равновесие - P∙V =ν·R·T
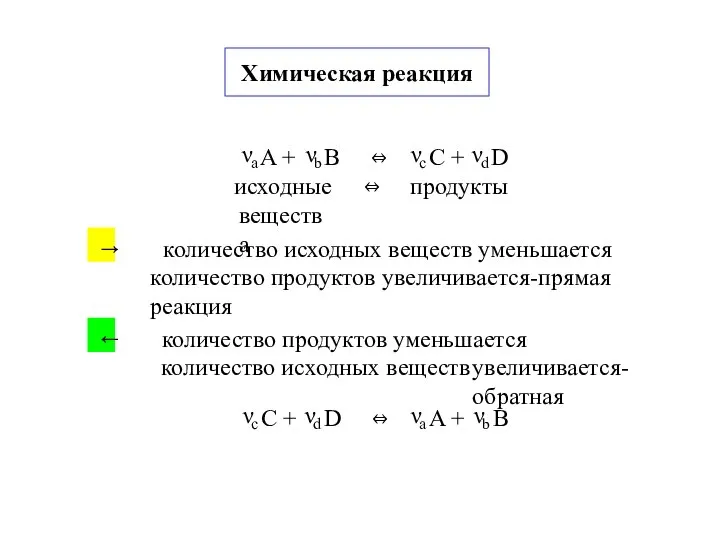
- 8. Химическая реакция
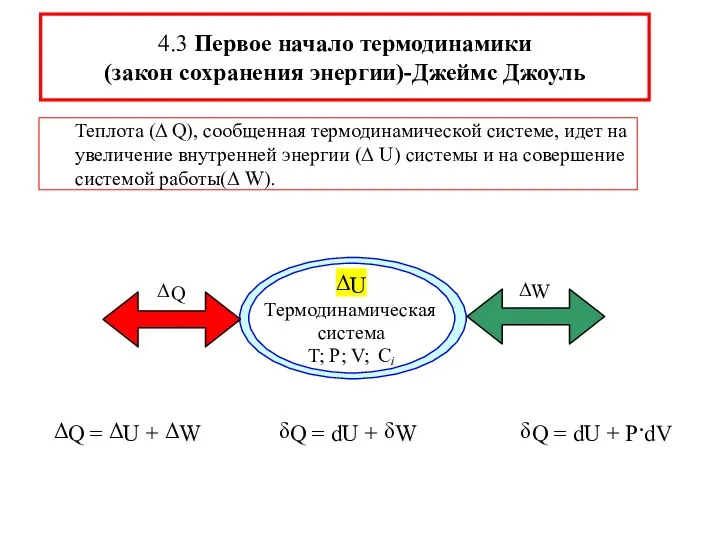
- 9. Теплота (Δ Q), сообщенная термодинамической системе, идет на увеличение внутренней энергии (Δ U) системы и на
- 10. Величину U характеризует Т. Если Т2 > Т1, то UТ2 >UТ1 Термодинамическая шкала температур Т, К
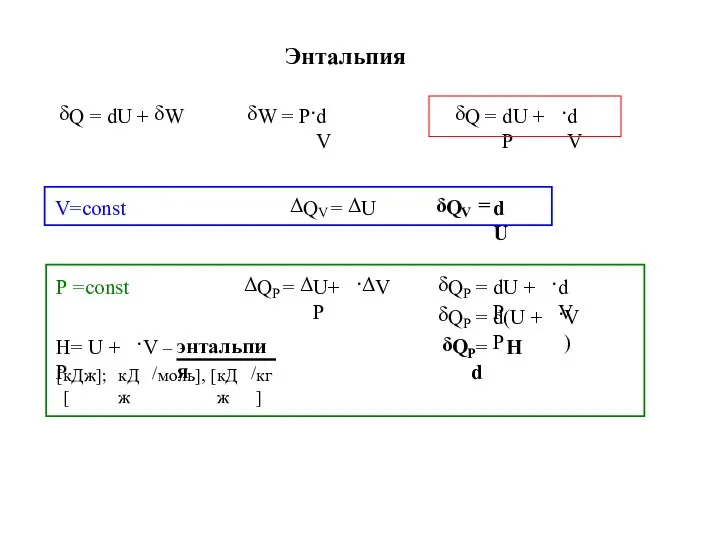
- 11. Энтальпия
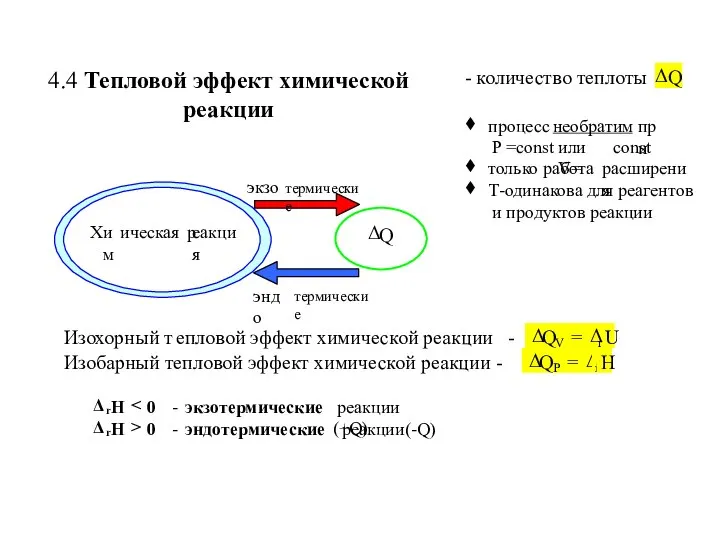
- 12. 4.4 Тепловой эффект химической реакции
- 13. Закон Гесса «тепловой эффект реакции зависит только от вида и состояния исходных веществ и конечных продуктов
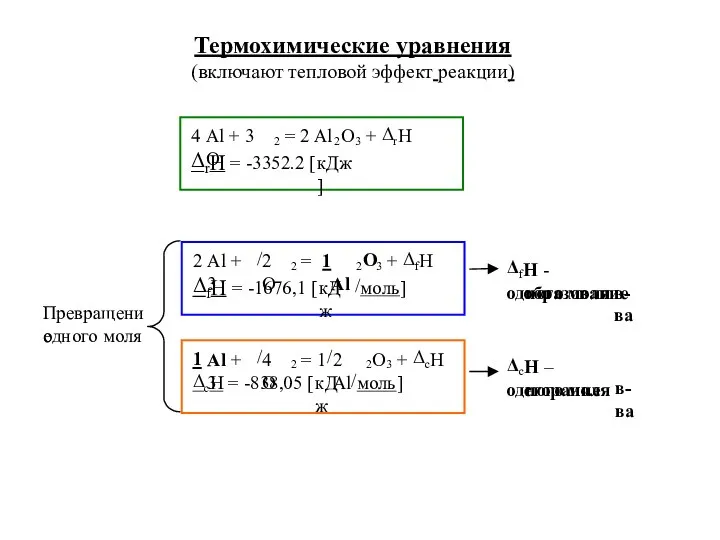
- 14. Термохимические уравнения (включают тепловой эффект реакции)
- 15. Стандартные условия: Р0 = 1,013⋅105 Па Т0 = 298,15 К С0 = 1моль/л ΔfН0298 стандартная энтальпия(теплота)
- 16. Следствие из закона Гесса: ΔrН0298 = (∑ νiΔfН0i)продукты – (∑ νiΔfН0i)исходные вещества Пример. реакция : CH4
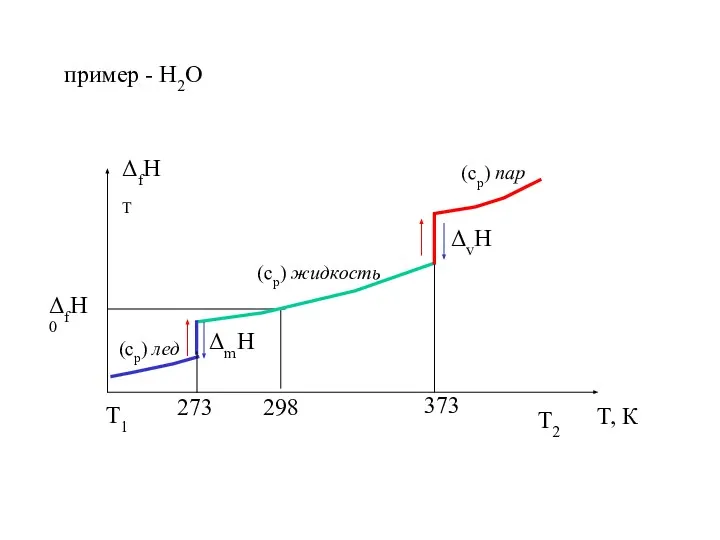
- 17. Зависимость теплового эффекта реакции от температуры
- 18. пример - Н2О T2 T1
- 19. 4.5 Второе начало термодинамики dU + p⋅dV -T⋅dS ≤ 0, dU=dV=0 → TdS≥0 → dS≥0 в
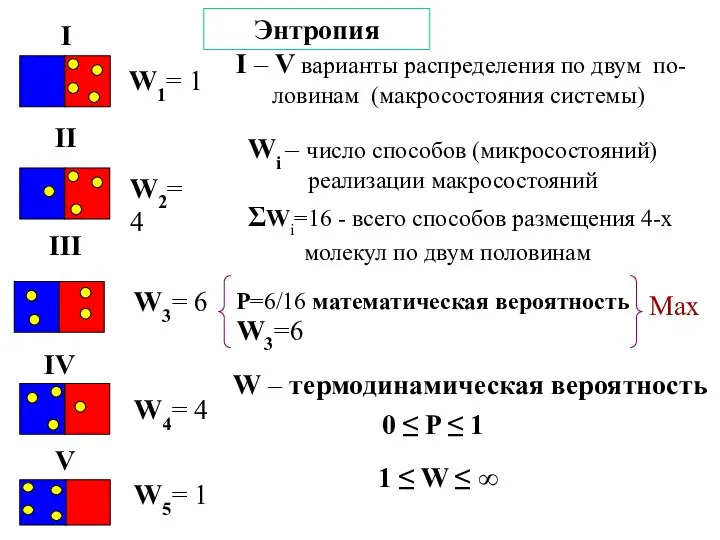
- 20. Энтропия W1= 1 W2= 4 W3= 6 W4= 4 W5= 1 I – V варианты распределения
- 21. S = k⋅lnW k = 1,38⋅10-23Дж/К – константа Больцмана (k = R/NА) W – термодинамическая вероятность
- 22. В изолированной системе самопроизвольно будут протекать процессы с увеличением термодинамической вероятности, а состояние равновесия соответствует состоянию
- 23. S [Дж/К] S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии
- 24. 4.6 Энергия Гиббса. Направление химического процесса
- 25. Энергия Гиббса реакции Энергии Гиббса образования в-ва ΔG0298 ΔrG0298 = (∑ νi⋅ΔfG0i)продукты – (∑ νi⋅ΔfG0i)исходные вещества
- 26. Температурная зависимость ΔrG Направление протекания химической реакции
- 27. Энергия Гиббса реакции С ≠С0 ΔfGi =ΔfG0i + R⋅T⋅lnCi ΔrG = (νc⋅ΔfG0C+ νd⋅ΔfG0D ) – (νa⋅ΔfG0A+νb⋅ΔfG0B)
- 28. 4.7 Равновесие
- 30. Скачать презентацию








![S [Дж/К] S0298 [Дж/моль⋅К] Факторы влияющие на величину энтропии](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1300272/slide-22.jpg)





 Масленица Кустодиев Борис Михайлович (1878-1927) (автопортрет) 5 класс Учитель: Перевозникова Е.В.
Масленица Кустодиев Борис Михайлович (1878-1927) (автопортрет) 5 класс Учитель: Перевозникова Е.В. ҚР оңтүстік аймақтарын табиғи газбен жабдықтау мәселелері
ҚР оңтүстік аймақтарын табиғи газбен жабдықтау мәселелері Инфекции
Инфекции Виды, разрезы, сечения
Виды, разрезы, сечения Индукционная плита
Индукционная плита Тематический урок русского языка с элементами ПДД.
Тематический урок русского языка с элементами ПДД. В поисках Истины
В поисках Истины Презентация Совет безопасности РФ
Презентация Совет безопасности РФ Презентация ООО «Допинг» для Freedom концерт-холл
Презентация ООО «Допинг» для Freedom концерт-холл Сохранение и популяризация историко-культурного и природного наследия Арктики: возможности компьютерной игры
Сохранение и популяризация историко-культурного и природного наследия Арктики: возможности компьютерной игры Меланоцитарные и нейрогенные опухоли
Меланоцитарные и нейрогенные опухоли правила личной гигиены Выполнила: Замараева Яна Ученица 4 «В» класса МОУ СОШ № 32 Г.Уссурийск 2011 г.
правила личной гигиены Выполнила: Замараева Яна Ученица 4 «В» класса МОУ СОШ № 32 Г.Уссурийск 2011 г. Liczby w Biblii
Liczby w Biblii Презентация на тему "Авторская технология взаимодействия участников образовательного процесса при организации системы монито
Презентация на тему "Авторская технология взаимодействия участников образовательного процесса при организации системы монито Дэвид Геслак. Упражнения для тренировок с особенными людьми
Дэвид Геслак. Упражнения для тренировок с особенными людьми Работы победителей муниципального этапа областного конкурса детского и юношеского изобразительного искусства «Я рисую
Работы победителей муниципального этапа областного конкурса детского и юношеского изобразительного искусства «Я рисую Школьная или обычная форма
Школьная или обычная форма Влияние занятий роллер спортом на состояние здоровья детей 10-12 лет
Влияние занятий роллер спортом на состояние здоровья детей 10-12 лет Презентация Таможенный платежи кроссворд
Презентация Таможенный платежи кроссворд Модели сущность-связь
Модели сущность-связь Презентация Классическое Средневековье (XI -XV вв.)
Презентация Классическое Средневековье (XI -XV вв.) ß-адреноблокаторы – величайший прорыв в лечении сердечно-сосудистых заболеваний
ß-адреноблокаторы – величайший прорыв в лечении сердечно-сосудистых заболеваний Социально-исторические предпосылки государства и права. Возникновение государства и права
Социально-исторические предпосылки государства и права. Возникновение государства и права Страхование ответственности за загрязнение окружающей среды (экологическое страхование) в России и за рубежом
Страхование ответственности за загрязнение окружающей среды (экологическое страхование) в России и за рубежом Kung fu and chinese martial arts
Kung fu and chinese martial arts Наш друг - спорт
Наш друг - спорт Распространенные заболевания человека
Распространенные заболевания человека Презентация на тему "Интерактивные методы обучения как фактор мотивации качества учебного материала" - скачать презентации п
Презентация на тему "Интерактивные методы обучения как фактор мотивации качества учебного материала" - скачать презентации п