Содержание
- 2. Среднее расстояние между частицами Vν = 22.4 л 1 моль ⇒ NA = 6.02⋅1023 частиц Кристалл,
- 3. Полярность связи Дипольный момент (мера полярности связи) μ = δ ⋅ l [Кл⋅м], Дебай (D) 1
- 4. Дипольный момент молекул
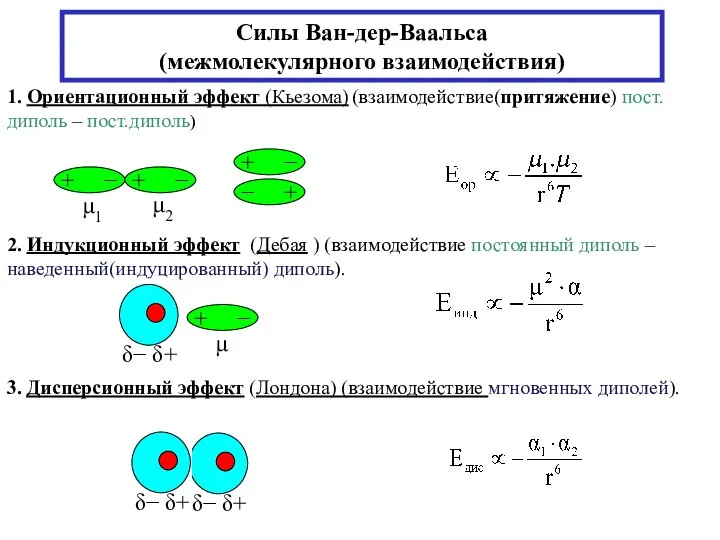
- 5. Силы Ван-дер-Ваальса (межмолекулярного взаимодействия) 1. Ориентационный эффект (Кьезома) (взаимодействие(притяжение) пост.диполь – пост.диполь) 2. Индукционный эффект (Дебая
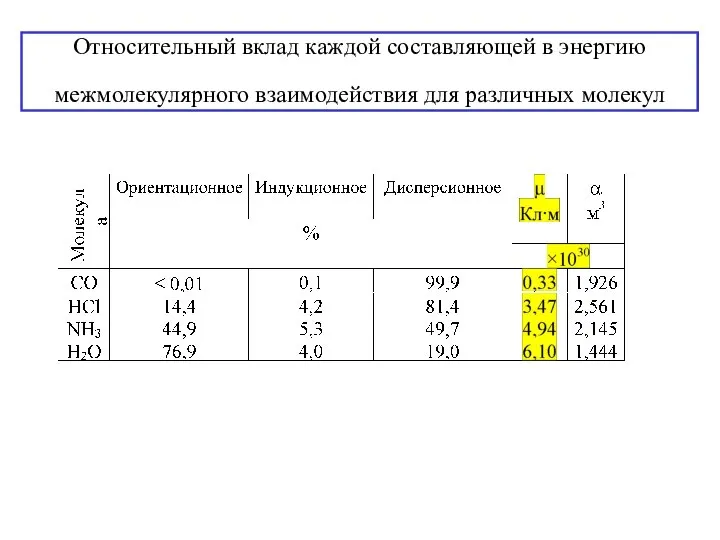
- 6. Относительный вклад каждой составляющей в энергию межмолекулярного взаимодействия для различных молекул
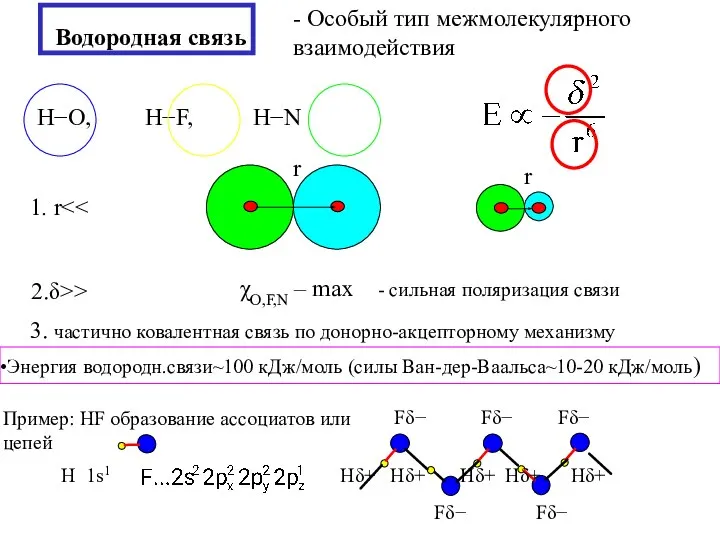
- 7. Водородная связь - Особый тип межмолекулярного взаимодействия 1. r 2.δ>> χO,F,N – max - сильная поляризация
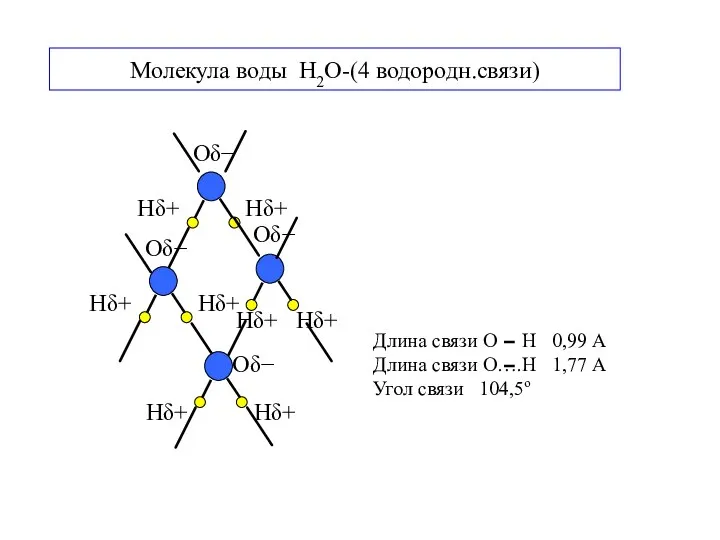
- 8. Молекула воды H2O-(4 водородн.связи)
- 9. 3.2 Твердые тела Екин по характеру распределения частиц в пространстве
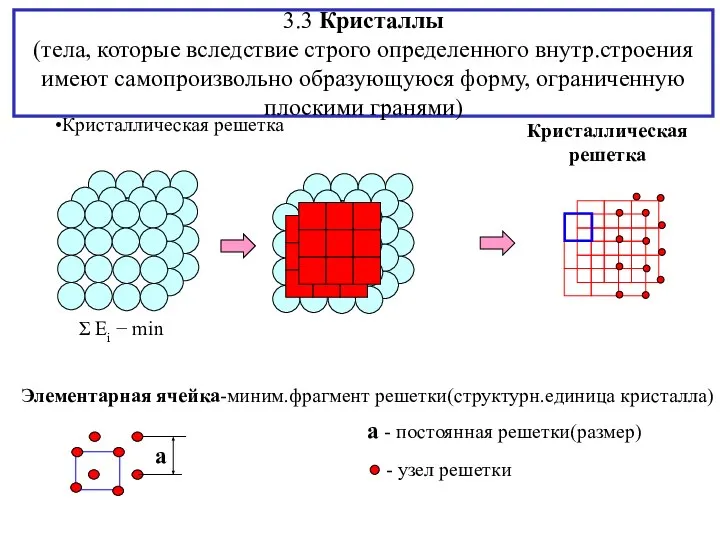
- 10. 3.3 Кристаллы (тела, которые вследствие строго определенного внутр.строения имеют самопроизвольно образующуюся форму, ограниченную плоскими гранями) Кристаллическая
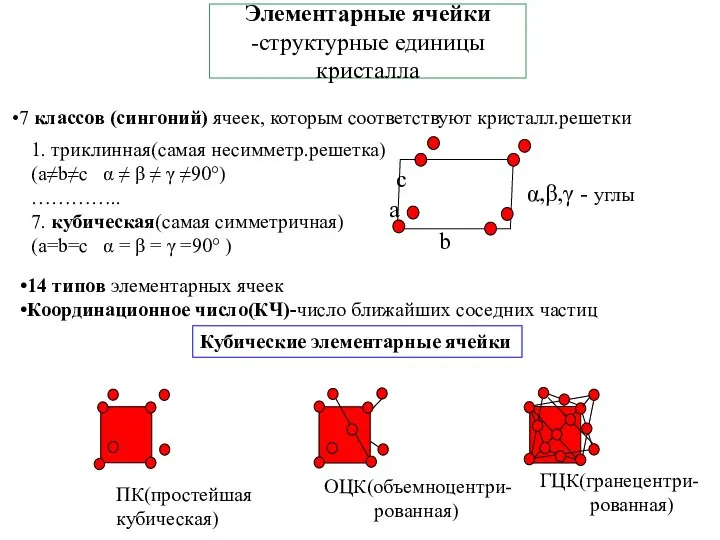
- 11. Элементарные ячейки -структурные единицы кристалла 7 классов (сингоний) ячеек, которым соответствуют кристалл.решетки 1. триклинная(самая несимметр.решетка) (a≠b≠c
- 12. Анизотропия свойств монокристалла; полиморфизм(аллотропические модификации) -зависимость физико-химических свойств кристалла от выбранного направления в нем(кристаллографической ориентации); -
- 13. Плотнейшая упаковка 1-2-1-2…. ГПУ(гексагональная) 1-2-3-1-2-3… КПУ(кубическая)
- 14. 3.4 Типы кристаллов молекулярные ионные металлические Ковалентные(атом-ные) Типы химической связи в кристаллах Расположение атомов
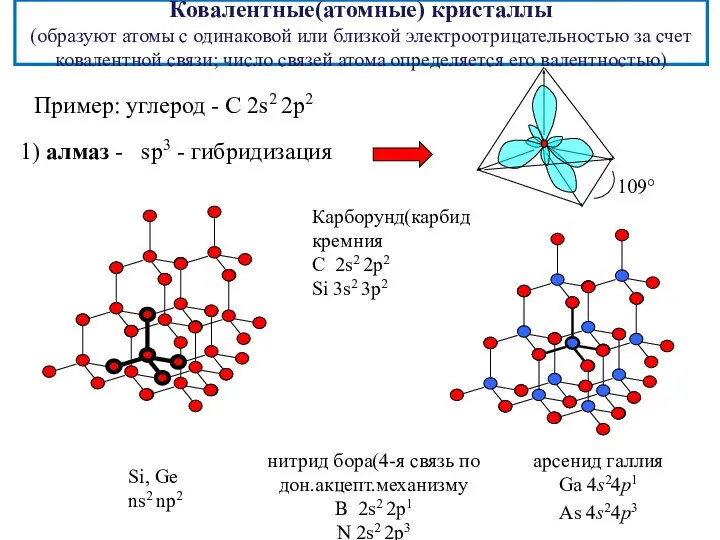
- 15. Ковалентные(атомные) кристаллы (образуют атомы с одинаковой или близкой электроотрицательностью за счет ковалентной связи; число связей атома
- 16. ковалентные кристаллы 2) графит - sp2 - гибридизация С 2s2 2p2 3 - sp2 + 1-
- 17. молекулярные кристаллы (молекулы в узлах кристаллической решетки) силы Ван-дер-Ваальса rI2-I2 = 3.60 А rI2-I2 = 4.40
- 18. Ионные кристаллы χB - χA > 2.1 A + B → A+ B− А - постоянная
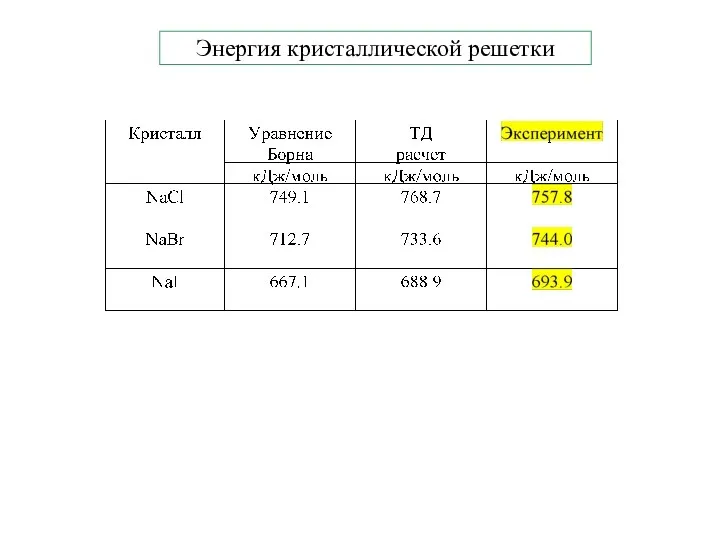
- 19. Энергия кристаллической решетки
- 20. Хим.связь в металлических кристаллах χA ≡ χB –ков.кристалл; КЧ 8-12-ионн.кристалл плотнейшая упаковка металлические орбитали метод валентных
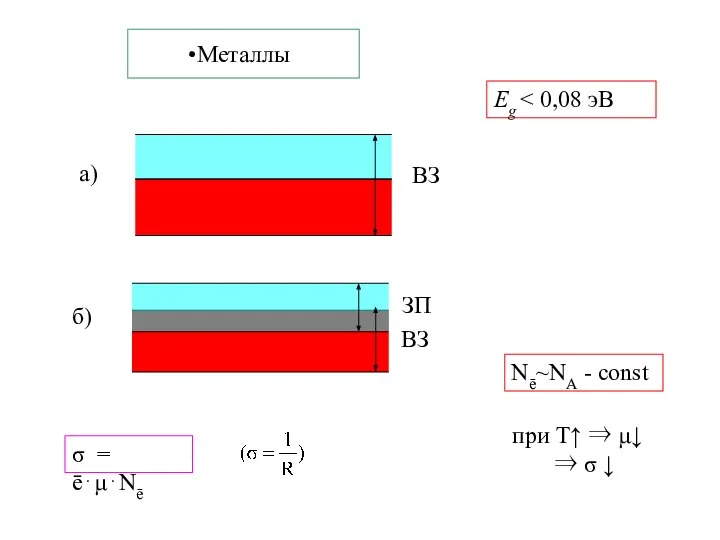
- 21. Металлы
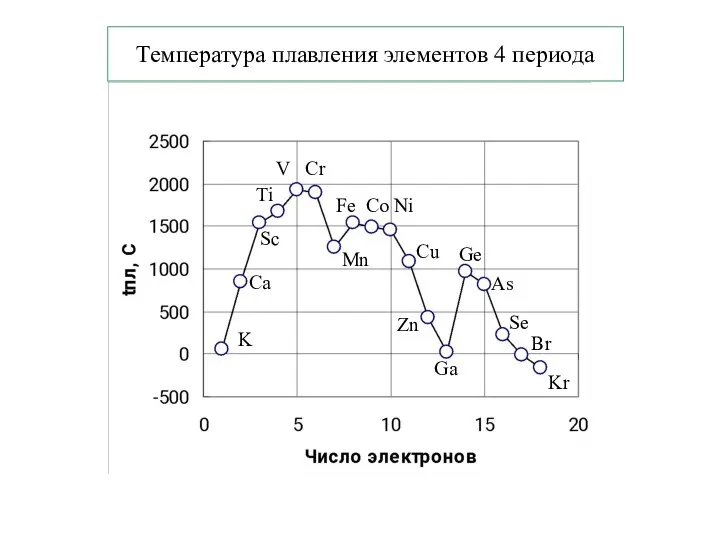
- 22. Температура плавления элементов 4 периода
- 23. 3.5 Зонная модель кристалла Подобна методу МО для кристаллов - число МО равно числу АО -
- 24. Энергетическая диаграмма
- 25. Металлы Nē~NА - const Eg при Т↑ ⇒ μ↓ ⇒ σ ↓
- 26. Eg > 3 эВ Nē = 0 ⇒ σ = 0 Диэлектрики
- 27. Полупроводник 0,08 эВ при T=0 K Nē; Nр = 0 ⇒ σ(T=0 K) = 0 σ
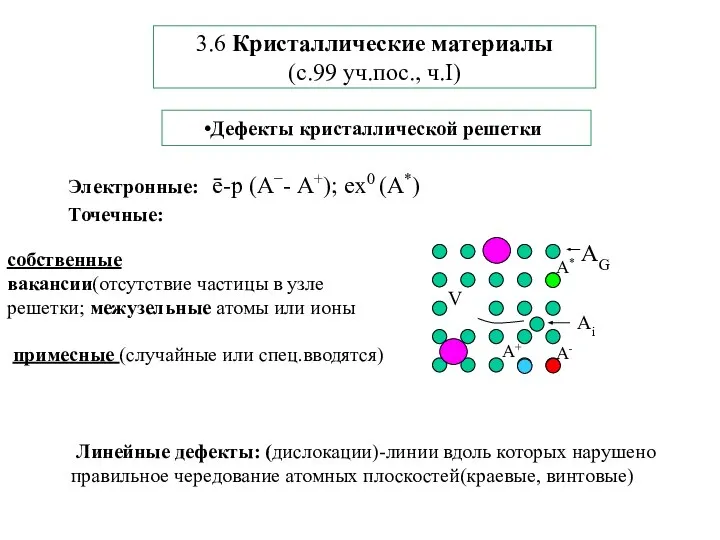
- 28. 3.6 Кристаллические материалы (с.99 уч.пос., ч.I) Дефекты кристаллической решетки Электронные: ē-р (А−- А+); ex0 (А*) Точечные:
- 29. получение расплав (жидкость), пар (газ), раствор
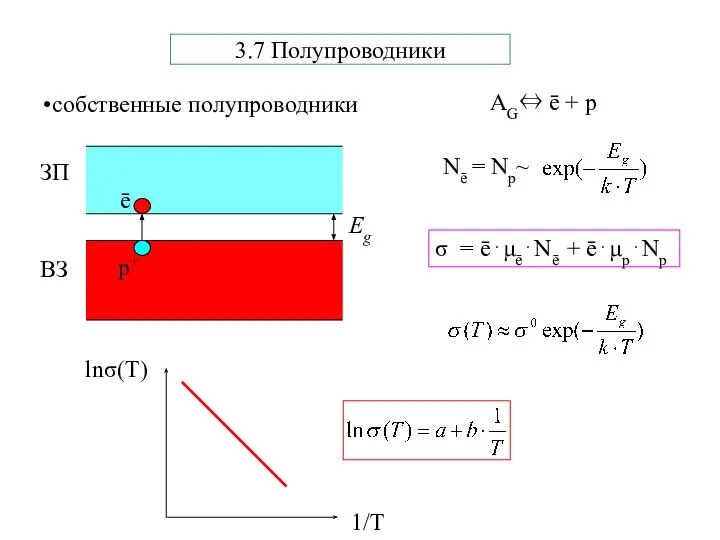
- 30. 3.7 Полупроводники σ = ē⋅μē⋅Nē + ē⋅μр⋅Nр
- 31. примесные полупроводники Пример – Si (2s22p2) донор - P (2s22p3) акцептор - B (2s22p1) Электронный тип
- 33. Скачать презентацию


















 Теория и методы. Сравнительный анализ политических систем. Лекция 1
Теория и методы. Сравнительный анализ политических систем. Лекция 1 Устройства ввода-вывода
Устройства ввода-вывода Инновационный менеджмент
Инновационный менеджмент Business etiquette
Business etiquette Технологический процесс уборки картофеля
Технологический процесс уборки картофеля Нұрсұлтан Әбішұлы Назарбаев
Нұрсұлтан Әбішұлы Назарбаев Формирование культуры здорового образа жизни на уроках иностранного языка в начальной школе
Формирование культуры здорового образа жизни на уроках иностранного языка в начальной школе Задачи и механизм обеспечения национальной технологической безопасности Подготовил Ивантей М.И. Группа Т-093
Задачи и механизм обеспечения национальной технологической безопасности Подготовил Ивантей М.И. Группа Т-093  Защита права собственности
Защита права собственности Государственная символика Государственные символы - установленные конституцией или специальным законом особые, исторически сло
Государственная символика Государственные символы - установленные конституцией или специальным законом особые, исторически сло Вершки и корешки Художник Сергий Елена
Вершки и корешки Художник Сергий Елена  Постлиберальный поворот в политике Пост-Запада: анализ Мюнхенского доклада 2017 года
Постлиберальный поворот в политике Пост-Запада: анализ Мюнхенского доклада 2017 года СИМПТОМАТОЛОГИЯ ЗАБОЛЕВАНИЙ СУСТАВОВ
СИМПТОМАТОЛОГИЯ ЗАБОЛЕВАНИЙ СУСТАВОВ  6Процессы теплопередачи (2)
6Процессы теплопередачи (2) ПРЕСТУПЛЕНИЯ ПРОТИВ БЕЗОПАСНОСТИ ДВИЖЕНИЯ И ЭКСПЛУАТАЦИИ ТРАНСПОРТА
ПРЕСТУПЛЕНИЯ ПРОТИВ БЕЗОПАСНОСТИ ДВИЖЕНИЯ И ЭКСПЛУАТАЦИИ ТРАНСПОРТА JavaScript. DOM, Examples
JavaScript. DOM, Examples Электролиз
Электролиз  Презентация Фармстандарт
Презентация Фармстандарт  Гулливер - презентация для начальной школы
Гулливер - презентация для начальной школы Пётр Па́влович Ершо́в
Пётр Па́влович Ершо́в Презентация Диаграмма Исикавы
Презентация Диаграмма Исикавы Отраслевая система управления проектами Елена Колосова Исполнительный директор группы компаний ПМСОФТ, Президент Российско
Отраслевая система управления проектами Елена Колосова Исполнительный директор группы компаний ПМСОФТ, Президент Российско Жизненный цикл трубопровода и мониторинг его технического состояния
Жизненный цикл трубопровода и мониторинг его технического состояния Международные экологические конференции и организации
Международные экологические конференции и организации Дизентерия, вводный
Дизентерия, вводный «МЫ И НАШИ РОДИТЕЛИ»
«МЫ И НАШИ РОДИТЕЛИ» КУЛЬТУРА ЗАПАДНОЕВРОПЕЙСКОГО РЕНЕССАНСА
КУЛЬТУРА ЗАПАДНОЕВРОПЕЙСКОГО РЕНЕССАНСА Обычаи и традиции
Обычаи и традиции