Содержание
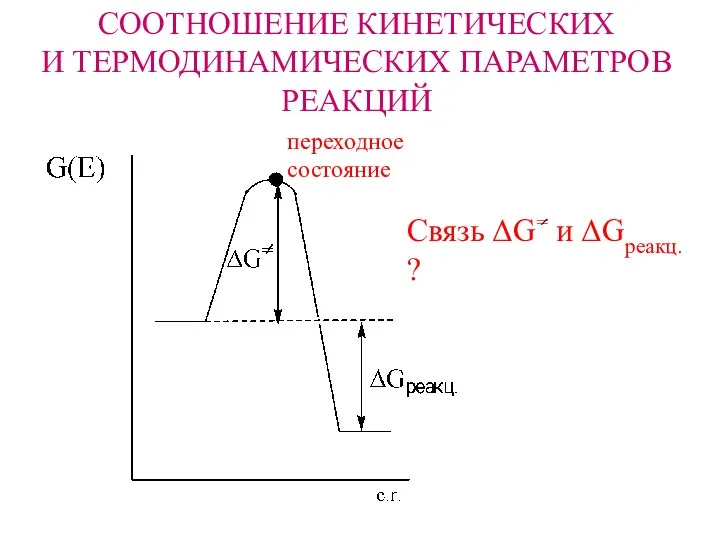
- 2. CООТНОШЕНИЕ КИНЕТИЧЕСКИХ И ТЕРМОДИНАМИЧЕСКИХ ПАРАМЕТРОВ РЕАКЦИЙ переходное состояние Связь ΔG= и ΔGреакц. ?
- 3. Соотношение Бренстеда k = βKpα lgk = lgβ + αlgKp α, β − const k -
- 4. Йоханн Николаус Бренстед Автор протонной теории кислот и оснований
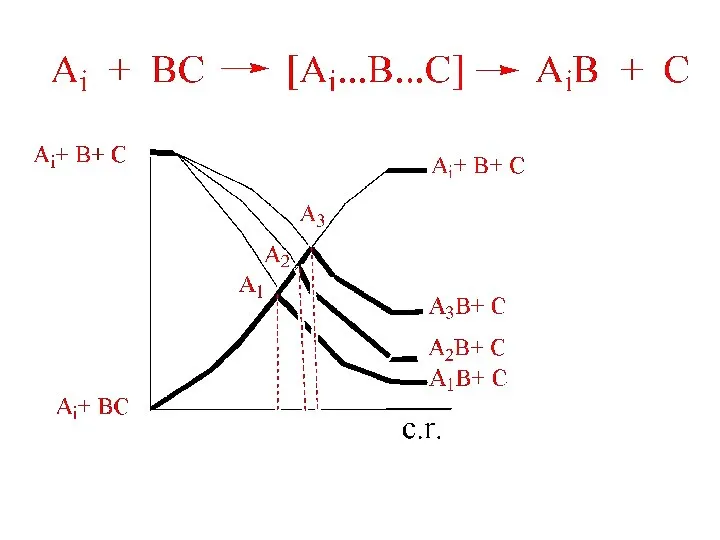
- 5. Принцип Бэлла-Эванса-Поляни (БЭП) EA = A + B ΔH Н.Н. Семенов (30-годы, свободные радикалы) : EA
- 6. Капица и Семенов
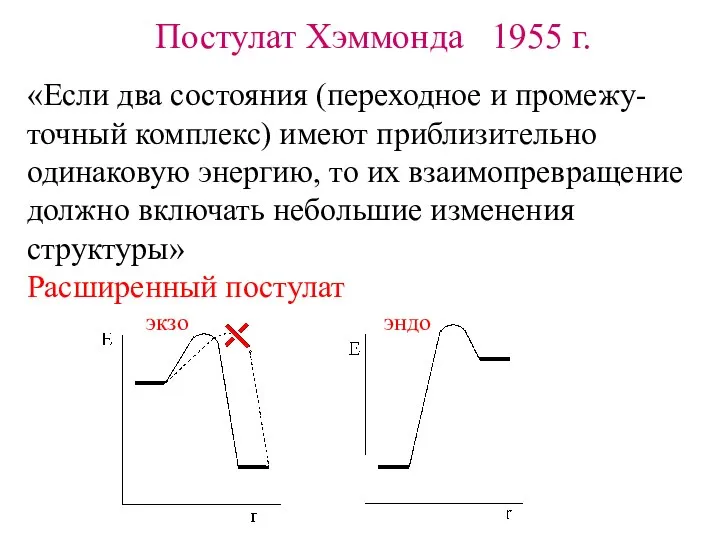
- 8. Постулат Хэммонда 1955 г. «Если два состояния (переходное и промежу- точный комплекс) имеют приблизительно одинаковую энергию,
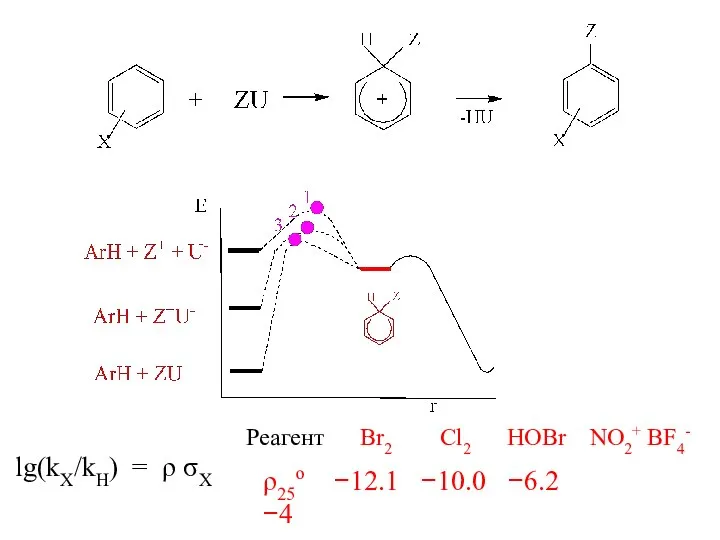
- 9. lg(kX/kH) = ρ σX Реагент Br2 Cl2 HOBr NO2+ BF4- ρ25ο −12.1 −10.0 −6.2 −4
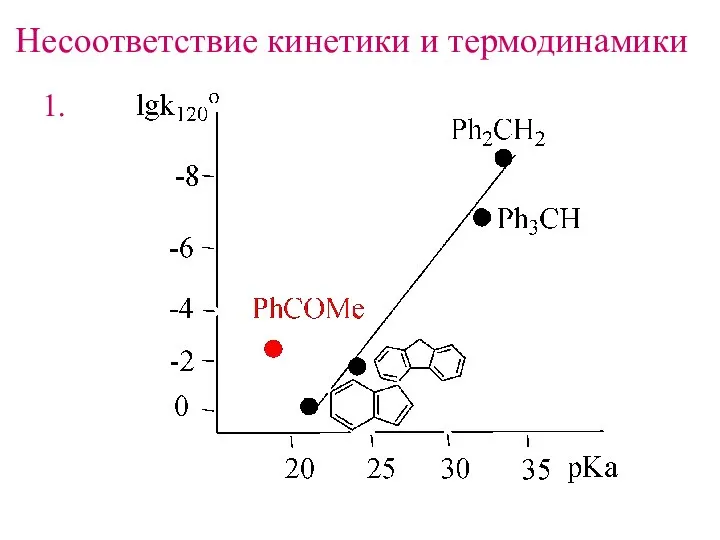
- 10. Несоответствие кинетики и термодинамики 1.
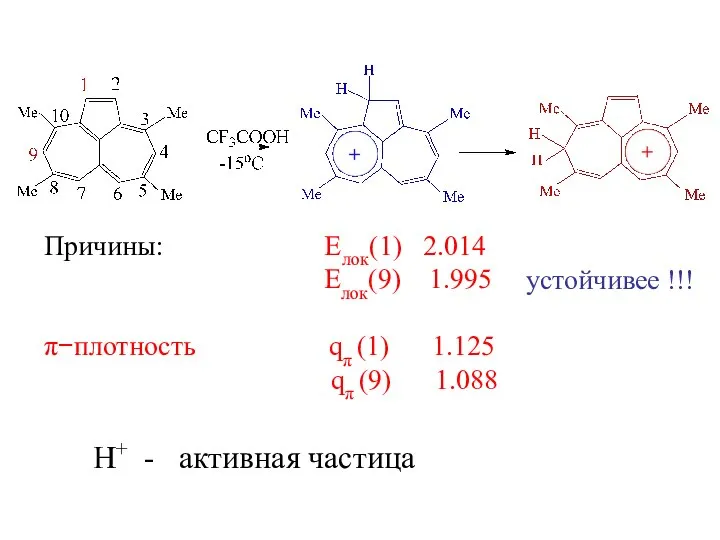
- 11. Причины: Елок(1) 2.014 Елок(9) 1.995 π−плотность qπ (1) 1.125 qπ (9) 1.088 H+ - активная частица
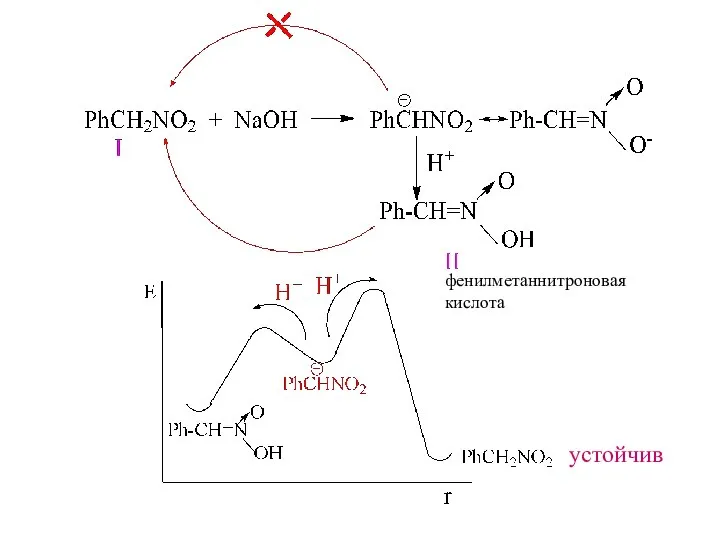
- 12. фенилметаннитроновая кислота устойчив
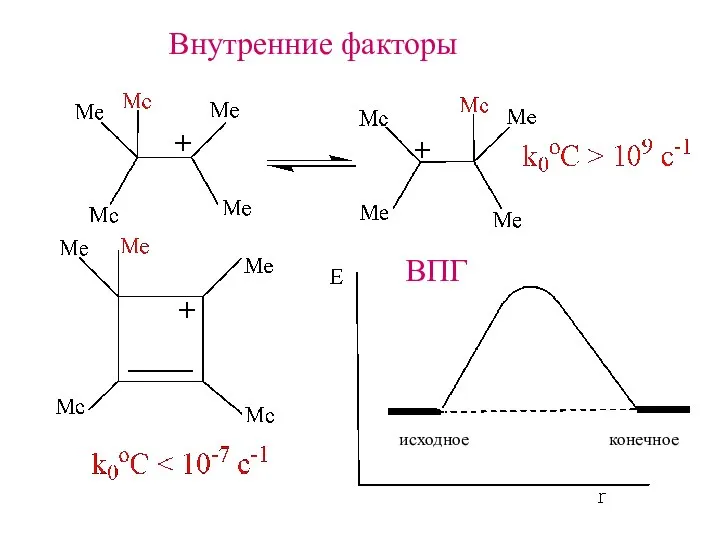
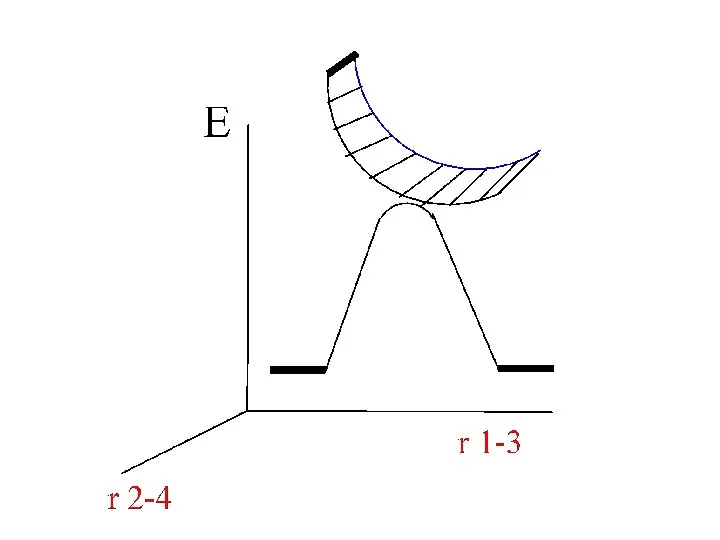
- 13. Внутренние факторы ВПГ исходное конечное
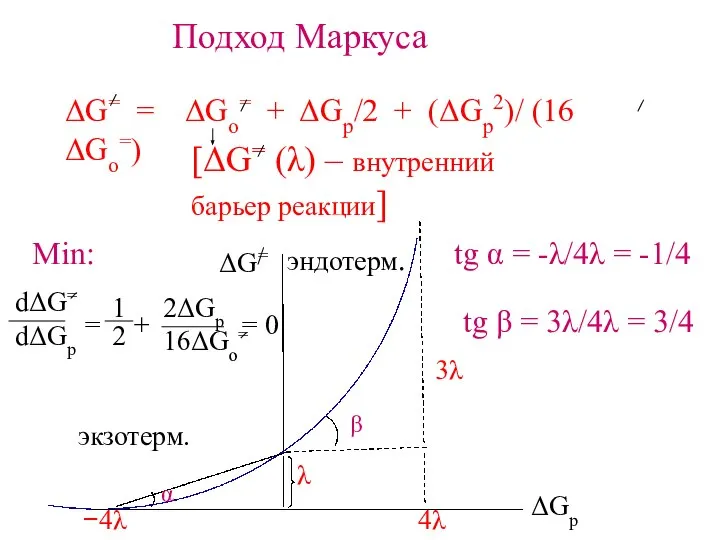
- 14. Подход Маркуса ΔG= = ΔGo= + ΔGp/2 + (ΔGp2)/ (16 ΔGo=) [ΔG= (λ) – внутренний барьер
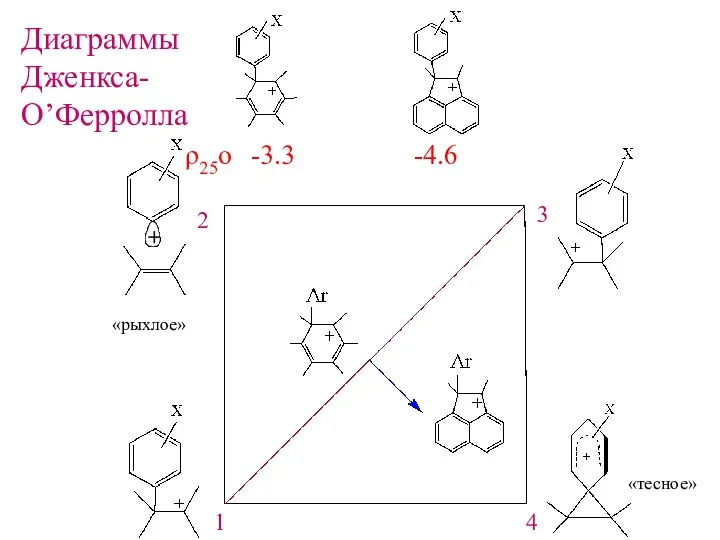
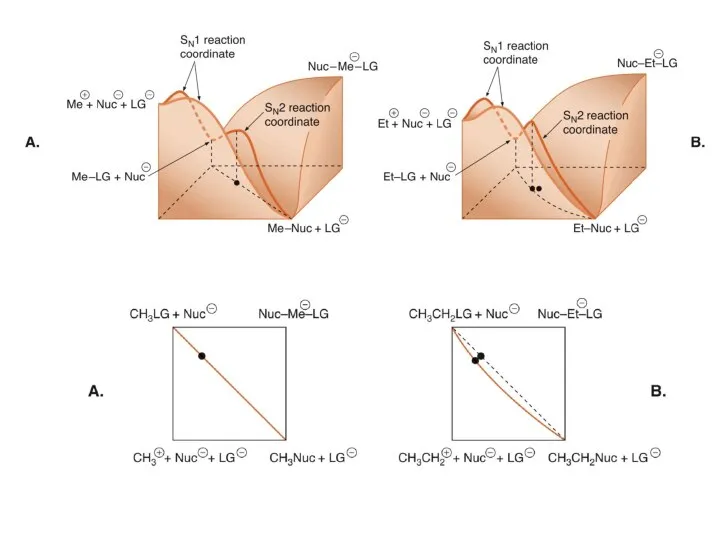
- 15. «рыхлое» «тесное» ρ25ο -3.3 -4.6 Диаграммы Дженкса- О’Ферролла 1 2 3 4
- 19. Скачать презентацию



 Документы, регламентирующие работу станции
Документы, регламентирующие работу станции ПЛАТЕЖНО-РАСЧЕТНЫЕ ОТНОШЕНИЯ ВО ВНЕШНЕЭКОНОМИЧЕСКОЙ ДЕЯТЕЛЬНОСТИ СУБЪЕКТОВ ХОЗЯЙСТВОВАНИЯ
ПЛАТЕЖНО-РАСЧЕТНЫЕ ОТНОШЕНИЯ ВО ВНЕШНЕЭКОНОМИЧЕСКОЙ ДЕЯТЕЛЬНОСТИ СУБЪЕКТОВ ХОЗЯЙСТВОВАНИЯ Безумство - это грех, который оскверняет человека
Безумство - это грех, который оскверняет человека Ардуино. 7-сегментный индикатор
Ардуино. 7-сегментный индикатор Будівельна техніка. Загальні положення. Основні вимоги до сучасної будівельної техніки. Класифікація та індексація
Будівельна техніка. Загальні положення. Основні вимоги до сучасної будівельної техніки. Класифікація та індексація Бытовая техника Часть 3
Бытовая техника Часть 3 Заключение эксперта
Заключение эксперта Презентация "Рынок труда. Безработица" - скачать презентации по Экономике
Презентация "Рынок труда. Безработица" - скачать презентации по Экономике СЕРТИФИКАЦИЯ НАПИТКОВ ВИНА
СЕРТИФИКАЦИЯ НАПИТКОВ ВИНА Правила определения таможенной стоимости ввозимых товаров в случаях их повреждения вследствие аварии или действия непреодолимой
Правила определения таможенной стоимости ввозимых товаров в случаях их повреждения вследствие аварии или действия непреодолимой Экономические закономерности Жуйкова Л.Д., преподаватель КГБОУ НПО «Профессиональный лицей № 67»
Экономические закономерности Жуйкова Л.Д., преподаватель КГБОУ НПО «Профессиональный лицей № 67» Ich und meine interessen
Ich und meine interessen Формы залегания, структуры и текстуры
Формы залегания, структуры и текстуры Прикладное программирование. Конструкторы и деструкторы
Прикладное программирование. Конструкторы и деструкторы Аппаратные средства визуализации
Аппаратные средства визуализации Квасникова Ирина, победитель чемпионата (Республика Хакассия) по легкой атлетике среди лиц с ограниченніми возможностями
Квасникова Ирина, победитель чемпионата (Республика Хакассия) по легкой атлетике среди лиц с ограниченніми возможностями Кинематика КШМ
Кинематика КШМ kofe
kofe «Тхэквондо» - северокорейское боевое искусство
«Тхэквондо» - северокорейское боевое искусство Нанесение размеров. Масштабы
Нанесение размеров. Масштабы Презентация КАПРОН
Презентация КАПРОН Выполнил: студент 1 – го курса, гр.Т-103. Ласёк Павел
Выполнил: студент 1 – го курса, гр.Т-103. Ласёк Павел Культура России в начале XX века
Культура России в начале XX века Стратегия формирования здорового образа жизни средствами физической культуры. Внедрение физкультурно-спортивного комплекса «ГТ
Стратегия формирования здорового образа жизни средствами физической культуры. Внедрение физкультурно-спортивного комплекса «ГТ Физиология локомоторного аппарата
Физиология локомоторного аппарата Электрические машины. Их устройства и принцип действия
Электрические машины. Их устройства и принцип действия Нельсон Мандела и Барак Обама
Нельсон Мандела и Барак Обама Великолепное установление института семьи и брака открывает нам тайны Царствия Божьего!
Великолепное установление института семьи и брака открывает нам тайны Царствия Божьего!