Содержание
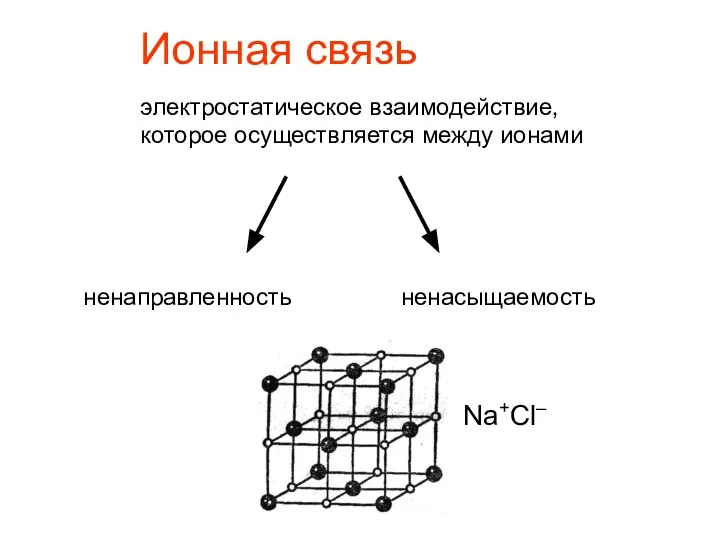
- 2. Ионная связь электростатическое взаимодействие, которое осуществляется между ионами ненаправленность ненасыщаемость Na+Cl–
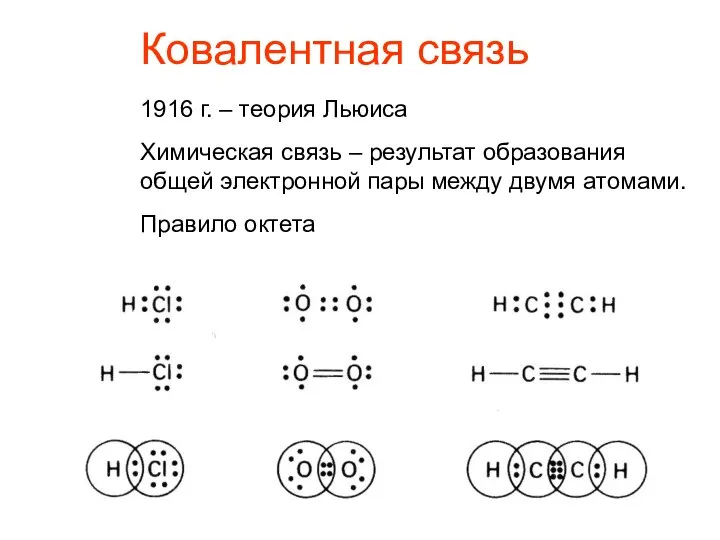
- 3. Ковалентная связь 1916 г. – теория Льюиса Химическая связь – результат образования общей электронной пары между
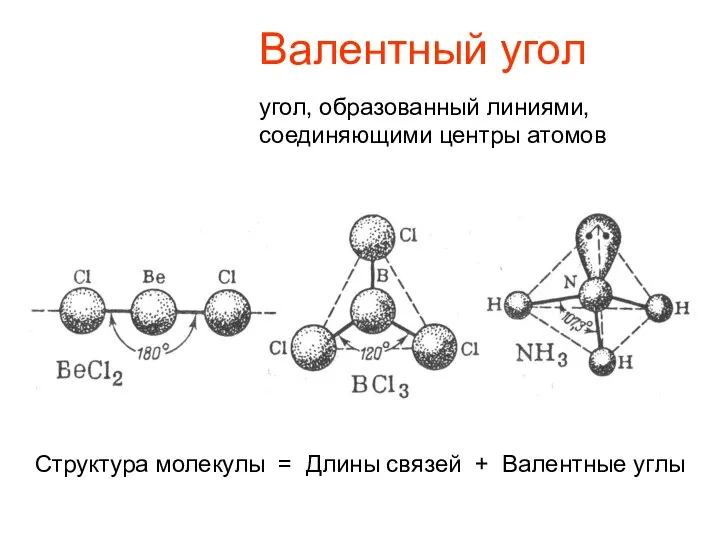
- 4. Валентный угол угол, образованный линиями, соединяющими центры атомов Структура молекулы = Длины связей + Валентные углы
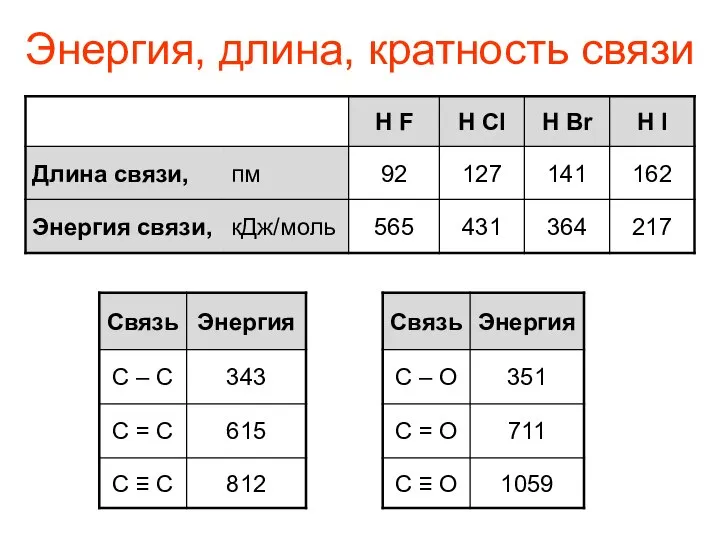
- 5. Энергия, длина, кратность связи
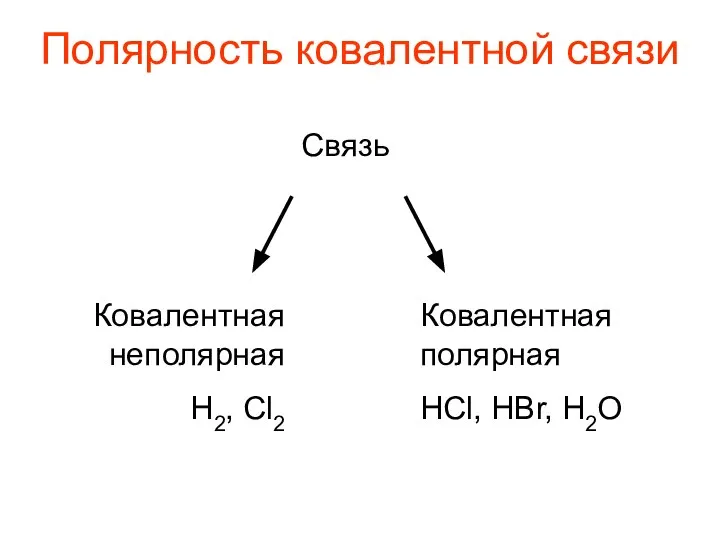
- 6. Полярность ковалентной связи Связь Ковалентная неполярная Н2, Cl2 Ковалентная полярная HCl, HBr, H2O
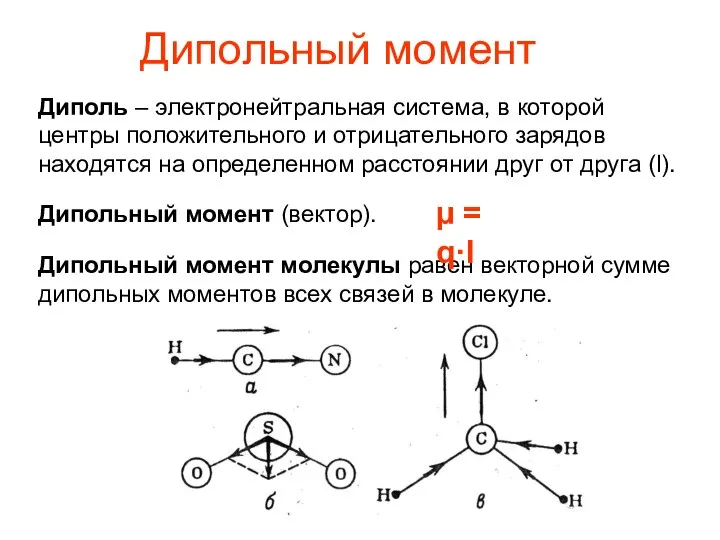
- 7. Дипольный момент Диполь – электронейтральная система, в которой центры положительного и отрицательного зарядов находятся на определенном
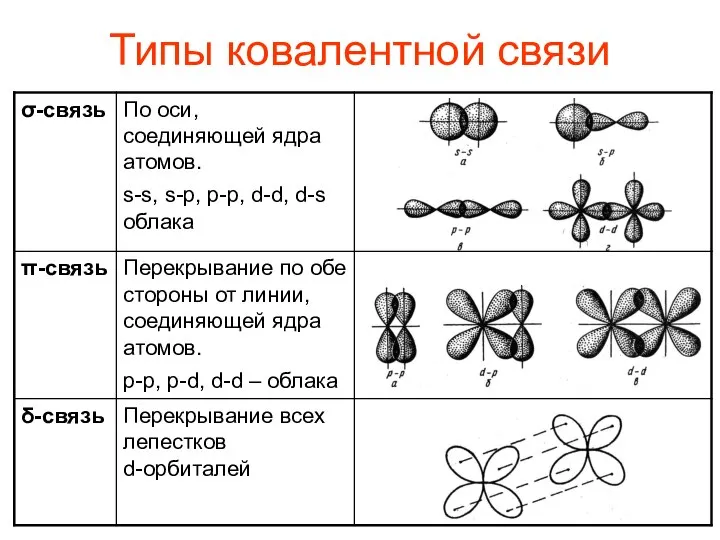
- 8. Типы ковалентной связи
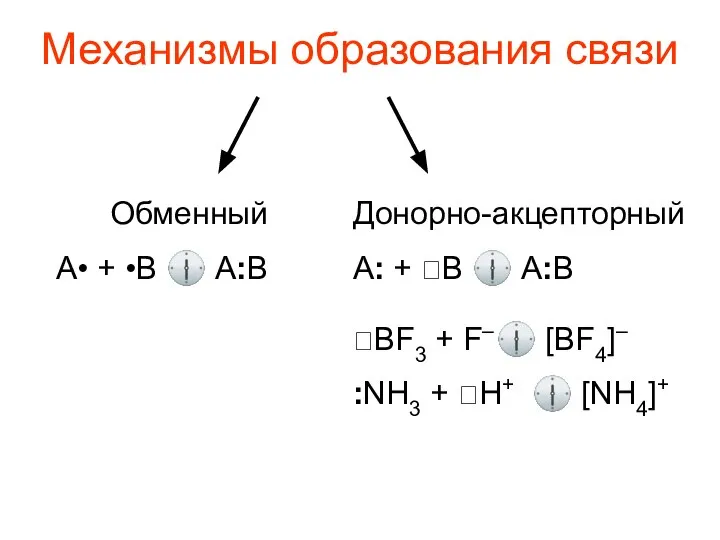
- 9. Механизмы образования связи
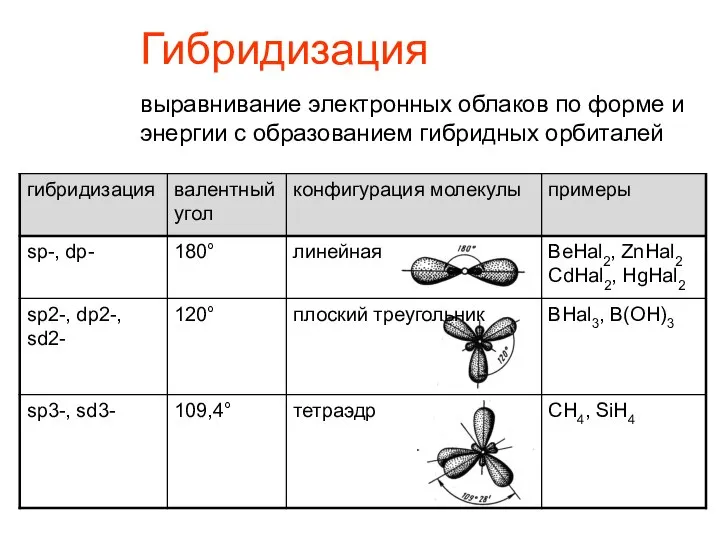
- 10. Гибридизация выравнивание электронных облаков по форме и энергии с образованием гибридных орбиталей
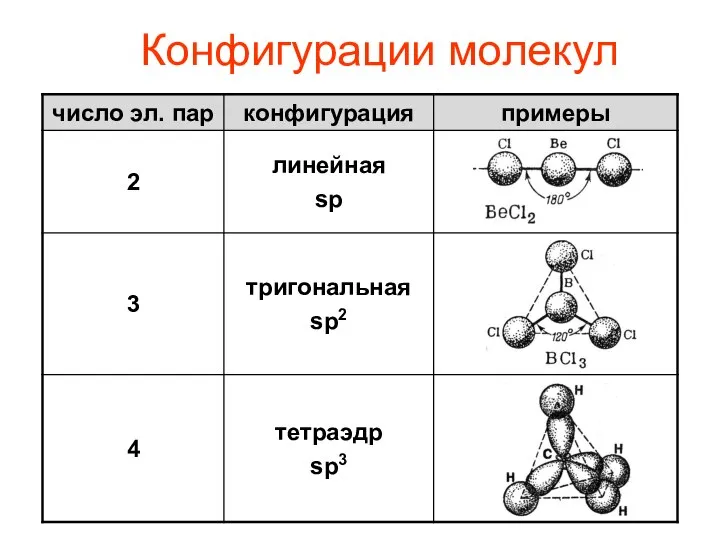
- 11. Конфигурации молекул
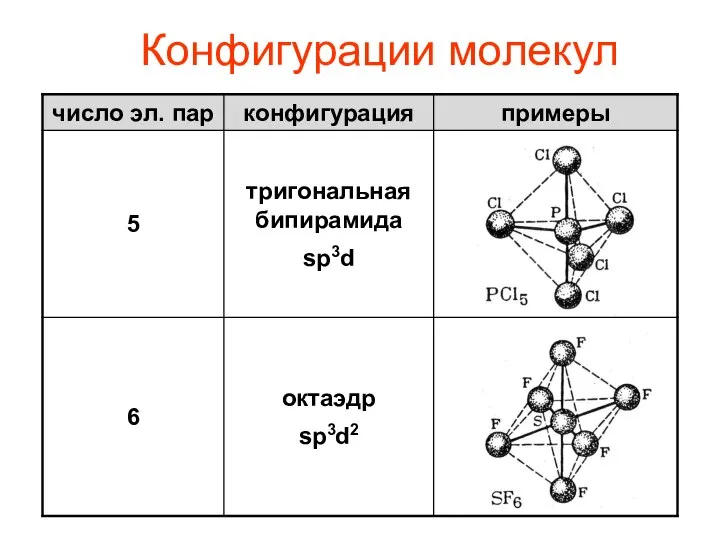
- 12. Конфигурации молекул
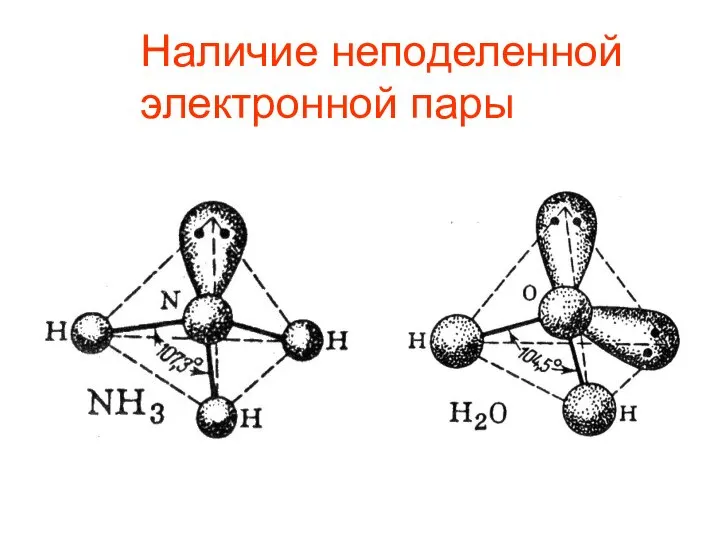
- 13. Наличие неподеленной электронной пары
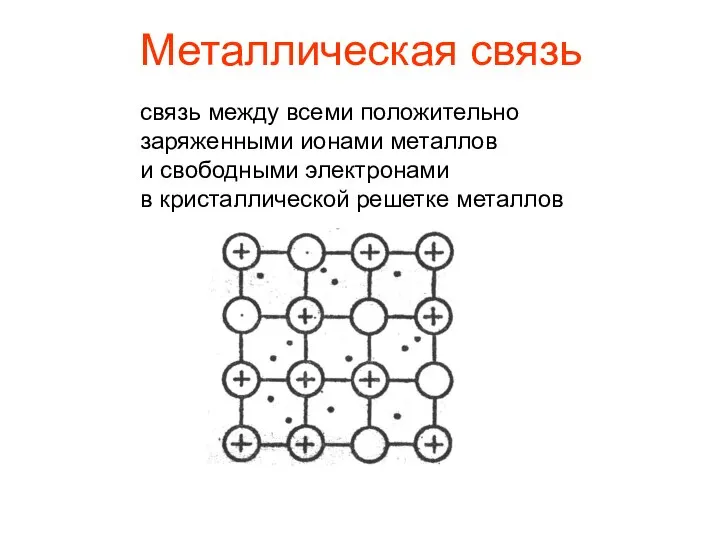
- 14. Металлическая связь связь между всеми положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов
- 15. Водородная связь взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода: А−Н ...
- 17. Скачать презентацию

 Непрерывные коды
Непрерывные коды Урок по китайскому языку. (Урок 10)
Урок по китайскому языку. (Урок 10) Производительность
Производительность Детям о ПБП на ДЖ транспорте - презентация для начальной школы
Детям о ПБП на ДЖ транспорте - презентация для начальной школы Презентация на тему "Мониторинг как инструмент оценки качества образовательных результатов учащихся" - скачать презентации
Презентация на тему "Мониторинг как инструмент оценки качества образовательных результатов учащихся" - скачать презентации  Крымская война 1853—1856 Выполнила студентка Группы Ю-104 Чуева Яна
Крымская война 1853—1856 Выполнила студентка Группы Ю-104 Чуева Яна Szczeciński Park Naukowo-Technologiczny
Szczeciński Park Naukowo-Technologiczny Выборочный контроль ЛС отечественного и зарубежного производства, находящиеся в сфере обращения
Выборочный контроль ЛС отечественного и зарубежного производства, находящиеся в сфере обращения Михаи́л Васи́льевич Ломоно́сов
Михаи́л Васи́льевич Ломоно́сов Информационные ресурсы негуманитарных областей науки и практики
Информационные ресурсы негуманитарных областей науки и практики Творчество душевнобольных
Творчество душевнобольных Клуб супер математиков - презентация по Алгебре
Клуб супер математиков - презентация по Алгебре Традиционные праздники и социализация детей народов Поволжья
Традиционные праздники и социализация детей народов Поволжья Geometria.ru - cоциальная сеть о клубной и ночной жизни - презентация
Geometria.ru - cоциальная сеть о клубной и ночной жизни - презентация Правовое обеспечение мультимедийного контента
Правовое обеспечение мультимедийного контента «КРАСОТА РУССКОГО ЖЕНСКОГО КОСТЮМА» Апрель, 2009 г.
«КРАСОТА РУССКОГО ЖЕНСКОГО КОСТЮМА» Апрель, 2009 г. Е.И.Чарушин «Кабан» Составитель: Шаршукова В.А., учитель начальных классов МАОУСОШ № 8 г.Старая Русса Новгородской области
Е.И.Чарушин «Кабан» Составитель: Шаршукова В.А., учитель начальных классов МАОУСОШ № 8 г.Старая Русса Новгородской области Исторические этапы развития коммуникаций. Общинная коммуникационная система
Исторические этапы развития коммуникаций. Общинная коммуникационная система Важность физкультуры для молодёжи
Важность физкультуры для молодёжи Муниципальное образовательное учреждение средняя общеобразовательная школа №93 Барабинского района Новосибирской области
Муниципальное образовательное учреждение средняя общеобразовательная школа №93 Барабинского района Новосибирской области  Архитектура итальянского Возрождения Выполнила: Учитель музыки и МХК ГОУ СОШ № 249 СВАО г. Москвы
Архитектура итальянского Возрождения Выполнила: Учитель музыки и МХК ГОУ СОШ № 249 СВАО г. Москвы  Алгебра 8 класс.
Алгебра 8 класс.  Экономика электронного бизнеса и информационных систем
Экономика электронного бизнеса и информационных систем Построение диаграмм. Типы диаграмм – Точечная, поверхность
Построение диаграмм. Типы диаграмм – Точечная, поверхность Сервитутное право в Римском праве Выполнила Мамочкина Юля
Сервитутное право в Римском праве Выполнила Мамочкина Юля  Работа с реестром (Лекция № 5)
Работа с реестром (Лекция № 5) Система и источники административного права как отрасли права, науки и учебной дисциплины
Система и источники административного права как отрасли права, науки и учебной дисциплины Дифференциация в обучении – ключ к сохранению индивидуальности «Обучение должно быть вариативным и индивидуальным особенностям
Дифференциация в обучении – ключ к сохранению индивидуальности «Обучение должно быть вариативным и индивидуальным особенностям