Содержание
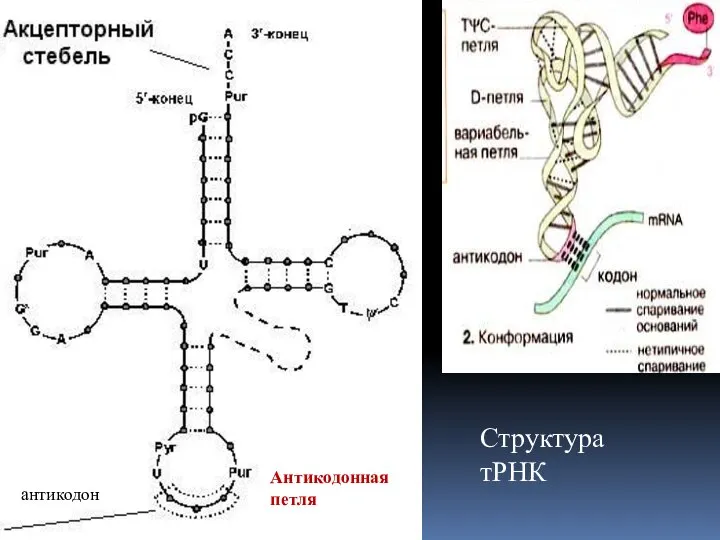
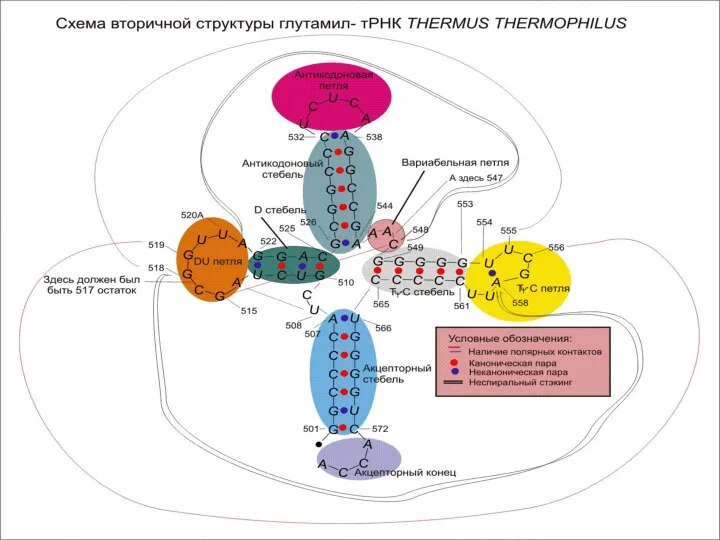
- 2. Структура тРНК Антикодонная петля антикодон
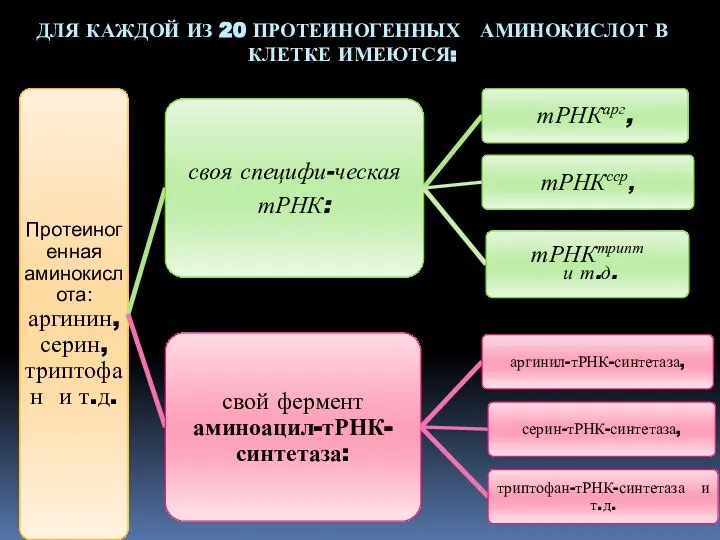
- 4. ФЕРМЕНТЫ АМИНОАЦИЛ-тРНК-СИНТЕТАЗЫ распознают тРНК и подходящую ей аминокислоту; присоединяют к 3΄-концу тРНК соответствующую аминокислоту.
- 5. ДЛЯ КАЖДОЙ ИЗ 20 ПРОТЕИНОГЕННЫХ АМИНОКИСЛОТ В КЛЕТКЕ ИМЕЮТСЯ:
- 6. РИБОСОМНАЯ РНК (рРНК)
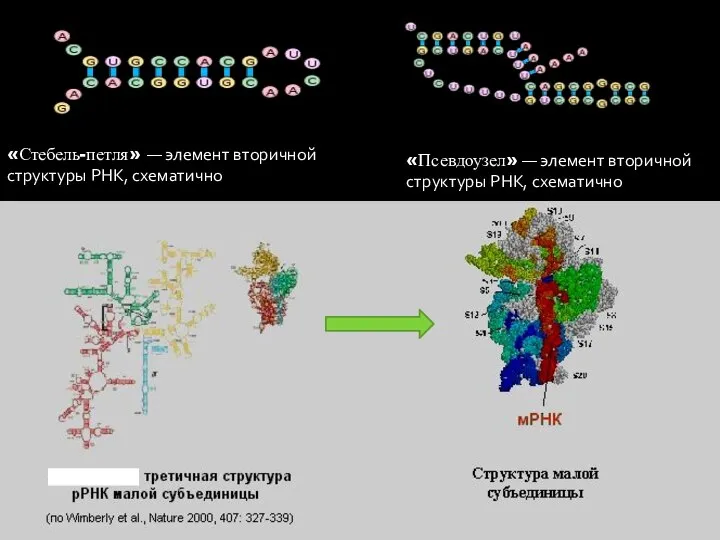
- 7. РИБОСОМНАЯ РНК. «Стебель-петля» — элемент вторичной структуры РНК, схематично «Псевдоузел» — элемент вторичной структуры РНК, схематично
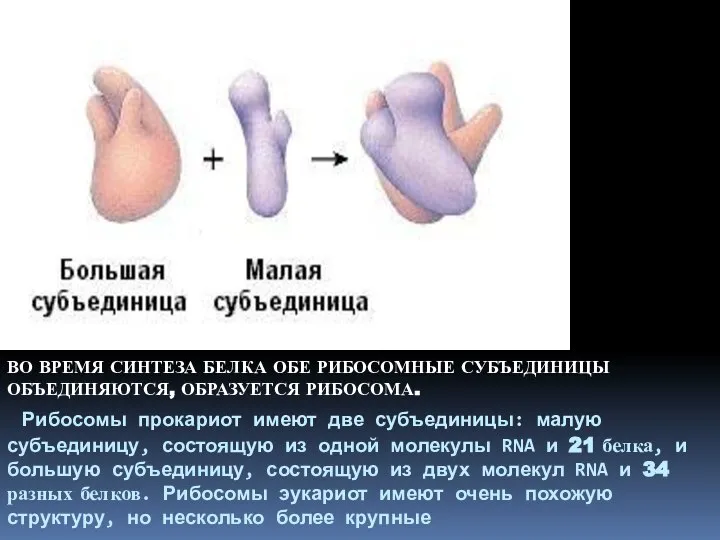
- 8. ВО ВРЕМЯ СИНТЕЗА БЕЛКА ОБЕ РИБОСОМНЫЕ СУБЪЕДИНИЦЫ ОБЪЕДИНЯЮТСЯ, ОБРАЗУЕТСЯ РИБОСОМА. Рибосомы прокариот имеют две субъединицы: малую
- 9. Структура и роль белка
- 10. БЕЛКИ —природные высокомолекулярные полимеры, состоящие из аминокислотных остатков, соединенных пептидной связью. Белки являются главной составной частью
- 11. II. По форме молекулы Фибриллярные (нитевидные) коллаген Глобулярные (шаровидные): альбумины, глобулины КЛАССИФИКАЦИЯ БЕЛКОВ I. По функциям:
- 12. ОСНОВНАЯ СТРУКТУРНАЯ ЕДИНИЦА БЕЛКОВ
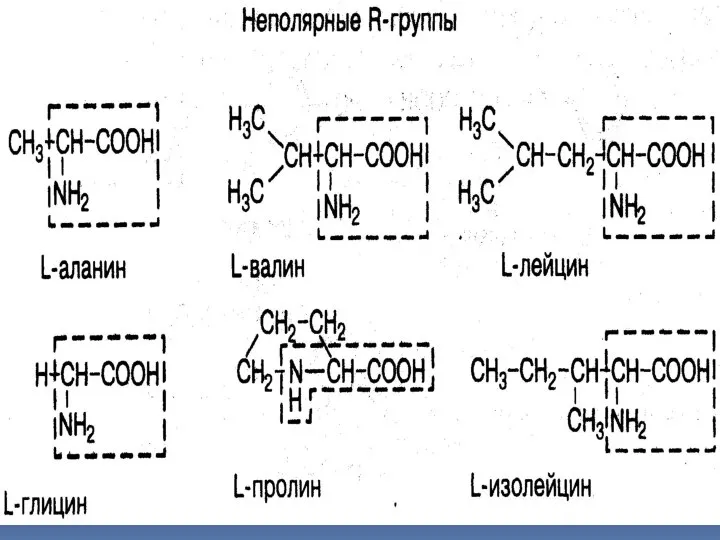
- 13. ПРОТЕИНОГЕННЫЕ АМИНОКИСЛОТЫ И ИХ ОБОЗНАЧЕНИЯ
- 14. Полярные, незаряженные R-группы L-серин; L-цистеин; L-глутамин; L-треонин; L-метионин; L-аспарагин Отрицательно заряженные R-группы L-глутаминовая к-та; L-аспарагиновая к-та
- 16. ЗАМЕНИМЫЕ АМИНОКИСЛОТЫ (ДЛЯ ЧЕЛОЕКА)
- 17. ПОЛУЗАМЕНИМЫЕ АМИНОКИСЛОТЫ (ДЛЯ ЧЕЛОВЕКА)
- 18. НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ (ДЛЯ ЧЕЛОВЕКА)
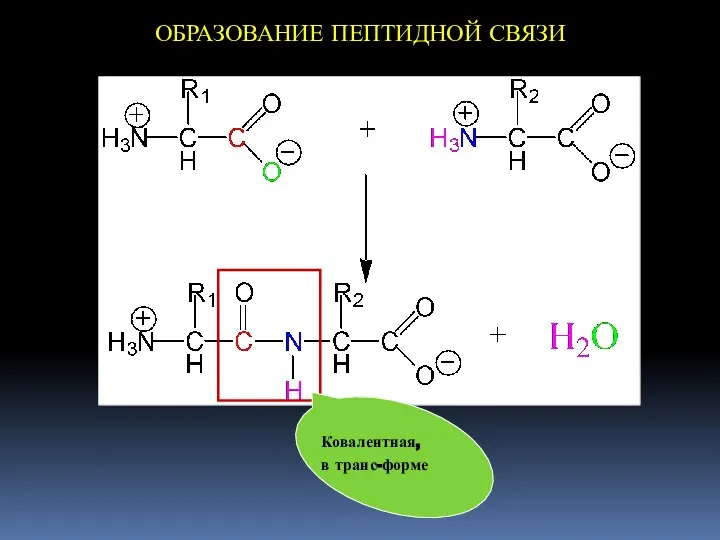
- 19. ОБРАЗОВАНИЕ ПЕПТИДНОЙ СВЯЗИ Ковалентная, в транс-форме
- 20. СТРУКТУРА БЕЛКА
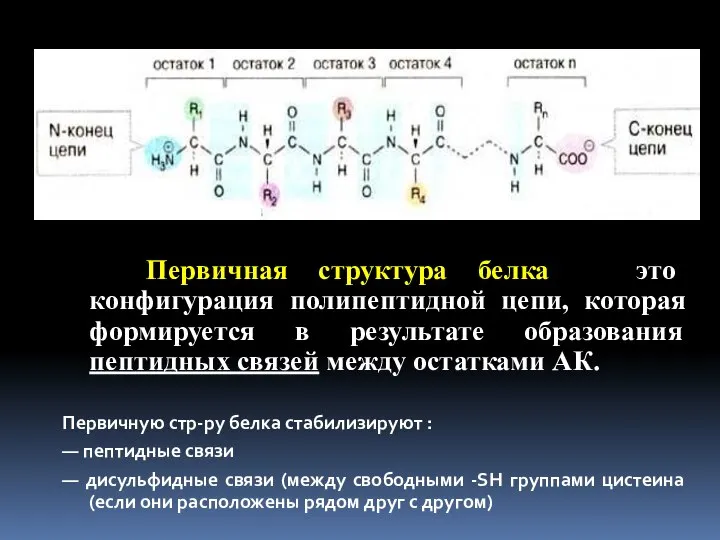
- 21. Первичная структура белка — это конфигурация полипептидной цепи, которая формируется в результате образования пептидных связей между
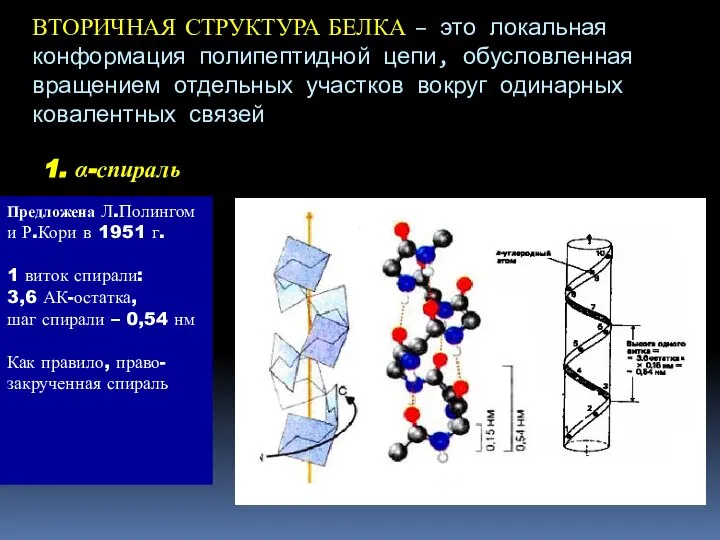
- 22. ВТОРИЧНАЯ СТРУКТУРА БЕЛКА – это локальная конформация полипептидной цепи, обусловленная вращением отдельных участков вокруг одинарных ковалентных
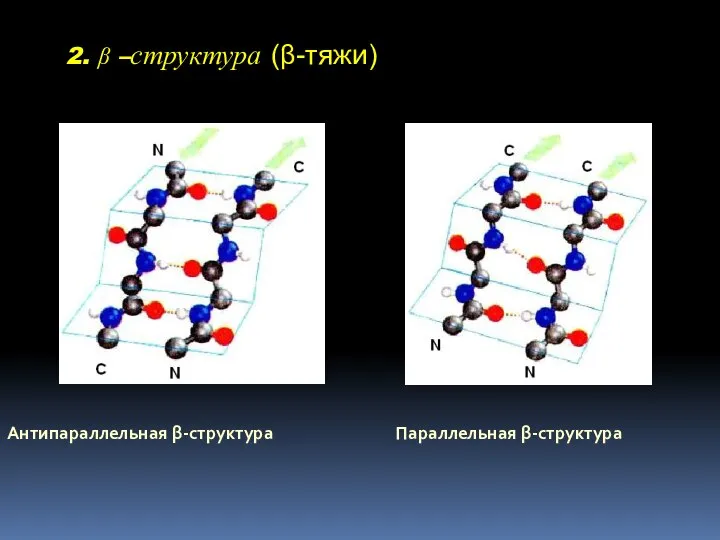
- 23. 2. β –структура (β-тяжи) Антипараллельная β-структура Параллельная β-структура
- 24. ТРЕТИЧНАЯ СТРУКТУРА (нативная) – расположение в пространстве всей полипептидной цепи, отдельные участки которой имеют локальную конформацию,
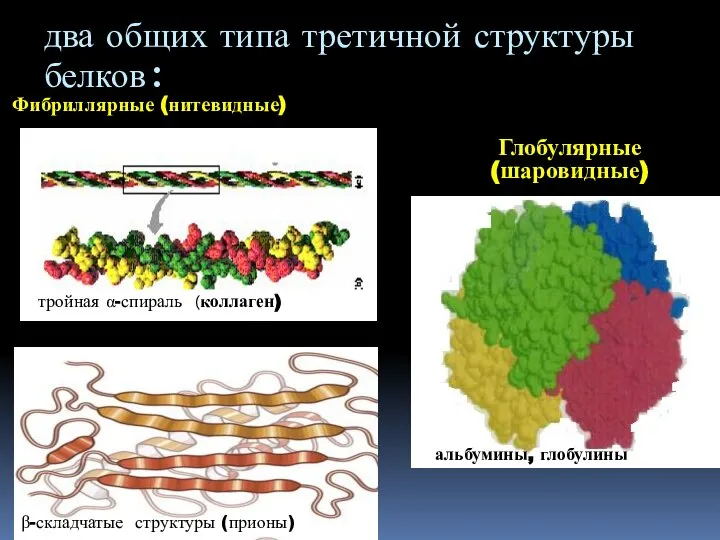
- 25. Фибриллярные (нитевидные) Глобулярные (шаровидные) два общих типа третичной структуры белков: тройная α-спираль (коллаген) β-складчатые структуры (прионы)
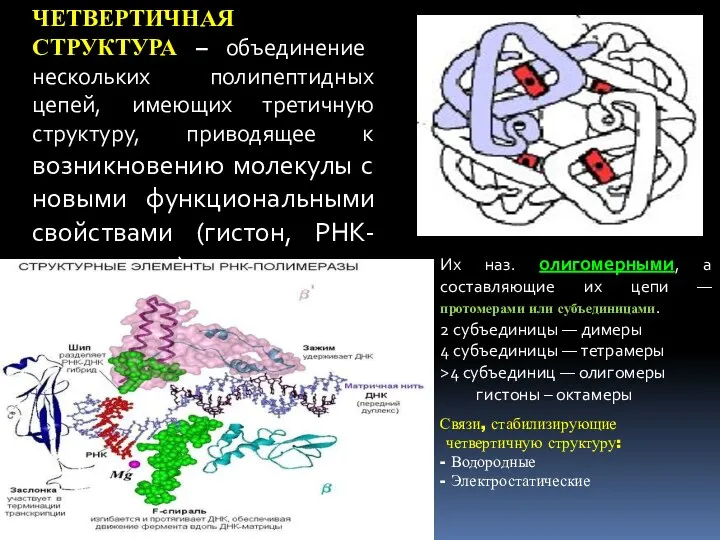
- 26. ЧЕТВЕРТИЧНАЯ СТРУКТУРА – объединение нескольких полипептидных цепей, имеющих третичную структуру, приводящее к возникновению молекулы с новыми
- 27. ПРЕИМУЩЕСТВА белков с четвертичной структурой Экономия генетического материала 2. Уменьшение числа ошибок при синтезе белка 3.
- 29. СИНТЕЗ БЕЛКА В КЛЕТКАХ РАЗЛИЧНЫХ ОРГАНИЗМОВ Синтез белка сводится не к переписыванию информации, а к переходу
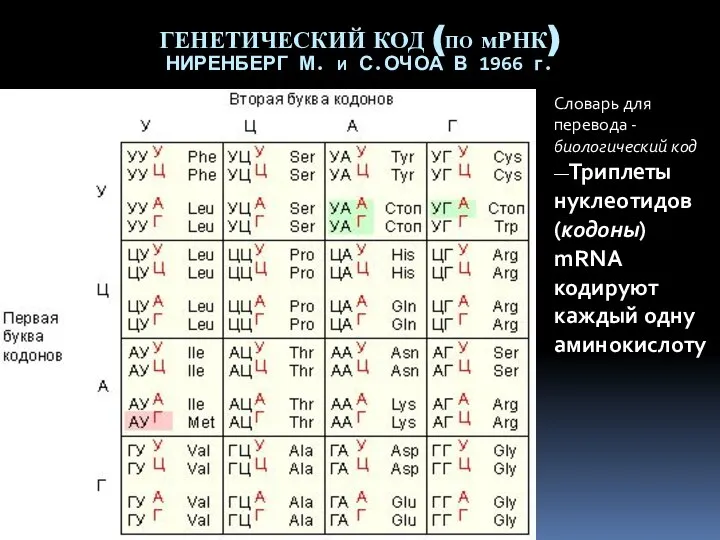
- 30. ГЕНЕТИЧЕСКИЙ КОД (ПО мРНК) НИРЕНБЕРГ М. И С.ОЧОА В 1966 г. Словарь для перевода - биологический
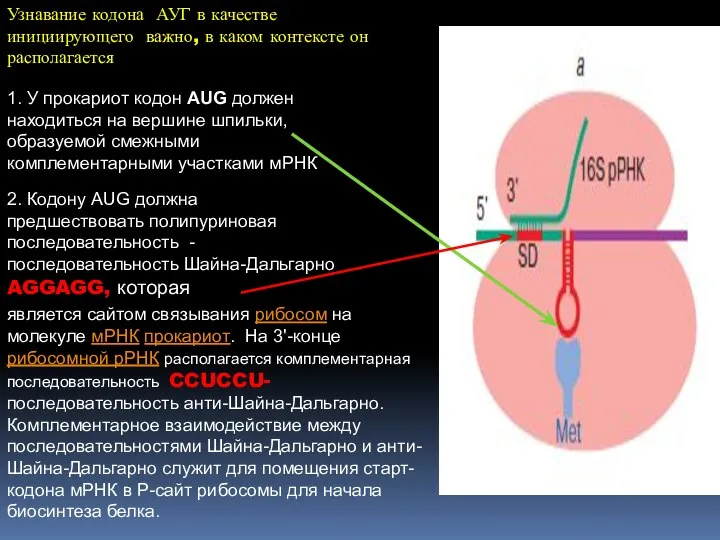
- 31. 1. У прокариот кодон AUG должен находиться на вершине шпильки, образуемой смежными комплементарными участками мРНК Узнавание
- 32. ТРАНСЛЯЦИЯ. ЭТАПЫ (БИОСИНТЕЗ БЕЛКА)
- 33. 1 этап. Инициация трансляции 1. Активация инициаторной аминокислоты . Метионин при участии ферментов связывается с АТФ.
- 34. 1 этап. продолжение 2. Аминоациладенилат (метионинаденилат) соединяется с тРНК мет при помощи фермента аминоацил-тРНК-синтетазы (метионин-тРНКсинтетазы). Образуется
- 35. 3. Перенос Мet-тРНК на малую рибосомную субъединицу. 4. Антикодон тРНК спаривается со старт-кодоном мРНК (триплет AUG).
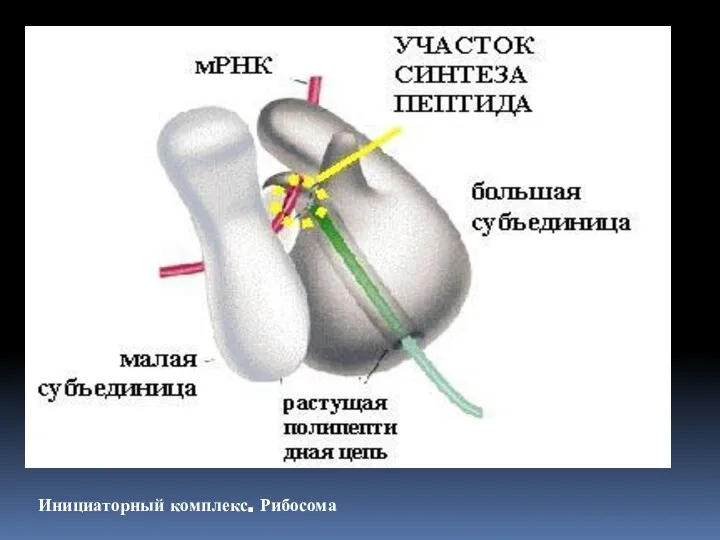
- 36. Инициаторный комплекс. Рибосома
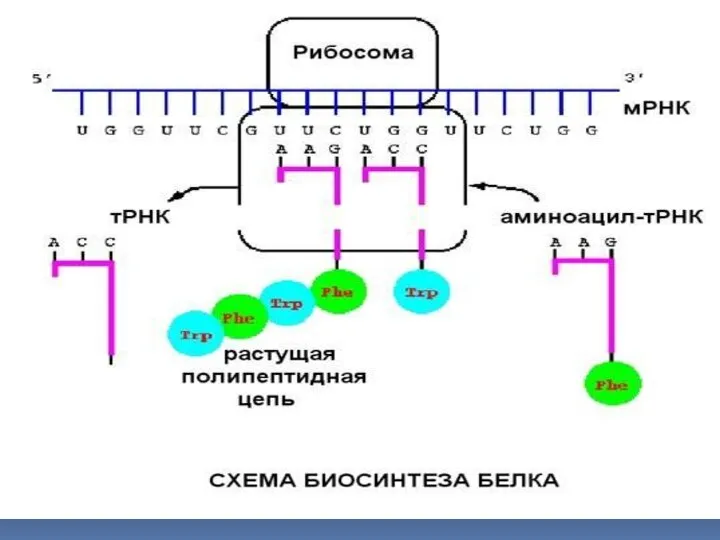
- 37. 2 ЭТАП. ЭЛОНГАЦИЯ (БИОСИНТЕЗ ПОЛИПЕПТИДНОЙ ЦЕПИ) Элонгация осуществляется при помощи белков цитозоля (факторов элонгации). Формирование пептидной
- 38. ЭЛОНГАЦИЯ
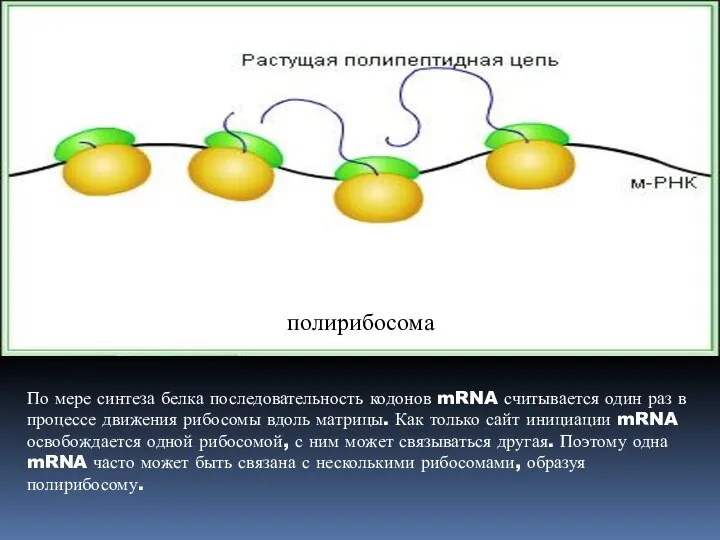
- 39. По мере синтеза белка последовательность кодонов mRNA считывается один раз в процессе движения рибосомы вдоль матрицы.
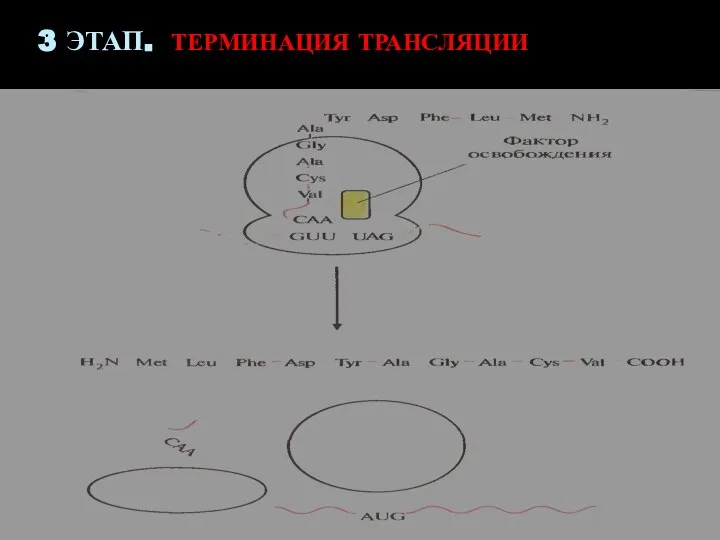
- 40. 3 ЭТАП. ТЕРМИНАЦИЯ ТРАНСЛЯЦИИ стоп-кодоны (триплеты UAA, UAG или UGA) прекращают процесс элонгации Присоединение к рибосоме
- 41. 3 ЭТАП. ТЕРМИНАЦИЯ ТРАНСЛЯЦИИ
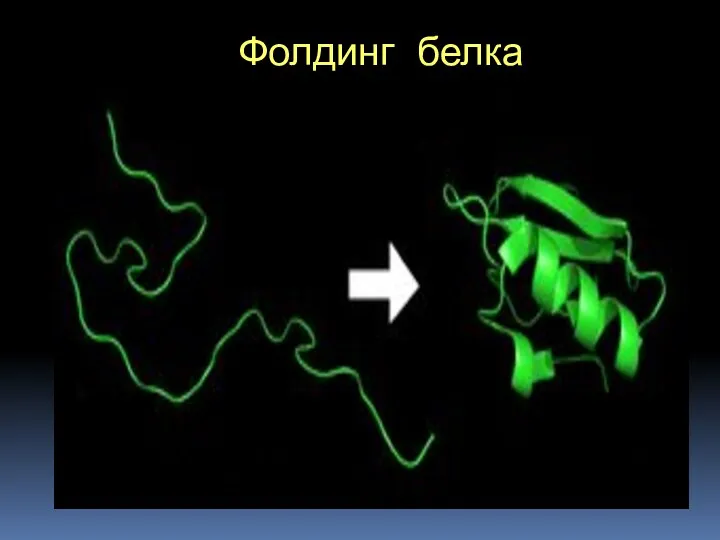
- 42. Фолдинг белка
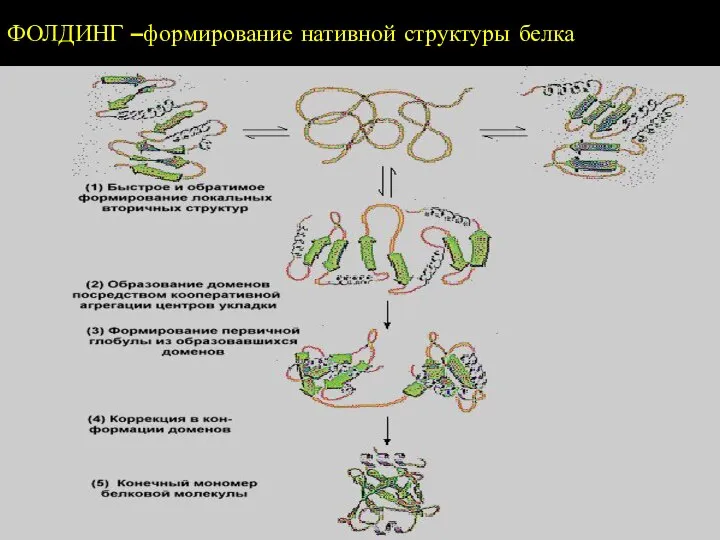
- 43. ФОЛДИНГ –формирование нативной структуры белка
- 45. Скачать презентацию






















 Психологические и медико-биологические проблемы физической культуры и спорта
Психологические и медико-биологические проблемы физической культуры и спорта Социальная антропология Республики Кореи
Социальная антропология Республики Кореи Презентация на тему "Дымова И.Е" - скачать презентации по Педагогике
Презентация на тему "Дымова И.Е" - скачать презентации по Педагогике ФОРМИРОВАНИЕ СИСТЕМЫ АДАПТАЦИИ ПЕРСОНАЛА НА ПРЕДПРИЯТИИ Выполнила студентка Н.В.Александрова гр.О-3272
ФОРМИРОВАНИЕ СИСТЕМЫ АДАПТАЦИИ ПЕРСОНАЛА НА ПРЕДПРИЯТИИ Выполнила студентка Н.В.Александрова гр.О-3272 15 лет шахматному клубу «Вертикаль» г. Сатка
15 лет шахматному клубу «Вертикаль» г. Сатка Управление освещением. Программирование в ONI PLR studio
Управление освещением. Программирование в ONI PLR studio Проблемы ограничения свободы СМИ
Проблемы ограничения свободы СМИ Интегрированный урок географии, естествознания
Интегрированный урок географии, естествознания Учебный предмет черчение. История развития чертежа
Учебный предмет черчение. История развития чертежа Понятие и признаки гражданского правоотношения
Понятие и признаки гражданского правоотношения Использование динамической памяти при организации списков и их обработке. Лекция 10
Использование динамической памяти при организации списков и их обработке. Лекция 10 Федеральная Антимонопольная Служба: чем она занимается и чем полезна потребителю
Федеральная Антимонопольная Служба: чем она занимается и чем полезна потребителю Основи будови військових засобів вимірювань. Засоби вимірювань
Основи будови військових засобів вимірювань. Засоби вимірювань Презентация Future of Ukraine
Презентация Future of Ukraine Устройства ввода и вывода информации
Устройства ввода и вывода информации Презентация Педагогическое взаимодействие
Презентация Педагогическое взаимодействие Українська мова
Українська мова Презентация к уроку «Наш край» Куликов Иван Семенович Подготовила: А.А.Лукьянова 2011 год
Презентация к уроку «Наш край» Куликов Иван Семенович Подготовила: А.А.Лукьянова 2011 год  Наркотические вещества, классификация, влияние на организм, профилактика
Наркотические вещества, классификация, влияние на организм, профилактика Презентация ВАЖНЕЙШИЕ ФАКТОРЫ РАЗВИТИЯ УПРАВЛЕНЧЕСКОЙ МЫСЛИ В РОССИИ XVII в
Презентация ВАЖНЕЙШИЕ ФАКТОРЫ РАЗВИТИЯ УПРАВЛЕНЧЕСКОЙ МЫСЛИ В РОССИИ XVII в Основы химического производства пластмасс
Основы химического производства пластмасс Коллективный договор как фактор мотивации профсоюзного членства
Коллективный договор как фактор мотивации профсоюзного членства Классицизм (от латинского- «образцовый»)
Классицизм (от латинского- «образцовый») Колобок
Колобок  Ау! Волонтеры! или как справиться с «кризисом доверия» 28 октября 2011, институт журналистики и массовой коммуникации КПУ, Альберт
Ау! Волонтеры! или как справиться с «кризисом доверия» 28 октября 2011, институт журналистики и массовой коммуникации КПУ, Альберт  Презентация Оценка результативности поведения персонала
Презентация Оценка результативности поведения персонала Помоги Митюше сделать хохломскую ложку. Игра
Помоги Митюше сделать хохломскую ложку. Игра Сканирование карт
Сканирование карт