Содержание
- 2. Тепловая машина – периодически действующий двигатель, предназначенный для преобразования в полезную работу теплоты, получаемой извне (выделяемой
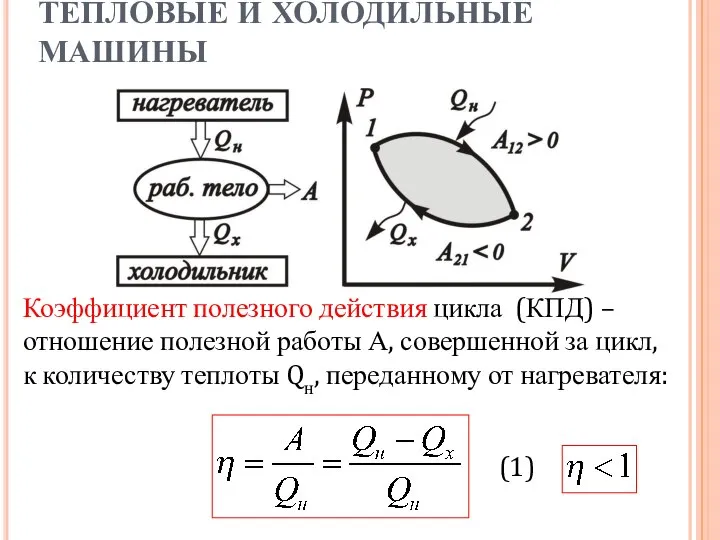
- 3. Условная схема тепловой машины и ее термодинамический цикл: ТЕПЛОВЫЕ И ХОЛОДИЛЬНЫЕ МАШИНЫ Работа газа за цикл:
- 4. ТЕПЛОВЫЕ И ХОЛОДИЛЬНЫЕ МАШИНЫ Коэффициент полезного действия цикла (КПД) – отношение полезной работы А, совершенной за
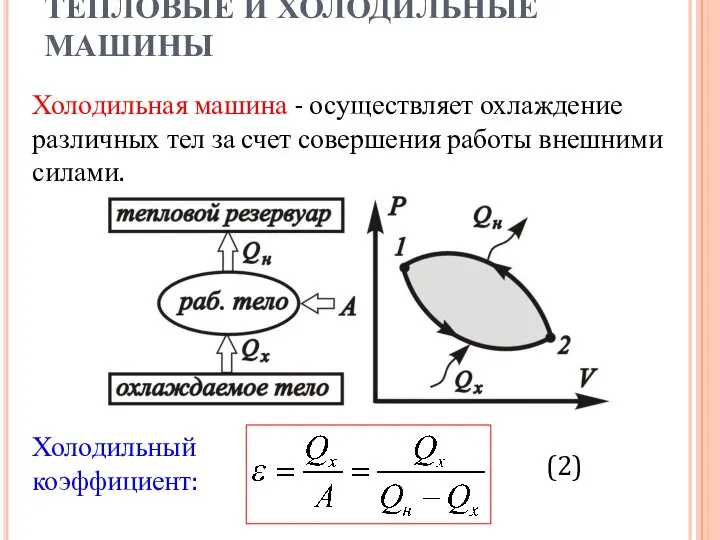
- 5. ТЕПЛОВЫЕ И ХОЛОДИЛЬНЫЕ МАШИНЫ . Холодильная машина - осуществляет охлаждение различных тел за счет совершения работы
- 6. 1850 г., Р. Клаузиус: Теплота не может самопроизвольно перейти от более холодного тела к более теплому.
- 7. Обратимый процесс – процесс, в результате которого система переходит из одного состояния в другое и возможен
- 8. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ Необратимые процессы возникают в системах, в которых наблюдается нарушение состояния равновесия, и
- 9. За весь цикл производится работа: Цикл Карно – состоит из двух изотерм и двух адиабат. ЦИКЛ
- 10. Первая теорема Карно: Коэффициент полезного действия любой обратимой тепловой машины, работающей по циклу Карно, не зависит
- 11. 1-2: изотермическое нагревание 2-3: адиабатное расширение 3-4: изотермическое сжатие 4-1: адиабатное сжатие ЦИКЛ КАРНО. ТЕОРЕМЫ КАРНО
- 12. 2-3: 4-1: [26] [28] Вторая теорема Карно: КПД любой тепловой машины, работающей по необратимому циклу, меньше
- 13. Неравенство Клаузиуса - приведенное количество теплоты в процессе 1-2 δQ – теплота, переданная системе от резервуара
- 14. [26], [28] Неравенство Клаузиуса [30] Приведенное количество теплоты, полученное системой в обратимом цикле Карно, равно нулю.
- 15. Неравенство Клаузиуса Можно показать, что утверждения, сделанные относительно приведенного количества теплоты, полученного системой за цикл Карно
- 16. Энтропия . [34] Пусть процесс 1а2b - обратимый [31] Энтропия – это функция состояния термодинамической системы,
- 17. Энтропия [32] [36] Обобщая (35) и (36) на любые процессы: Если процесса 1а2 - обратимый, а
- 18. Энтропия идеального газа Уравнение (37) в дифференциальном виде: СV – молярная теплоемкость идеального газа [38] [39]
- 19. . Закон возрастания энтропии В адиабатически изолированной системе δQ = 0 [37] Закон возрастания энтропии: В
- 21. Скачать презентацию








![2-3: 4-1: [26] [28] Вторая теорема Карно: КПД любой тепловой машины,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1299948/slide-11.jpg)

![[26], [28] Неравенство Клаузиуса [30] Приведенное количество теплоты, полученное системой в](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1299948/slide-13.jpg)

![Энтропия . [34] Пусть процесс 1а2b - обратимый [31] Энтропия –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1299948/slide-15.jpg)
![Энтропия [32] [36] Обобщая (35) и (36) на любые процессы: Если](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1299948/slide-16.jpg)
![Энтропия идеального газа Уравнение (37) в дифференциальном виде: СV – молярная теплоемкость идеального газа [38] [39]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1299948/slide-17.jpg)

 Храми Японії та Китаю
Храми Японії та Китаю Презентация Первый урок алгебры 7 класс
Презентация Первый урок алгебры 7 класс Easy Trace
Easy Trace  Презентация "Луис Комфорт Тиффани" - скачать презентации по МХК
Презентация "Луис Комфорт Тиффани" - скачать презентации по МХК Танцевальная физминутка "Лепим снеговика" (1-4 класс)
Танцевальная физминутка "Лепим снеговика" (1-4 класс) Глава 3. Экономика фирмы 18. Фирма на рынке
Глава 3. Экономика фирмы 18. Фирма на рынке  День защитника отечества 23 февраля
День защитника отечества 23 февраля Share manager
Share manager Презентация "Основы функционирования малого бизнеса" - скачать презентации по Экономике
Презентация "Основы функционирования малого бизнеса" - скачать презентации по Экономике О реализации пилотного проекта Межвузовской индексно-рейтинговой системы оценки студентов, как будущих работников ПАО «Газпром»
О реализации пилотного проекта Межвузовской индексно-рейтинговой системы оценки студентов, как будущих работников ПАО «Газпром» Интернационализация и ее воздействие на стратегию нового университета Джон Филден
Интернационализация и ее воздействие на стратегию нового университета Джон Филден Государственный мемориальный историко-литературный и природно-ландшафтный музей-заповедник А.С.Пушкина "Михайловское"
Государственный мемориальный историко-литературный и природно-ландшафтный музей-заповедник А.С.Пушкина "Михайловское" Акбаян5,09
Акбаян5,09 Презентация на тему "Психологическое сопровождение учащихся при подготовке к ЕГЭ и ЕРЭ" - скачать презентации по Педагогике
Презентация на тему "Психологическое сопровождение учащихся при подготовке к ЕГЭ и ЕРЭ" - скачать презентации по Педагогике Гибкость и методика ее развития
Гибкость и методика ее развития кухня
кухня Правовые основы ведения бухгалтерского учета и составления бухгалтерской отчетности
Правовые основы ведения бухгалтерского учета и составления бухгалтерской отчетности Сергий Радонежский. К 705-летию со дня рождения
Сергий Радонежский. К 705-летию со дня рождения расширенный цикл
расширенный цикл  Презентация на тему Мир динозавров Юрский период Мезозойской эры
Презентация на тему Мир динозавров Юрский период Мезозойской эры Русские народные праздники. Ярмарка
Русские народные праздники. Ярмарка Параолимпийцы России. Плавание
Параолимпийцы России. Плавание Современная теория демократии
Современная теория демократии Урок №2. Урок №2. Православие и культура. Учитель:
Урок №2. Урок №2. Православие и культура. Учитель:  Презентация____
Презентация____ РЕФЛЕКТОРНЫЙ ПРИНЦИП ДЕЯТЕЛЬНОСТИ НЕРВНОЙ СИСТЕМЫ
РЕФЛЕКТОРНЫЙ ПРИНЦИП ДЕЯТЕЛЬНОСТИ НЕРВНОЙ СИСТЕМЫ Футбол в детской художественной литературе
Футбол в детской художественной литературе Культура и быт XVII века
Культура и быт XVII века