Содержание
- 2. Внутренняя энергия является функцией состояния термодинамической системы: В т/д процессах внутримолекулярная и внутриядерная энергии не меняются,
- 3. ВНУТРЕННЯЯ ЭНЕРГИЯ Изменение внутренней энергии идеального газа: [3] - внутренняя энергия идеального газа [2] Найдем внутреннюю
- 4. СПОСОБЫ ИЗМЕНЕНИЯ ВНУТРЕННЕЙ ЭНЕРГИИ Теплообмен Количество теплоты Q - количество энергии, переданное от одного тела другому
- 5. Для элементарного процесса: А и Q зависят от вида процесса! ΔU не зависит от вида протекающего
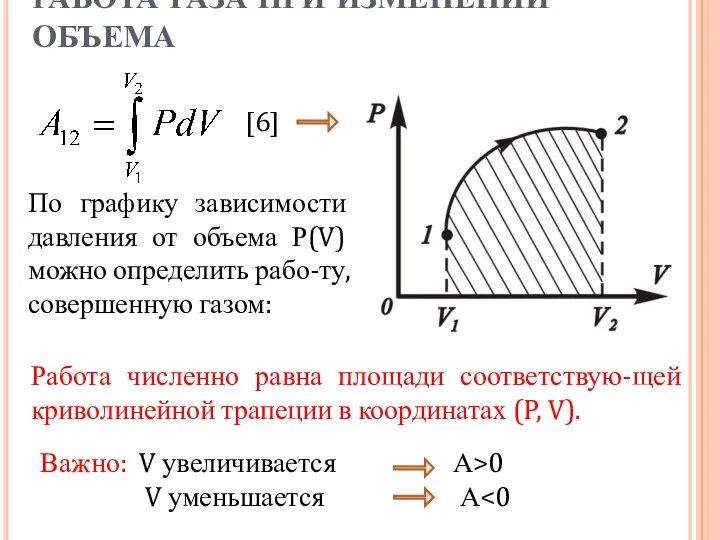
- 6. [6] РАБОТА ГАЗА ПРИ ИЗМЕНЕНИИ ОБЪЕМА Рассмотрим газ в сосуде под поршнем площадью S. При соударении
- 7. РАБОТА ГАЗА ПРИ ИЗМЕНЕНИИ ОБЪЕМА По графику зависимости давления от объема Р(V) можно определить рабо-ту, совершенную
- 8. Изотермический процесс: Т = const 2. Изобарный процесс: Р = const 3. Изохорный процесс: V =
- 9. Теплоемкостью тела называется отношение бесконечно малого количества теплоты, полу-ченного телом, к соответствующему изменению его температуры: (7)
- 10. Связь удельной и молярной теплоемкости: (10) Найдем молярную теплоемкость идеального газа в изопроцессах. Для нахождения δQ
- 11. ТЕПЛОЕМКОСТЬ ИДЕАЛЬНОГО ГАЗА . 2) Р = const → (12) Формула Майера: (13) 3) Т =
- 12. Опыт → число степеней свободы молекулы зависит от температуры газа → при значительных измене-ниях температуры теплоемкость
- 13. Процесс, протекающий без теплообмена термо-динамической системы с окружающей средой, называется адиабатическим. δQ = 0 → первое
- 14. АДИАБАТИЧЕСКИЙ ПРОЦЕСС . (15) γ - показатель адиабаты (коэффициент Пуассона) Решая данную систему уравнений можно получить
- 16. Скачать презентацию

![ВНУТРЕННЯЯ ЭНЕРГИЯ Изменение внутренней энергии идеального газа: [3] - внутренняя энергия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1299947/slide-2.jpg)


![[6] РАБОТА ГАЗА ПРИ ИЗМЕНЕНИИ ОБЪЕМА Рассмотрим газ в сосуде под](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1299947/slide-5.jpg)







 Душа, як правило, передається через вираз очей, через погляд, спрямований на глядача… Відділ мистецтв пропонує! З циклу онлайн презентацій “Креатив” ОЧІ ЕПОХ III Західна
Душа, як правило, передається через вираз очей, через погляд, спрямований на глядача… Відділ мистецтв пропонує! З циклу онлайн презентацій “Креатив” ОЧІ ЕПОХ III Західна  C#, объектно-ориентированное программирование
C#, объектно-ориентированное программирование Презентация на тему "Ошибки ставшие откытиями" - скачать презентации по Педагогике
Презентация на тему "Ошибки ставшие откытиями" - скачать презентации по Педагогике Рестлинг. История рестлинга
Рестлинг. История рестлинга Составление разветвляющихся алгоритмов
Составление разветвляющихся алгоритмов Лица, перемещающие товары и транспортные средства через таможенную границу, как субъекты таможенного права. Подготовили студент
Лица, перемещающие товары и транспортные средства через таможенную границу, как субъекты таможенного права. Подготовили студент Programming paradigms
Programming paradigms Big picture. Persistence
Big picture. Persistence Утренняя зарядка. Правила её составления и выполнения
Утренняя зарядка. Правила её составления и выполнения ИНФОРМАЦИОННАЯ БЕЗОПАСНОСТЬ: ОСНОВНЫЕ АСПЕКТЫ, СОВРЕМЕННОЕ СОСТОЯНИЕ
ИНФОРМАЦИОННАЯ БЕЗОПАСНОСТЬ: ОСНОВНЫЕ АСПЕКТЫ, СОВРЕМЕННОЕ СОСТОЯНИЕ Федеральная Служба Охраны РФ
Федеральная Служба Охраны РФ Эгейское искусство Материалы к уроку МХК В 10 классе _
Эгейское искусство Материалы к уроку МХК В 10 классе _ Начертательная геометрия. Введение
Начертательная геометрия. Введение Рефлекторный принцип деятельности ЦНС
Рефлекторный принцип деятельности ЦНС Внешний образ современного учителя
Внешний образ современного учителя Кокки. cтом
Кокки. cтом Сравнительное правоведение. Чиркин Вениамин Евгеньевич
Сравнительное правоведение. Чиркин Вениамин Евгеньевич Презентация на тему "подготовка к ЕНТ" - скачать презентации по Педагогике
Презентация на тему "подготовка к ЕНТ" - скачать презентации по Педагогике Конструкторская документация. Чертежи деталей и изделий из древесины
Конструкторская документация. Чертежи деталей и изделий из древесины Астродиетология. Обозначения знаков зодиака, планет и аспектов
Астродиетология. Обозначения знаков зодиака, планет и аспектов рисуем мальчика - презентация для начальной школы
рисуем мальчика - презентация для начальной школы Презентация "ГРАФФИТИ" - скачать презентации по МХК
Презентация "ГРАФФИТИ" - скачать презентации по МХК Первый шаг к «эффективному тестировщику»: профориентация Юлия Нечаева, NIX Solutions, Харьков, Украина
Первый шаг к «эффективному тестировщику»: профориентация Юлия Нечаева, NIX Solutions, Харьков, Украина  Симплекс метод розв’язання задачі лінійного програмування
Симплекс метод розв’язання задачі лінійного програмування Военно-специальная подготовка
Военно-специальная подготовка БИОХИМИЯ МИОКАРДА-МОЗГА
БИОХИМИЯ МИОКАРДА-МОЗГА  Синхронные машины
Синхронные машины Презентация на тему "Дружная семья" - скачать презентации по Педагогике
Презентация на тему "Дружная семья" - скачать презентации по Педагогике