Содержание
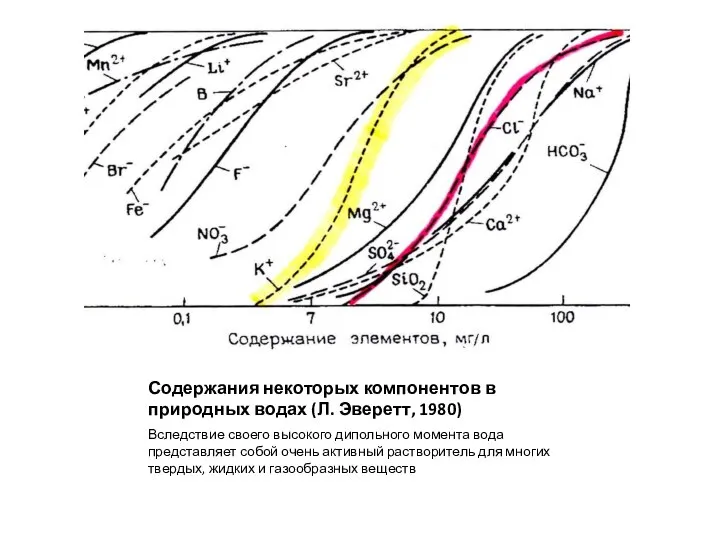
- 2. Содержания некоторых компонентов в природных водах (Л. Эверетт, 1980) Вследствие своего высокого дипольного момента вода представляет
- 3. Анионы Хлор-ион. Растворимость NaCl при 20о – 360 г/кг при 100о – 391. Хлориды кальция и
- 4. Растворение каменной соли Вторым источником хлор-иона в подземных водах является растворение залежей каменной соли (галита) и
- 5. Роль хлор-иона для живого вещества Хлор относится к важнейшим биогенным элементам и входит в состав всех
- 6. Загрязнение вод. Хлорорганические соединения - продукты замещения в органических соединениях атомов водорода хлором (диоксины, пестициды и
- 7. Сульфат-ион Главным источником сульфат-иона являются широко распространенные горные породы – гипсы и ангидриты. CaSO4 (ангидрит)+ H2O
- 8. сульфатредукция В отличие от хлор-иона, почти не вступающего в химические реакции, сульфат-ион легко восстанавливается при взаимодействии
- 9. Гидрокарбонат-ион Концентрации изменяются от долей мг/л (кислые воды) до 2-3 г/л (нарзаны), реже до 100 г/л
- 10. диссоциация угольной кислоты Концентрации гидрокарбонат-иона в подземных водах лимитируются также уравнениями диссоциации угольной кислоты H2СO3↔HСO3+H ;
- 11. выветривание алюмосиликатов Вторым источником гидрокарбонат-иона в природных водах являются процессы выветривания алюмосиликатов Все эти реакции ведут
- 12. Катионы Натрий (Na+). Является преобладающим среди катионов океанской воды, содержащей 10,8 г/кг натрия (77,3 %-экв). Накапливался
- 13. Источники натрия При формировании морских осадков, сопровождающемся захоронением соленой воды, в водоносные горизонты попадает значительное количество
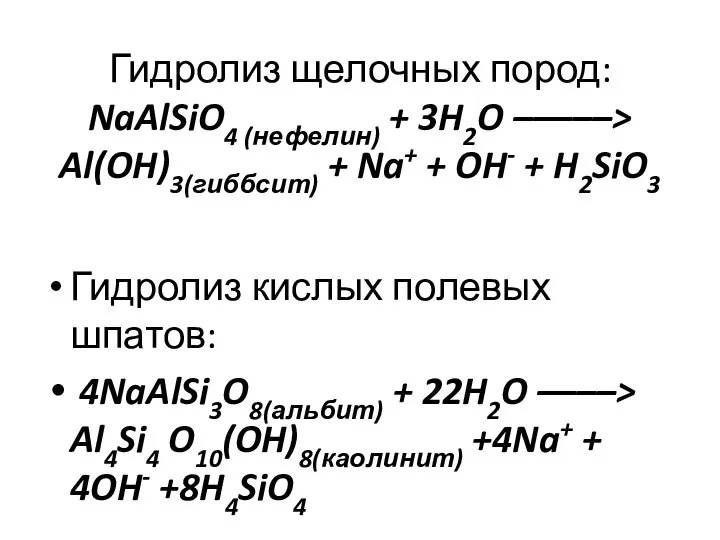
- 14. Гидролиз щелочных пород: NaAlSiO4 (нефелин) + 3H2O –––––> Al(OH)3(гиббсит) + Na+ + OH- + H2SiO3 Гидролиз
- 15. Калий (K+). Калийные соли хорошо растворимы. Растворимость KСl при 20о – 340 г/кг, при 100о –
- 16. Кальций (Ca2+). Высокая растворимость хлоридов (745 г/кг при 20о и 1590 при 100о), относительно низкая –
- 17. При растворении гипсов и ангидритов концентрации кальция достигают 450–600 мг/л. Процессы растворения и выщелачивания горных пород
- 18. 2Naтв + Сa2+ р-р Caтв + 2Na+р-р В результате относительное содержание кальция в подземных рассолах оказывается
- 20. Скачать презентацию















 Автопилот в автомобиле
Автопилот в автомобиле Понятие и роль документационного обеспечения управления персоналом
Понятие и роль документационного обеспечения управления персоналом «Матрешка - самая известная русская игрушка». Папка-передвижка для родителей
«Матрешка - самая известная русская игрушка». Папка-передвижка для родителей Новоодеська централізована бібліотечна система. Бузька бібліотека-філія
Новоодеська централізована бібліотечна система. Бузька бібліотека-філія Процессы. Понятие процесса. Состояния процесса. Блок управления процессом
Процессы. Понятие процесса. Состояния процесса. Блок управления процессом Механика, оның бөлімдері және қозғалысты оқып үйренуде қолданылатын абстракциялық ұғымдар
Механика, оның бөлімдері және қозғалысты оқып үйренуде қолданылатын абстракциялық ұғымдар Meine sommerfeiren
Meine sommerfeiren Алгоритм BlowFish
Алгоритм BlowFish Arcade Cover. MF Thomas
Arcade Cover. MF Thomas Готика. Готический стиль
Готика. Готический стиль Урок обучения грамоте по теме «Закрепление звуков [о],[э]» Подготовил учитель начальных классов МБОУ гимназии №14 г. Одинцово Бочар
Урок обучения грамоте по теме «Закрепление звуков [о],[э]» Подготовил учитель начальных классов МБОУ гимназии №14 г. Одинцово Бочар Зимние виды спорта
Зимние виды спорта Оздоровительные технологии (Скандинавская ходьба)
Оздоровительные технологии (Скандинавская ходьба) План событийного туризма 3 квартал 2019 г.
План событийного туризма 3 квартал 2019 г. Отделочные материалы
Отделочные материалы Koruma Sorumluluğu Doktrini ve Değişen Egemenlik Anlayışı
Koruma Sorumluluğu Doktrini ve Değişen Egemenlik Anlayışı Лазерная технология 5
Лазерная технология 5 Der Computer – ein Werkzeug der Zukunft
Der Computer – ein Werkzeug der Zukunft Animal-Zoo
Animal-Zoo Парные согласные 2 класс - презентация_
Парные согласные 2 класс - презентация_ Художественная культура Китая
Художественная культура Китая Товариство з обмеженою відповідальністю «АРТ-БУД-ПЛЮС»
Товариство з обмеженою відповідальністю «АРТ-БУД-ПЛЮС» Отчет об исследованиях
Отчет об исследованиях Особенности методики развития координации движений и ловкости спортсмена
Особенности методики развития координации движений и ловкости спортсмена Пресс-релиз
Пресс-релиз  Юридическая компания "Аврора"
Юридическая компания "Аврора" 1. Замок феодала.
1. Замок феодала. ВКР: Наречия модальностей предположения и долженствования в современном японском языке
ВКР: Наречия модальностей предположения и долженствования в современном японском языке