Содержание
- 2. Классификация по минерализации 1 г/кг = 1000 мг/кг = 1000 ррm = 0,1 % = 1
- 3. Классификации по преобладающим ионам С.А.Щукарев, А.А.Бродский. Н.И.Толстихин, К.Е.Питьева Классификация О.А.Алекина классы C,S,Cl; группы Са,Mg,Na типы (с
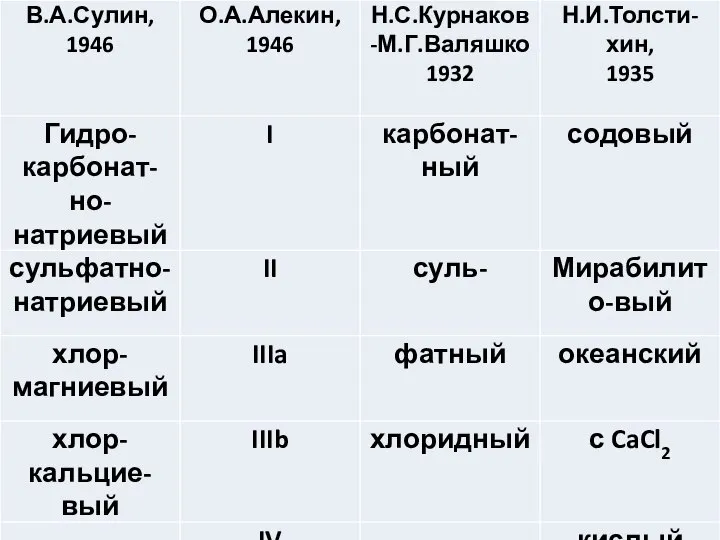
- 4. Классификация В.А.Сулина (по характерным солям) гидрокарбонатно-натриевый тип сульфатно-натриевый тип хлор-магниевый тип хлор-кальциевый тип Генетические истоки классификации
- 5. Классификация Н.С.Курнакова-М.Г.Валяшко Карбонатный, сульфатный, хлоридный типы природных вод. Истоки. Исследования формирования соляных месторождений, проводившиеся в тридцатые
- 7. Кислород (O2) Объемная доля кислорода в воздухе составляет 20,9 %. Растворимость кислорода (при 0 °C и
- 8. В недрах кислород расходуется на окисление органич. веществ, Fe, сульфидов. Участие аэробных бактерий приводит к появлению
- 9. Озон (O3) (от др-греч ὄζω — пахну) Впервые озон обнаружил в 1785 г. голландский физик М.
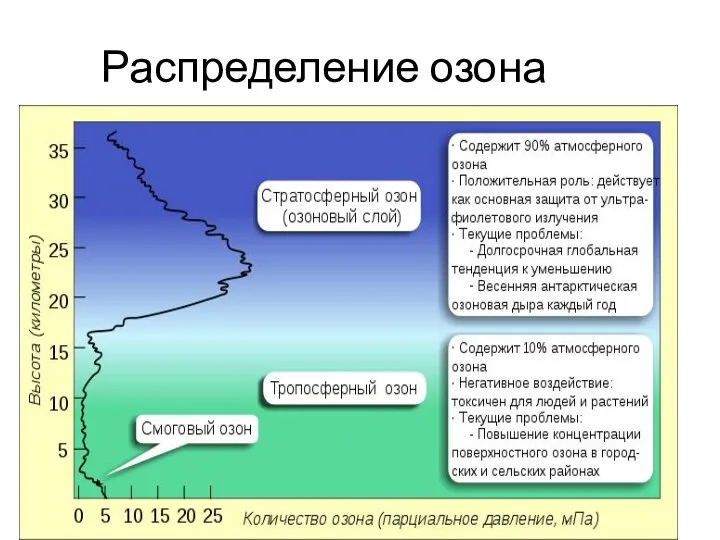
- 10. Распределение озона В воздухе на поверхности Земли 1.1012 см-3 (молекул в куб.см газа). На высоте 15-25
- 11. Распределение озона
- 12. Образование Озон образуется под действием ультрафиолетовых лучей с длиной волны менее 180 нм. УФ-свет с большей
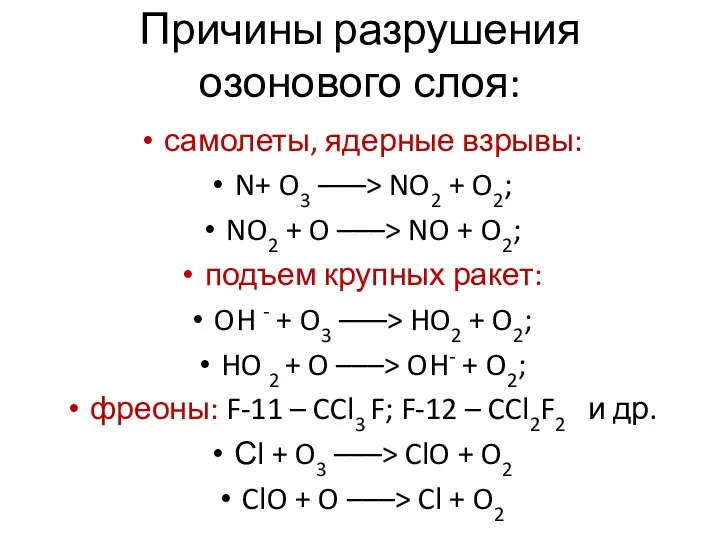
- 14. Причины разрушения озонового слоя: самолеты, ядерные взрывы: N+ O3 –––> NO2 + O2; NO2 + O
- 15. Углекислый газ (CO2) В воздухе: начало века – 0,030 %; семидесятые годы 0,033, теперь около 0,04.
- 16. Подземные воды содержат значительно большее количество углекислого газа. Является обязательным компонентом большинства природных вод. Процессы окисления
- 17. Другим мощным источником CO2 в недрах являются процессы термального метаморфизма горных пород На всех стадиях термального
- 18. Выделяющийся CO2 вдоль зоны тектонического нарушения создает травертиновый хребет (вблизи г. Сиена)
- 19. Травертин - (синоним — известковый туф) — легкая пористая (ячеистая) порода, образовавшаяся в результате осаждения карбоната
- 20. Концентрация углекислого газа в таких водах зависит от его парциального давления и температуры и обычно составляет
- 21. CO2 скапливается в понижениях рельефа
- 22. Аргон (Ar) Является постоянной составляющей газового состава природных вод. Содержание аргона в воздухе по объему составляет
- 23. Поскольку Ar как благородный газ не вступает в реакции с горными породами, его содержание в воздухе
- 24. Гелий (He). Это один из самых распространенных во Вселенной газов, составляющий 23 % от общей массы
- 25. Гелий как индикатор возраста и генезиса воды He/Ar для воздуха около 0,0005. Накопление – радиоактивный распад
- 26. Гелий имеет два стабильных изотопа – 3He и 4He, причем содержание тяжелого изотопа всегда на несколько
- 27. Водород (H2) Водород – самый распространенный элемент Вселенной. В земных условиях водород распространен прежде всего в
- 28. Влияние процессов серпентинизации ультрабазитов на формирование состава флюидов прослеживается по реакции (Сharlou et al., 2002; Леин
- 30. Скачать презентацию
























 Диагностика ИСУД ученика Параметры индивидуального стиля учебной деятельности ученика
Диагностика ИСУД ученика Параметры индивидуального стиля учебной деятельности ученика Гражданство
Гражданство Главная тайна растений - презентация для начальной школы_
Главная тайна растений - презентация для начальной школы_ Информационные ресурсы и сервисы интернета. Коммуникационные технологии
Информационные ресурсы и сервисы интернета. Коммуникационные технологии The operation of the diode and the device
The operation of the diode and the device Израиль против террористических группировок
Израиль против террористических группировок Зайчик и рябина - презентация для начальной школы_
Зайчик и рябина - презентация для начальной школы_ Северо-западный федеральный округ
Северо-западный федеральный округ Швейная машинка
Швейная машинка Гарантия в пользу налоговых органов для некрупных экспортёров
Гарантия в пользу налоговых органов для некрупных экспортёров Мозаика «Попугай» Мозаика «Попугай»
Мозаика «Попугай» Мозаика «Попугай» American versus British English
American versus British English Управленческая мысль в России в 20-е г. ХХ в. Презентация выполнена студентками 1 курса экономического факультета Кузнецовой А.И; Г
Управленческая мысль в России в 20-е г. ХХ в. Презентация выполнена студентками 1 курса экономического факультета Кузнецовой А.И; Г Введение в XML
Введение в XML Книга Даниила
Книга Даниила Презентация на тему "портфолио воспитателя" - скачать презентации по Педагогике
Презентация на тему "портфолио воспитателя" - скачать презентации по Педагогике Дробные рациональные уравнения Подготовила: учитель математики МОУ сош №30 имени А.И.Колдунова Кутоманова Е.М. 2010-2011 учебный год
Дробные рациональные уравнения Подготовила: учитель математики МОУ сош №30 имени А.И.Колдунова Кутоманова Е.М. 2010-2011 учебный год Я ученик 2А класса Козлов Данил Я ученик 2А класса Козлов Данил. Презентация на тему кактусы.
Я ученик 2А класса Козлов Данил Я ученик 2А класса Козлов Данил. Презентация на тему кактусы.  История Нового года
История Нового года «Секреция».
«Секреция». Рынок сыров и критерии их классификации
Рынок сыров и критерии их классификации Конус и призма
Конус и призма Основы нравственной культуры народов России
Основы нравственной культуры народов России Программа элективного курса «Основы фитодизайна»
Программа элективного курса «Основы фитодизайна» Комбинаторные задачи Перестановки Размещения Сочетания (выборки)
Комбинаторные задачи Перестановки Размещения Сочетания (выборки) Презентация "Древесина" - скачать презентации по Экономике
Презентация "Древесина" - скачать презентации по Экономике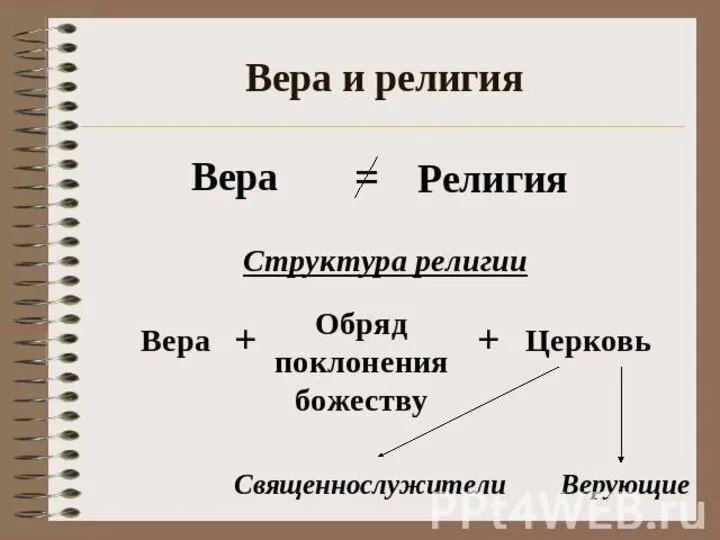 Вера и религия
Вера и религия JavaScript – основы
JavaScript – основы