Содержание
- 2. ювенильная вода Термин «ювенильные» воды впервые был предложен в 1902 году Э. Зюссом для вод, образовавшихся
- 3. В.В. Хаустовым (2011) предлагается ввести понятие ювенильного водного флюида (ЮВФ). ЮВФ - первичная вода, зарождение которой
- 4. ювенильный водный флюид (ЮВФ) ЮВФ - первичная вода, зарождение которой происходит в верхнемантийных и более глубоких
- 5. Что касается минерализации и солевого состава ювенильных вод, то наиболее убедительной представляется гипотеза М.А. Мартыновой и
- 6. Количественная оценка подтока ювенильных растворов О возможной производительности глубинного потока судят опосредовано по: а) интенсивности накопления
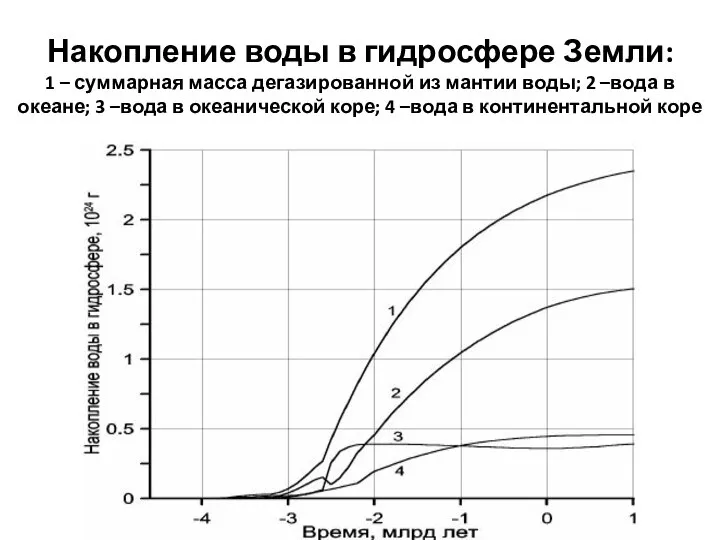
- 7. Накопление воды в гидросфере Земли: 1 – суммарная масса дегазированной из мантии воды; 2 –вода в
- 8. Следует отметить, что существующие количественные оценки подтока ювенильных вод различных авторов различаются на порядки Тем не
- 9. Природная вода это водный раствор, т. е. дисперсная система. В растворе чистая вода является растворителем (диспергатором),
- 10. Как показывают характеристики электропроводности, «чистая» вода также диссоциирует по схеме 2Н2O ⇆ Н3О++ОН-. Часто упрощенно вместо
- 11. Водородный ион (H+) Концентрации ионов водорода и гидроксил-иона в нейтральной среде составляют 10-7 г-моль/л; поскольку ионная
- 12. Природные воды - растворы соляной или серной кислот, встречаются в кратерах вулканов. Содержание водорода в таких
- 13. Гидроксил-ион (OH–) В большинстве природных вод концентрации гидроксил-иона, определяемые значениями рН=6-8, очень малы. Воды с повышенной
- 14. В исключительных случаях могут формироваться воды с pH до 12,3–12,5. Концентрация гидроксил-иона в таких водах достигает
- 15. Изотопный состав природной воды Благодаря работам Вл.Ив. Ферронского, Иг. Нест. Толстихина по изотопии воды нам известно,
- 16. Водород. 1H – протий – 99,98 % 2Н (D) – дейтерий – 0,02 % 3Н (Т)
- 17. SMOW – Standard of Marine Ocean Water D – 0,0158 о/оо; 18О – 0, 1985 о/оо
- 18. SMOW – Standard of Marine Ocean Water D – 0,0158 о/оо; 18О – 0, 1985 о/оо
- 19. Наиболее устойчивой является тяжелая вода D2O. Содержится в виде примеси в обычной воде в сотых долях
- 21. Скачать презентацию

















 Презентация на тему "Презентация портфолио детского сада" - скачать презентации по Педагогике
Презентация на тему "Презентация портфолио детского сада" - скачать презентации по Педагогике Ökologie und umweltverträglichkeit
Ökologie und umweltverträglichkeit ХК Мотор 2010
ХК Мотор 2010 Торжество православия
Торжество православия Уровни и типы построения служб международного маркетинга. Организационные структуры международного маркетинга Выполнили: Бе
Уровни и типы построения служб международного маркетинга. Организационные структуры международного маркетинга Выполнили: Бе Процессы Эксплуатации и сопровождения
Процессы Эксплуатации и сопровождения Как выполнять нормы ГТО по видам испытаний
Как выполнять нормы ГТО по видам испытаний Электротехника и электроника. Гармонические колебания в пассивных элементах электрических цепей. (Лекция 5)
Электротехника и электроника. Гармонические колебания в пассивных элементах электрических цепей. (Лекция 5) Політична система суспільства
Політична система суспільства Презентация "Критика маркетинга со стороны общественности" - скачать презентации по Экономике
Презентация "Критика маркетинга со стороны общественности" - скачать презентации по Экономике Аудитория фитнес-клубов. Редиус реклама
Аудитория фитнес-клубов. Редиус реклама Изобразительное искусство урок МХК, 9 класс Автор: Ананьева Елена Андреевна учитель МХК ГБОУ СОШ №2009 г. Москвы
Изобразительное искусство урок МХК, 9 класс Автор: Ананьева Елена Андреевна учитель МХК ГБОУ СОШ №2009 г. Москвы Стандарты ПИ
Стандарты ПИ ПАТОФИЗИОЛОГИЯ СИСТЕМЫ ДЫХАНИЯ
ПАТОФИЗИОЛОГИЯ СИСТЕМЫ ДЫХАНИЯ Виртуальная инженерия. Управление производством
Виртуальная инженерия. Управление производством ЛУМИНЕСЦЕНТНИ И ЛАЗЕРНИ ИЗТОЧНИЦИ НА СВЕТЛИНА УРОК
ЛУМИНЕСЦЕНТНИ И ЛАЗЕРНИ ИЗТОЧНИЦИ НА СВЕТЛИНА УРОК Политическое лидерство
Политическое лидерство Криптон Ключевая система
Криптон Ключевая система Презентация Правоохранительная деятельность таможенных органов
Презентация Правоохранительная деятельность таможенных органов  Альтернативная энергетика
Альтернативная энергетика Індивідуальне завдання
Індивідуальне завдання Рециркуляция отработавших газов в автомобиле
Рециркуляция отработавших газов в автомобиле Особенности стандартизации строительных материалов и изделий
Особенности стандартизации строительных материалов и изделий Металлический каркас одноэтажного промышленного здания
Металлический каркас одноэтажного промышленного здания Регрессия — погружение в прошлые жизни
Регрессия — погружение в прошлые жизни Cтенфордский линейный ускоритель (SLAC, США)
Cтенфордский линейный ускоритель (SLAC, США) Историческая справка. Курс начертательной геометрии
Историческая справка. Курс начертательной геометрии Конституция России
Конституция России