Содержание
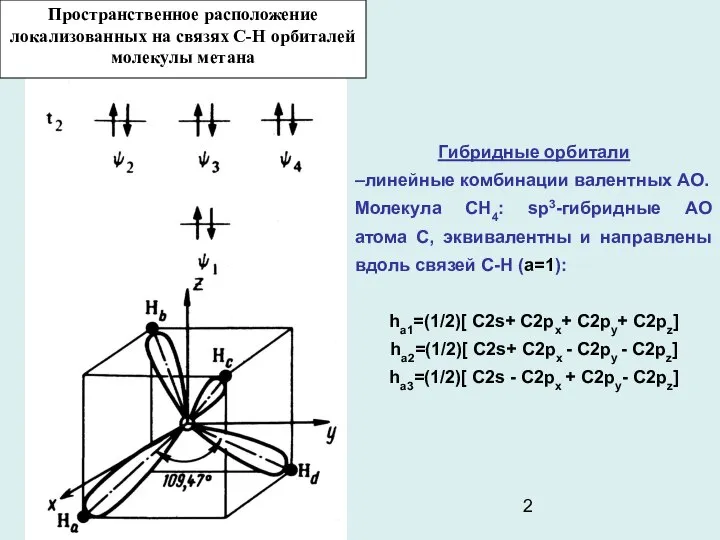
- 2. Пространственное расположение локализованных на связях С-Н орбиталей молекулы метана Гибридные орбитали –линейные комбинации валентных АО. Молекула
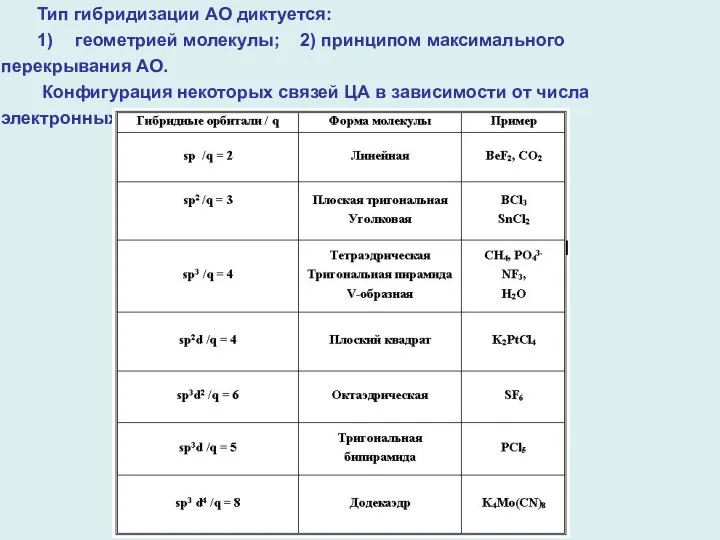
- 3. Тип гибридизации АО диктуется: 1) геометрией молекулы; 2) принципом максимального перекрывания АО. Конфигурация некоторых связей ЦА
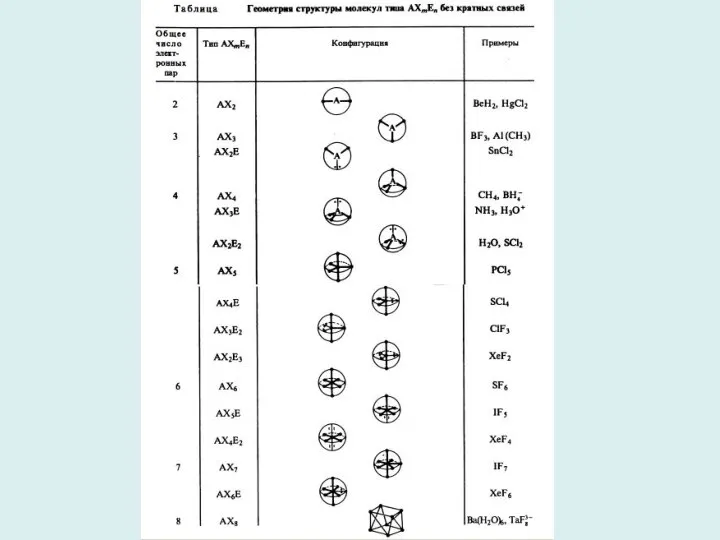
- 5. Модель отталкивания электронных пар Гиллеспи приложима только к соединениям непереходных элементов. Основные идеи: 1.Конфигурация связей многовалентных
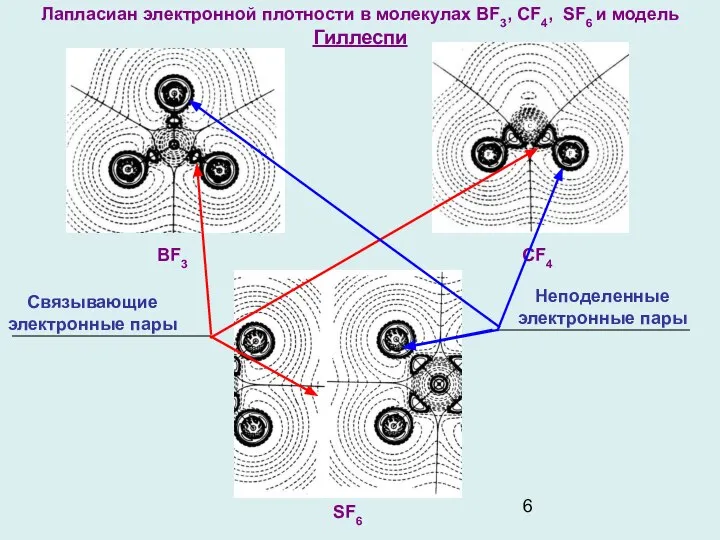
- 6. Лапласиан электронной плотности в молекулах BF3, CF4, SF6 и модель Гиллеспи SF6 CF4 BF3 Связывающие электронные
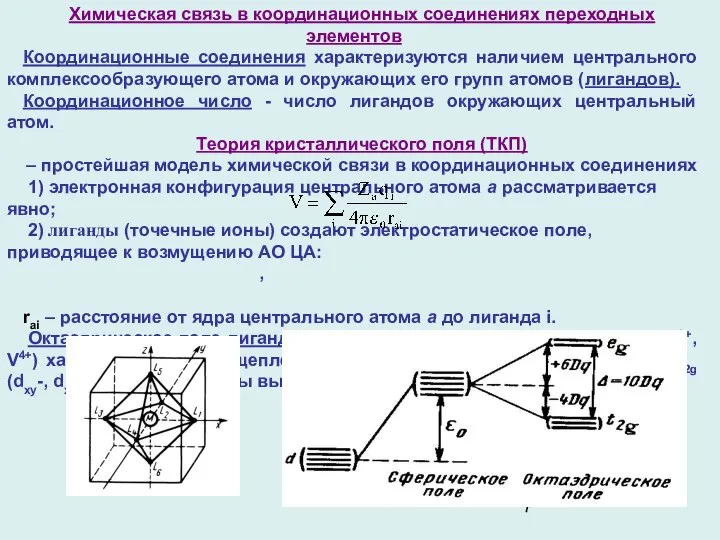
- 7. Химическая связь в координационных соединениях переходных элементов Координационные соединения характеризуются наличием центрального комплексообразующего атома и окружающих
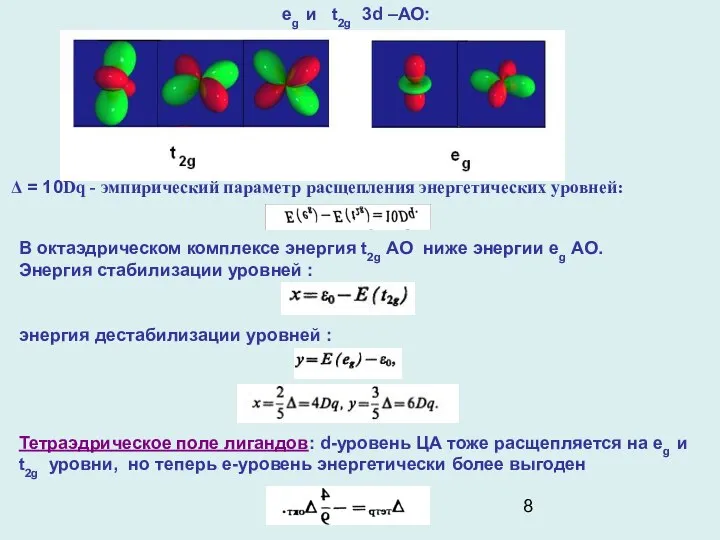
- 8. eg и t2g 3d –АО: Δ = 10Dq - эмпирический параметр расщепления энергетических уровней: В октаэдрическом
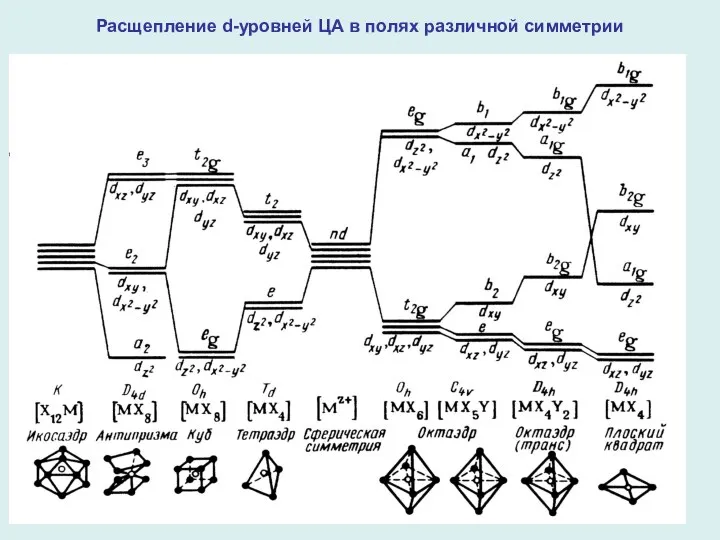
- 9. Расщепление d-уровней ЦА в полях различной симметрии
- 10. Спектрохимический ряд. Величина 10Dq для различных ЦА постоянна и возрастает в следующем ряду лигандов: Ру -
- 11. Октаэдрическое поле лигандов: - Для электронных конфигураций d1 , d2 , d3, d8, d9, d10 есть
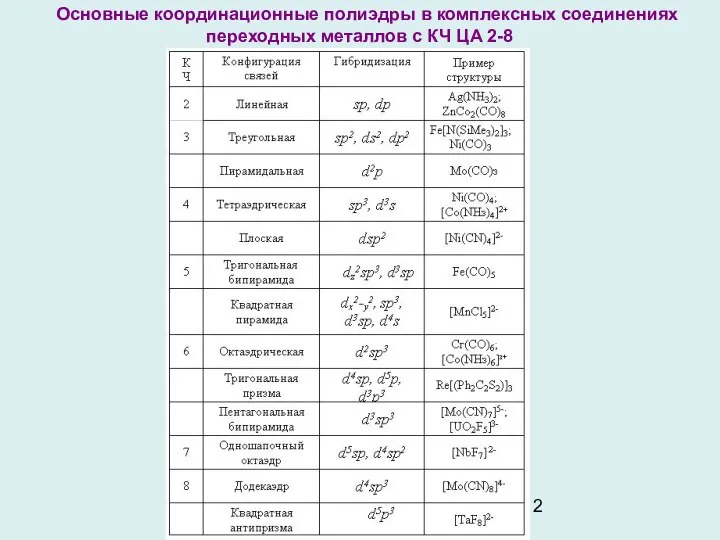
- 12. Основные координационные полиэдры в комплексных соединениях переходных металлов с КЧ ЦА 2-8
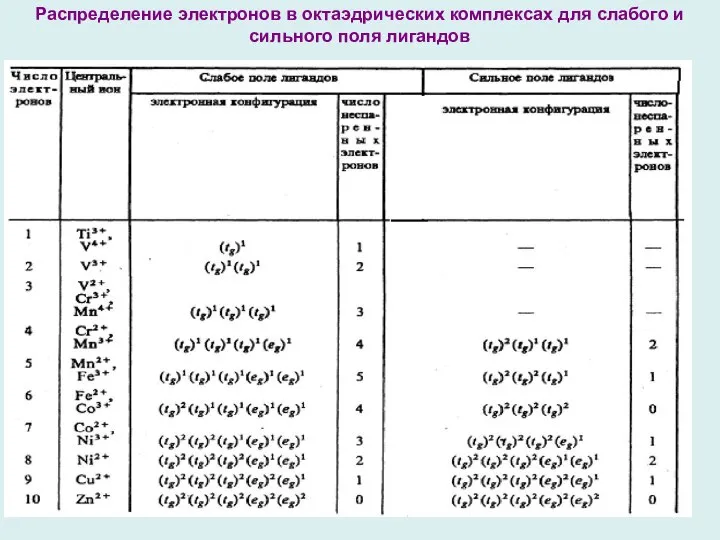
- 13. Распределение электронов в октаэдрических комплексах для слабого и сильного поля лигандов
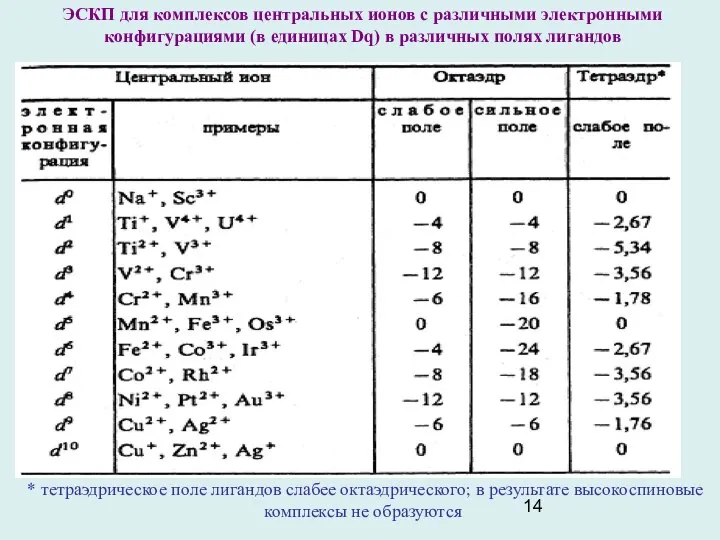
- 14. ЭСКП для комплексов центральных ионов с различными электронными конфигурациями (в единицах Dq) в различных полях лигандов
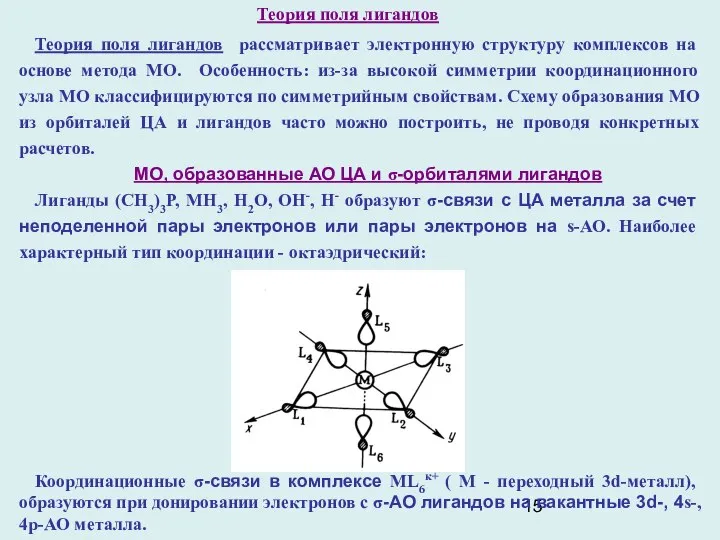
- 15. Теория поля лигандов Теория поля лигандов рассматривает электронную структуру комплексов на основе метода МО. Особенность: из-за
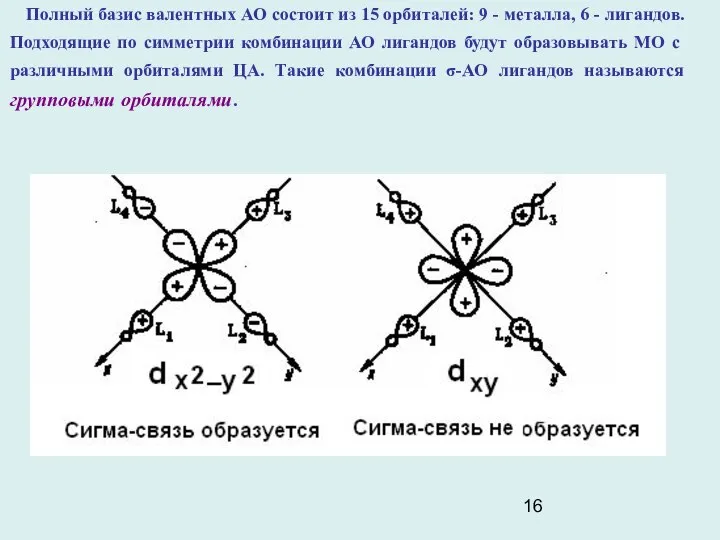
- 16. Полный базис валентных АО состоит из 15 орбиталей: 9 - металла, 6 - лигандов. Подходящие по
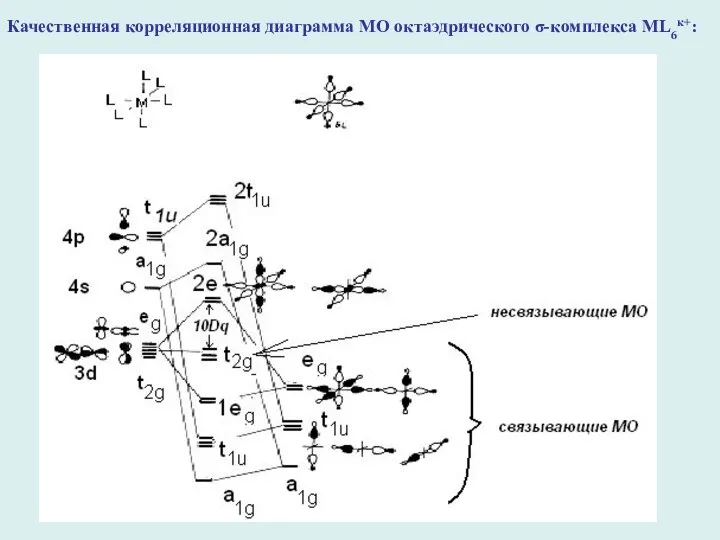
- 17. Качественная корреляционная диаграмма МО октаэдрического σ-комплекса ML6к+:
- 18. Вывод: в октаэдрическом имеется шесть связывающих валентных МО (a1g, tu1, 1eg) и три несвязывающих (t2g) МО,
- 19. Системы, где волновая функция вырождена (например, октаэдрические и плоские комплексы d-элементов), структурно неустойчивы: всегда существуют деформации
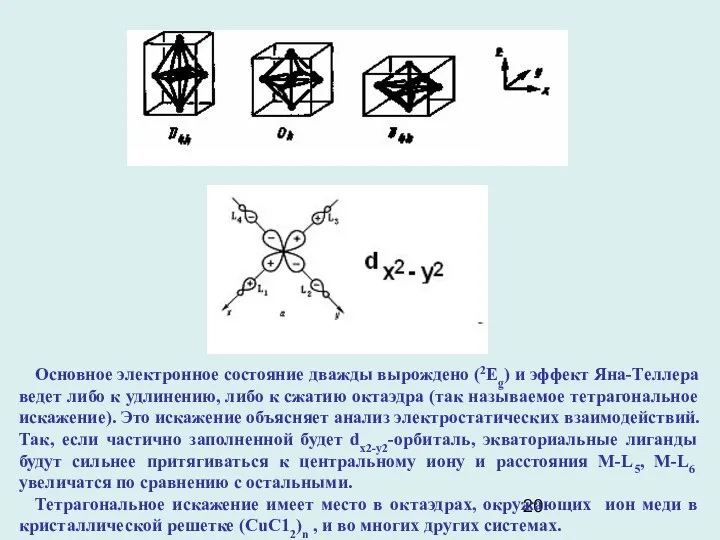
- 20. Основное электронное состояние дважды вырождено (2Eg) и эффект Яна-Теллера ведет либо к удлинению, либо к сжатию
- 21. Валентные орбитали ЦА и групповые орбитали лигандов октаэдрическом комплексе ML6 (связывающие комбинации)
- 23. Скачать презентацию






 Инвестиционные и финансовые решения. Основы принятия инвестиционных решений
Инвестиционные и финансовые решения. Основы принятия инвестиционных решений Технические характеристики тяговых двигателей
Технические характеристики тяговых двигателей Социально-исторические предпосылки государства и права. Возникновение государства и права
Социально-исторические предпосылки государства и права. Возникновение государства и права Профессионально-этический стандарт антикоррупционного поведения сотрудника ОВД
Профессионально-этический стандарт антикоррупционного поведения сотрудника ОВД Фотолитография
Фотолитография Электронные больничные и прямые выплаты ФСС
Электронные больничные и прямые выплаты ФСС Культура, как фактор социальных изменений
Культура, как фактор социальных изменений Зв′язне мовлення. Поняття культури мовлення і спілкування
Зв′язне мовлення. Поняття культури мовлення і спілкування Презентация на тему "ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЯ КОЛОРЕКТАЛЬНОГО РАКА" - скачать презентации по Медицине
Презентация на тему "ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЯ КОЛОРЕКТАЛЬНОГО РАКА" - скачать презентации по Медицине Электрические Цепи Однофазного Синусоидального Тока
Электрические Цепи Однофазного Синусоидального Тока  Работа и мощность силы
Работа и мощность силы  Обработка ошибок
Обработка ошибок Основы кристаллооптики
Основы кристаллооптики  Закон Мерфи
Закон Мерфи Пример плана трассы. Классификация автомобильных дорог. (Заочникам 2)
Пример плана трассы. Классификация автомобильных дорог. (Заочникам 2) Историко-ландшафтный контекст в дизайне архитектурной среды. Региональные особенности архитектуры Казахстана
Историко-ландшафтный контекст в дизайне архитектурной среды. Региональные особенности архитектуры Казахстана День Святого Валентина в Германии
День Святого Валентина в Германии Музей-заповедник И.С. Тургенева Спасское-Лутовиново
Музей-заповедник И.С. Тургенева Спасское-Лутовиново План-конспект урока по праву План-конспект урока по праву (10 класс) «Происхождение государства и права» (параграф 1, стр. 6-11) У
План-конспект урока по праву План-конспект урока по праву (10 класс) «Происхождение государства и права» (параграф 1, стр. 6-11) У Наши бабушки, наши дедушки Абитова Эльвира Фоатовна Учитель начальных классов Высшей категории Школа –интернат №3 г.Энгельса
Наши бабушки, наши дедушки Абитова Эльвира Фоатовна Учитель начальных классов Высшей категории Школа –интернат №3 г.Энгельса Теория игр Метод Робинсон
Теория игр Метод Робинсон Модернізація комп’ютерної мережі навчального закладу
Модернізація комп’ютерної мережі навчального закладу Etyka w administracji publicznej
Etyka w administracji publicznej Базові поняття Knowledge Management
Базові поняття Knowledge Management  Препарирование зубов. Профилактика воспаления пульпы после препарирования
Препарирование зубов. Профилактика воспаления пульпы после препарирования  Пищевые добавки
Пищевые добавки Определение классов и методов
Определение классов и методов План участка контрольного пункта автосцепки (КПА) с расстановкой оборудования
План участка контрольного пункта автосцепки (КПА) с расстановкой оборудования