Содержание
- 2. Термодинамика therme (теплота) + dinamis (сила) наука о силах, связанных с теплотой; изучает взаимосвязь теплоты, работы
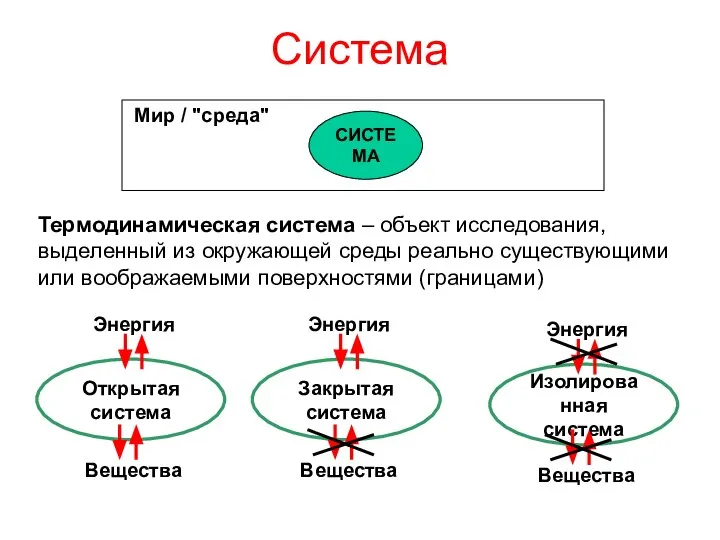
- 3. Система Термодинамическая система – объект исследования, выделенный из окружающей среды реально существующими или воображаемыми поверхностями (границами)
- 4. Свойства системы Совокупность свойств определяет состояние системы f (p, V, T) = 0 – функция состояния;
- 5. Параметры (свойства) системы I (V1, p1, T1) → II (V2, p2, T2) Изменение свойств системы не
- 6. Процессы изотермический (T = const) изобарический (p = const) изохорный (V = const) изобарно-изотермический (p, T
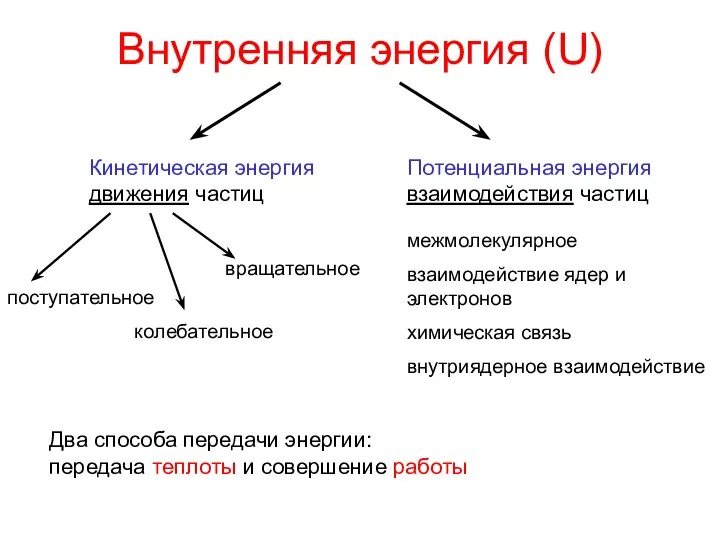
- 7. Внутренняя энергия (U) Кинетическая энергия движения частиц Потенциальная энергия взаимодействия частиц поступательное колебательное вращательное межмолекулярное взаимодействие
- 8. Теплота (Q) Передача теплоты – "микрофизический" (на уровне молекул) способ передачи энергии от системы к системе
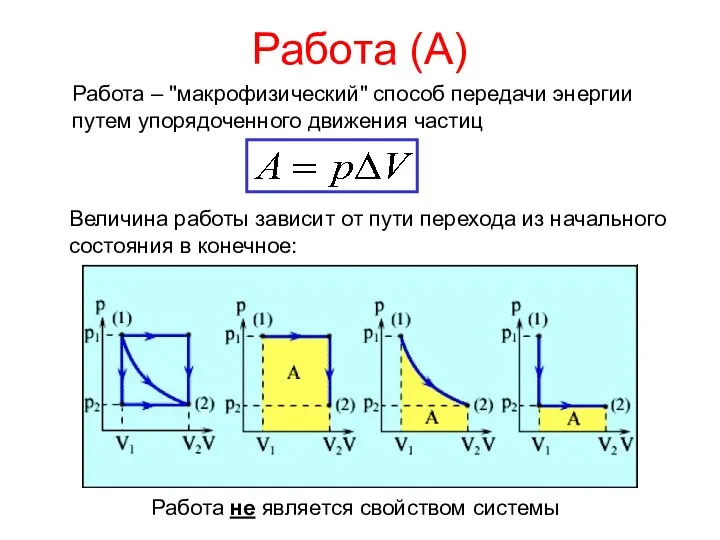
- 9. Работа (А) Работа – "макрофизический" способ передачи энергии путем упорядоченного движения частиц Работа не является свойством
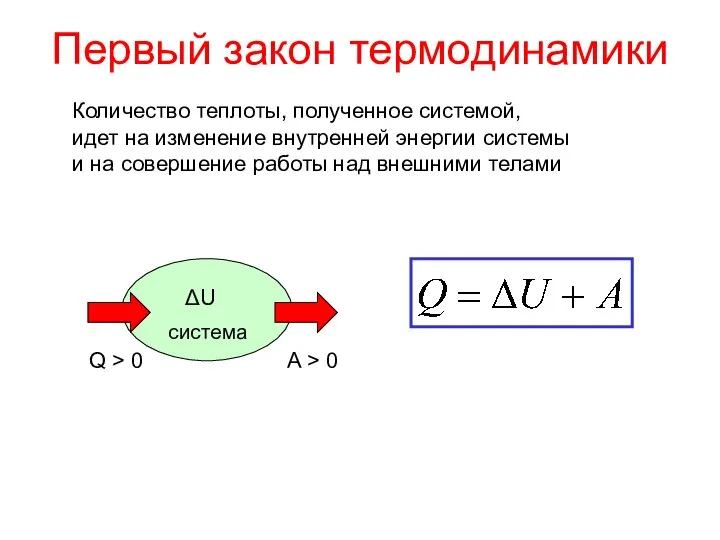
- 10. Первый закон термодинамики Количество теплоты, полученное системой, идет на изменение внутренней энергии системы и на совершение
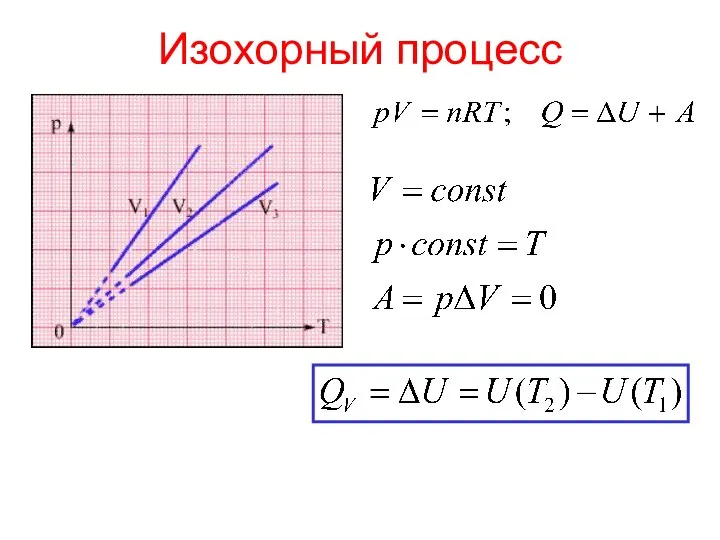
- 11. Изохорный процесс
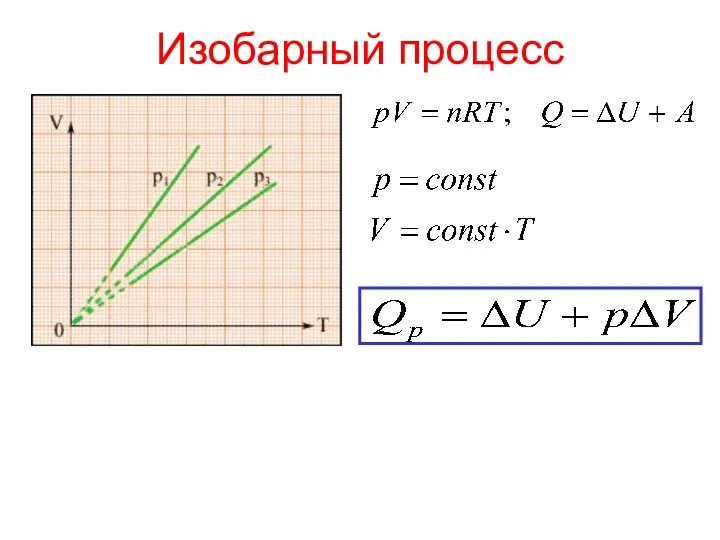
- 12. Изобарный процесс
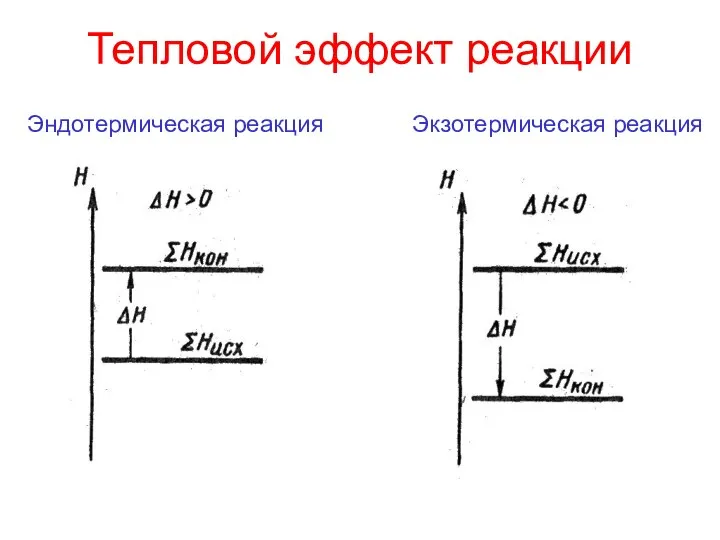
- 13. Тепловой эффект реакции теплота, выделяющаяся или поглощающаяся при химической реакции
- 14. Тепловой эффект реакции Эндотермическая реакция Экзотермическая реакция
- 15. Термохимические уравнения химические уравнения, в которых указан тепловой эффект реакции ΔH°T – дельта аш стандартное при
- 16. Стандартная теплота образования Теплота образования (formation) – тепловой эффект реакции образования 1 моля вещества из простых
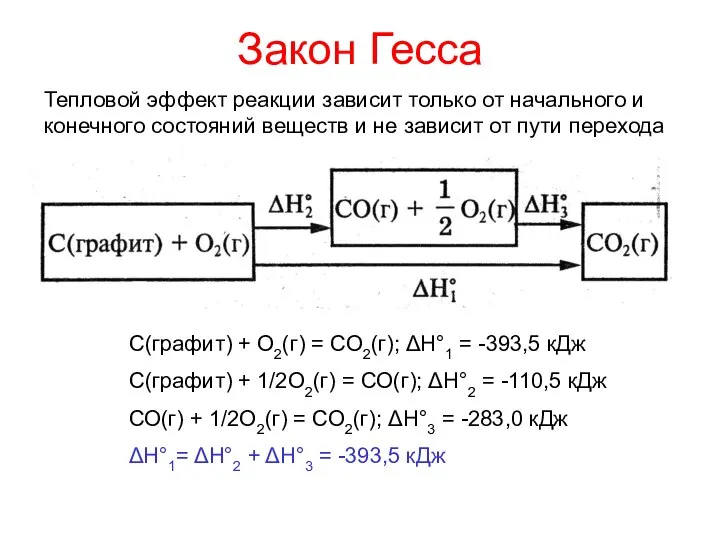
- 17. Закон Гесса С(графит) + О2(г) = СО2(г); ΔН°1 = -393,5 кДж С(графит) + 1/2О2(г) = СО(г);
- 18. Следствия из закона Гесса Закон Лавуазье-Лапласа. Тепловой эффект обратной реакции равен тепловому эффекту прямой реакции с
- 19. Термохимические расчеты Примеры 1) Используя табличные значения энтальпий образования, определите стандартную энтальпию реакции: 3Mn3O4(т) + 8Al(т)
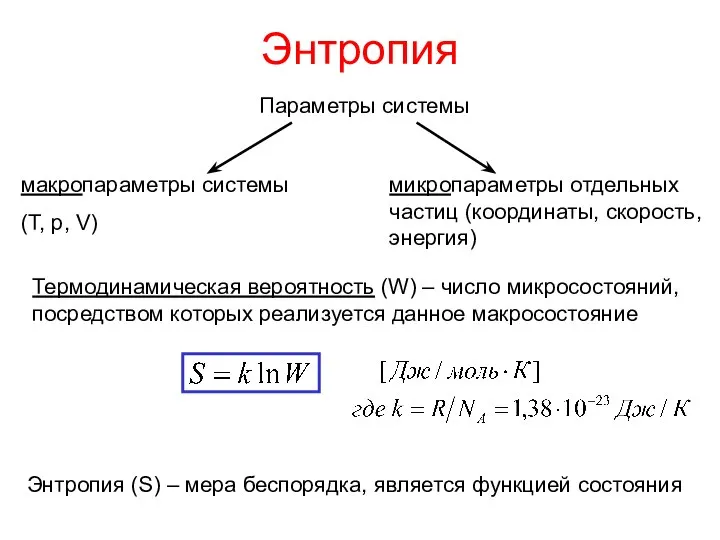
- 20. Энтропия Параметры системы макропараметры системы (Т, р, V) микропараметры отдельных частиц (координаты, скорость, энергия) Термодинамическая вероятность
- 21. Изменение энтропии в химических реакциях Пример Определить изменение энтропии в ходе реакции: 2С(тв.) + О2(г) =
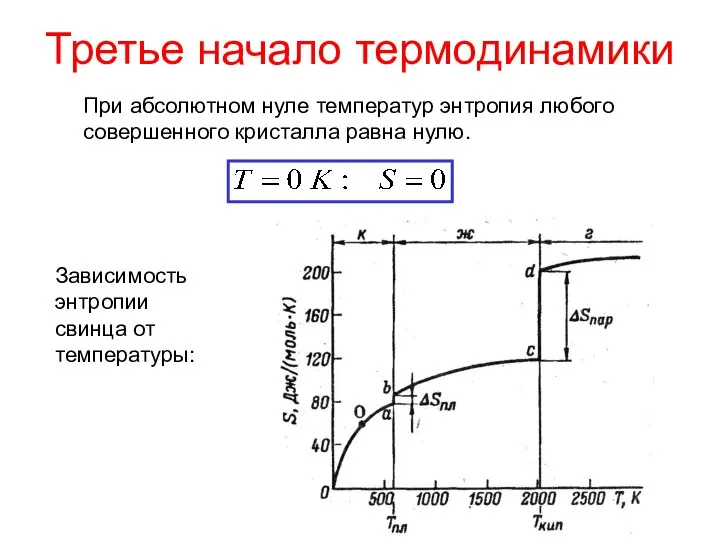
- 22. Третье начало термодинамики При абсолютном нуле температур энтропия любого совершенного кристалла равна нулю. Зависимость энтропии свинца
- 23. Самопроизвольные процессы Принцип Бертло-Томсена. Самопроизвольный химический процесс должен сопровождаться выделением тепла. ΔH Экзотермические реакции Эндотермические реакции
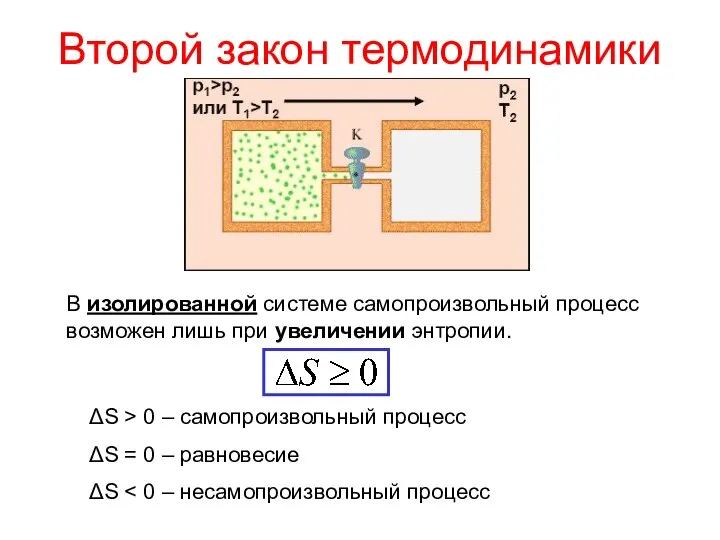
- 24. Второй закон термодинамики В изолированной системе самопроизвольный процесс возможен лишь при увеличении энтропии. ΔS > 0
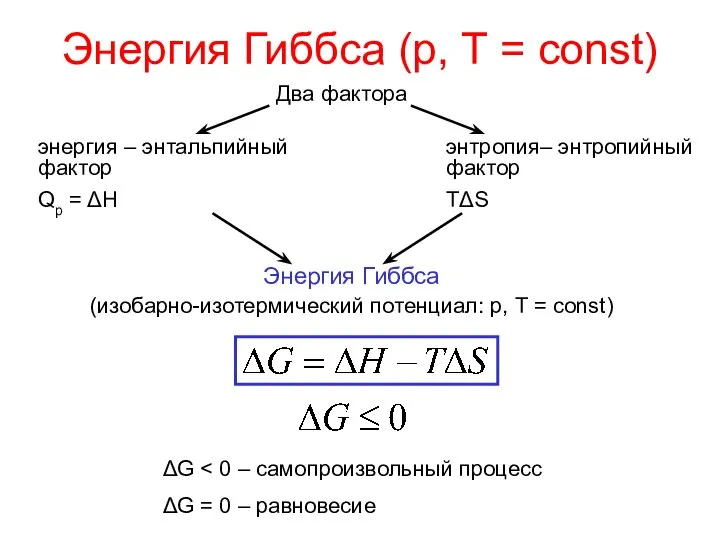
- 25. Энергия Гиббса (р, Т = const) Два фактора энергия – энтальпийный фактор Qp = ΔH энтропия–
- 26. II закон т.д. для химических процессов ΔH 0 – самопроизвольный процесс. 2С(тв.) + О2(г) = 2СО(г)
- 28. Скачать презентацию













 Динамические задачи. Сопротивление материалов
Динамические задачи. Сопротивление материалов Alexei Smertin. Football player Midfield the captain of the Russian national team
Alexei Smertin. Football player Midfield the captain of the Russian national team подготовила учитель начальных классов МАОУ Ильинской СОШ Домодедовского района Белозёрова Татьяна Владимировна
подготовила учитель начальных классов МАОУ Ильинской СОШ Домодедовского района Белозёрова Татьяна Владимировна  Сучасні методи стилістичного аналізу тексту
Сучасні методи стилістичного аналізу тексту Система классификации пород собак
Система классификации пород собак Нивелирование
Нивелирование Презентация на тему Рыба и морепродукты
Презентация на тему Рыба и морепродукты Тунельно-резонансні явища. Інтерференційні ефекти та прилади
Тунельно-резонансні явища. Інтерференційні ефекти та прилади НЕРАВНОМЕРНОЕ КОДИРОВАНИЕ ДЛЯ ПОСЛЕДОВАТЕЛЬНОСТИ СООБЩЕНИЙ
НЕРАВНОМЕРНОЕ КОДИРОВАНИЕ ДЛЯ ПОСЛЕДОВАТЕЛЬНОСТИ СООБЩЕНИЙ  Алгоритм Флойда-Уоршалла
Алгоритм Флойда-Уоршалла Профессионально-прикладная физическая подготовка студентов
Профессионально-прикладная физическая подготовка студентов Страх и ненависть в платежных системах (DevConf)
Страх и ненависть в платежных системах (DevConf) Как используют твиттер в бизнесе?
Как используют твиттер в бизнесе? QNetworkAccessManager
QNetworkAccessManager Наноспутники в системе космической радиосвязи
Наноспутники в системе космической радиосвязи Организация навески Правила и необходимое снаряжение
Организация навески Правила и необходимое снаряжение Перетворення механічної енергії в електричну. Теоретичні основи електротехніки
Перетворення механічної енергії в електричну. Теоретичні основи електротехніки Проектирование свайных фундаментов
Проектирование свайных фундаментов Презентация Социология как наука об обществе, основные понятия социологии
Презентация Социология как наука об обществе, основные понятия социологии  II. Раздел. Экономическая теория. Доцент Ковальская Марика Ивановна
II. Раздел. Экономическая теория. Доцент Ковальская Марика Ивановна  Обеспечение безопасности детей в информационном пространстве
Обеспечение безопасности детей в информационном пространстве Культура общения: сотовый телефон
Культура общения: сотовый телефон Расследование преступлений против конституционных прав и свобод человека и гражданина
Расследование преступлений против конституционных прав и свобод человека и гражданина Politics: Science or Art
Politics: Science or Art Воспаление
Воспаление  Challenges to international order
Challenges to international order Смешанная республика
Смешанная республика Без названия
Без названия