Содержание
- 2. Константа равновесия через давление через концентрации CL, CM, CA, CB–концентрации растворённых веществ РL, РM, РA, CB
- 3. Закон действующих масс: Отношение произведения равновесных концентраций продуктов реакции в степенях равных стехиометрическим коэффициентам, к произведению
- 4. N2+3Н2 = 2NН3 закон действующих масс имеет вид: Кс = [NH3]2/ [N2]·[Н2]3 или Кр = Р2NH3/РN2·Р3Н2
- 5. Кр>>1 - в системе в основном продукты реакции. Кр Кр = Кс (RT)Δ ν Δν –
- 6. Связь константы равновесия и энтальпийного и энтропийного: При 298К: ΔG298= -5,71·lgКр298= -2,48·lnКр298 При любой температуре: ΔG0
- 7. Для исходных веществ: Сисх = [ ] + ΔС Сисх>[ ] Cисх – исходная концентрация -
- 8. Расчеты констант и концентраций Вариант 1. Дан процесс А(г)+2В(г)↔Д(г)+2Е(г) САисх=1моль/л СВисх=1моль/л [Д]=0,1 моль/л Кс -? [Д]
- 9. Вариант 2. Дан процесс А(г)+2В(г)↔Д(г)+2Е(г) СВисх=1моль/л; [Д] = 0,1 моль/л; Кс = 7*10-3 САисх.-? [Д] [Е]2
- 10. Вариант 3. Дан процесс А(г)+2В(г)↔Д(г)+2Е(г) САисх=1моль/л; СВисх=1моль/л; Кр=7·10-3 Найти [ ] реагирующих веществ. [Д] [Е]2 Кс
- 11. Принцип Ле Шателье если на систему, находящуюся в состоянии равновесия, оказывается внешнее воздействие, то равновесие смещается
- 12. Влияние температуры. При ↑ Т→эндотермического процесса (ΔН>0). При ↓ Т→экзотермического процесса (ΔН Влияние изменения концентраций. При
- 13. СН4 + 2Н2О = СО2 + 4Н2; ΔН >0 ↑Спрод. р-ции, ↓ С исх. в-в, ↓
- 14. Химическое равновесие в гетерогенных процессах В уравнение константы гетерогенного химического равновесия не входят никакие члены, относящиеся
- 15. Транспортные химические реакции Равновесные гетерогенные химические реакций, сопровождающихся переносом исходного твердого или жидкого вещества из одной
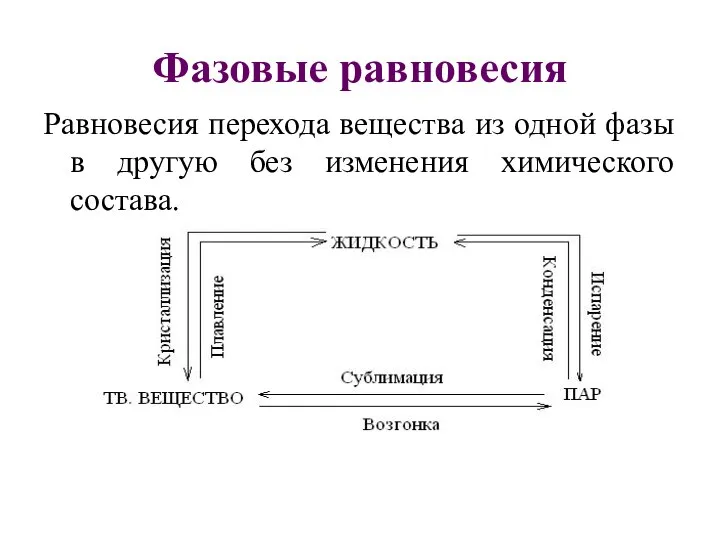
- 16. Фазовые равновесия Равновесия перехода вещества из одной фазы в другую без изменения химического состава.
- 17. Степенями свободы равновесной системы называют те параметры, которые можно произвольно менять, не затрагивая числа и природы
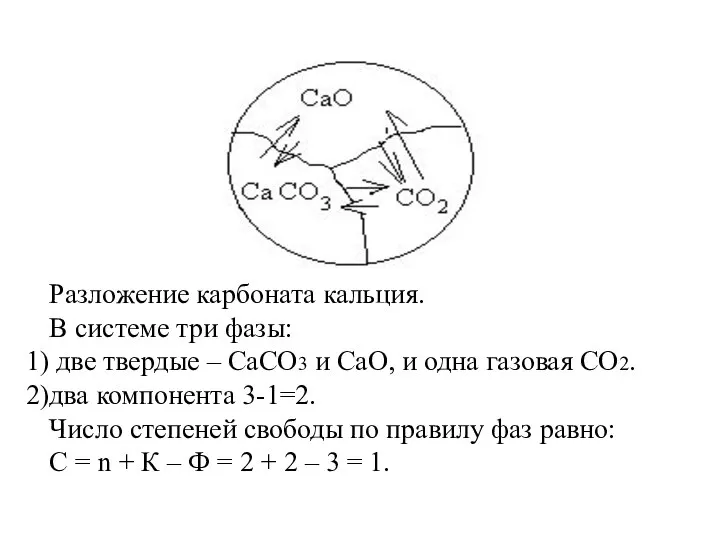
- 18. Разложение карбоната кальция. В системе три фазы: две твердые – СаСО3 и СаО, и одна газовая
- 19. Однокомпонентные системы Правило фаз имеет вид: С = 3 – Ф Однофазная система имеет две степени
- 20. Диаграммы, по которым можно определить условия устойчивости фаз и фазового равновесия, называются фазовыми диаграммами или диаграммами
- 22. Скачать презентацию


![N2+3Н2 = 2NН3 закон действующих масс имеет вид: Кс = [NH3]2/](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294715/slide-3.jpg)


![Для исходных веществ: Сисх = [ ] + ΔС Сисх>[ ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294715/slide-6.jpg)

![Вариант 2. Дан процесс А(г)+2В(г)↔Д(г)+2Е(г) СВисх=1моль/л; [Д] = 0,1 моль/л; Кс](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294715/slide-8.jpg)
![Вариант 3. Дан процесс А(г)+2В(г)↔Д(г)+2Е(г) САисх=1моль/л; СВисх=1моль/л; Кр=7·10-3 Найти [ ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294715/slide-9.jpg)








 Презентация "Булгаков Михаил" - скачать презентации по МХК
Презентация "Булгаков Михаил" - скачать презентации по МХК Причины коррупции в сфере государственной службы
Причины коррупции в сфере государственной службы Заболевания наружного уха, острый средний отит, мастоидит
Заболевания наружного уха, острый средний отит, мастоидит  Niedersachsen
Niedersachsen Искусство Древнего Китая
Искусство Древнего Китая Россия в XVII веке. Образование, наука и общественное мнение
Россия в XVII веке. Образование, наука и общественное мнение Презентация Структура денежно-кредитного рынка
Презентация Структура денежно-кредитного рынка Электронная почта
Электронная почта Повторение условного оператора
Повторение условного оператора Монументально-декоративное искусство Японии
Монументально-декоративное искусство Японии Беларусь і праблемы міжнароднай бяспекі ў 2000-х гг. Пагрозы
Беларусь і праблемы міжнароднай бяспекі ў 2000-х гг. Пагрозы Доклад на тему: «Педагогика и психология.» Выполнила: Студентка 1 курса 11 группы Сегень Екатерина Руководитель: Москалёва О
Доклад на тему: «Педагогика и психология.» Выполнила: Студентка 1 курса 11 группы Сегень Екатерина Руководитель: Москалёва О Дроссели и трансформаторы источников питания
Дроссели и трансформаторы источников питания Предложение. Эластичность предложения. Работа выполнена учителем экономики МОУ СОШ № 4 Г. Сосновый Бор Ефимовой Е.В.
Предложение. Эластичность предложения. Работа выполнена учителем экономики МОУ СОШ № 4 Г. Сосновый Бор Ефимовой Е.В.  Заполнители из природных плотных каменных пород
Заполнители из природных плотных каменных пород Физическая подготовка альпиниста
Физическая подготовка альпиниста Культура эпохи Возрождения Это,несомненно,золотой век, который вернул свет свободным искусствам.
Культура эпохи Возрождения Это,несомненно,золотой век, который вернул свет свободным искусствам. Основные направления социальной политики Вьетнама
Основные направления социальной политики Вьетнама  Бөлмелер экспликациясы
Бөлмелер экспликациясы Аттестационная работа. Методическая разработка “Датчик воды для Ардуино своими руками”
Аттестационная работа. Методическая разработка “Датчик воды для Ардуино своими руками” Внедрение игровой робототехники в образовательное пространство ОУ СПО
Внедрение игровой робототехники в образовательное пространство ОУ СПО Свадебная атрибутика славян
Свадебная атрибутика славян Обозначения условные приборов и средств автоматизации в схемах
Обозначения условные приборов и средств автоматизации в схемах Производная степенной функции
Производная степенной функции Предметные недели: нетрадиционный подход. И мы сохраним, тебя, русская речь, Великое русское слово. Анна Ахматова.
Предметные недели: нетрадиционный подход. И мы сохраним, тебя, русская речь, Великое русское слово. Анна Ахматова. Схемо- и системотехника электронных средств
Схемо- и системотехника электронных средств Легенда о Святом Валентине. День Святого Валентина в разных странах
Легенда о Святом Валентине. День Святого Валентина в разных странах Организационно-функциональная структура государственного управления в Республике Казахстан
Организационно-функциональная структура государственного управления в Республике Казахстан