Содержание
- 2. Порядок разряжения ионов на электродах при электролизе водных растворов На катоде: если Еме > Ен2, то
- 3. На аноде: Электрод инертный (нерастворимый - золото, платина, графит). 1) окисляются бескислородные кислотные остатки (С1-, S2-
- 4. Пример: Электролиз водных растворов КС1 и К2SО4 с нерастворимым анодом: А) К2SO4↔2К+ + SО42- НОН↔Н+ +
- 5. Электролиз расплава На катоде: Меn+ + nе = Ме0 На аноде: Электрод инертный (нерастворимый - золото,
- 6. Например: Электролиз расплава СаС12 на: а) инертном и б) медных электродах. А) инертные электроды: К(-) Са2+
- 7. Второй закон Фарадея : равное количество электричества выделяют при электролизе эквивалентные количества различных веществ. Выход по
- 9. Скачать презентацию
Слайд 2
Порядок разряжения ионов на электродах при электролизе водных растворов
На катоде:
если Еме
Порядок разряжения ионов на электродах при электролизе водных растворов
На катоде:
если Еме
> Ен2, то на катоде идет реакция:
Меn+ + nе = Ме0
2) если Еме<-1,67 В, то на катоде идет реакция:
2Н2О +2е = Н2 + 2ОН-
3) если -1,67 В< Еме< Ен2, то на катоде идут реакции:
Меn+ + nе = Ме0
2Н2О +2е = Н2 + 2ОН-
Меn+ + nе = Ме0
2) если Еме<-1,67 В, то на катоде идет реакция:
2Н2О +2е = Н2 + 2ОН-
3) если -1,67 В< Еме< Ен2, то на катоде идут реакции:
Меn+ + nе = Ме0
2Н2О +2е = Н2 + 2ОН-
Слайд 3
На аноде:
Электрод инертный
(нерастворимый - золото, платина, графит).
1) окисляются бескислородные кислотные
На аноде:
Электрод инертный
(нерастворимый - золото, платина, графит).
1) окисляются бескислородные кислотные
остатки (С1-, S2- и др.)
2) кислород из воды: 2Н2О –4е = 4Н+ + О2
Кислородсодержащие кислотные остатки (SO42- NO3- и др.). в растворах не окисляются
Электрод растворимый (металлический).
если Е анода<Е он- или Е других анионов в растворе:
происходит растворение анода
2) если Е анода ≈ Е он- или Е других анионов в растворе:
Идет и растворение анода и разряд имеющихся анионов.
2) кислород из воды: 2Н2О –4е = 4Н+ + О2
Кислородсодержащие кислотные остатки (SO42- NO3- и др.). в растворах не окисляются
Электрод растворимый (металлический).
если Е анода<Е он- или Е других анионов в растворе:
происходит растворение анода
2) если Е анода ≈ Е он- или Е других анионов в растворе:
Идет и растворение анода и разряд имеющихся анионов.
Слайд 4
Пример: Электролиз водных растворов КС1 и К2SО4 с нерастворимым анодом:
А) К2SO4↔2К+
Пример: Электролиз водных растворов КС1 и К2SО4 с нерастворимым анодом:
А) К2SO4↔2К+
+ SО42- НОН↔Н+ + ОН-
Ек+/к = -2,925В < Ен+/н2, на катоде выделяется водород
К(-) 2Н2О +2е = Н2 + 2ОН-|2
На аноде выделяется кислород, т.к. эта соль кислородсодержащей кислотой. А(+) 2Н2О –4е = 4Н+ + О2|1
------------------------------------------------------------------------------
4Н2О + 2Н2О = 2Н2 + 4ОН- + 4Н+ + О2
2К2SO4 + 6 Н2О = 2Н2 + 4КОН + 2Н2SО4 + О2
Б) КС1 ↔ К+ + С1- НОН↔Н+ + ОН-.
Ек+/к = -2,925В < Ен+/н2, на катоде выделяется водород
К(-) 2Н2О +2е = Н2 + 2ОН-|1
На аноде окисляется ион хлора, т.к. эта соль бескислородной кислотой. А(+) 2С1- -2е = С12|1
------------------------------------------------------------------------------
2Н2О + 2С1- = Н2 + 2ОН-+ С12
2КС1 + 2Н2О = 2КОН + Н2 + С12
Ек+/к = -2,925В < Ен+/н2, на катоде выделяется водород
К(-) 2Н2О +2е = Н2 + 2ОН-|2
На аноде выделяется кислород, т.к. эта соль кислородсодержащей кислотой. А(+) 2Н2О –4е = 4Н+ + О2|1
------------------------------------------------------------------------------
4Н2О + 2Н2О = 2Н2 + 4ОН- + 4Н+ + О2
2К2SO4 + 6 Н2О = 2Н2 + 4КОН + 2Н2SО4 + О2
Б) КС1 ↔ К+ + С1- НОН↔Н+ + ОН-.
Ек+/к = -2,925В < Ен+/н2, на катоде выделяется водород
К(-) 2Н2О +2е = Н2 + 2ОН-|1
На аноде окисляется ион хлора, т.к. эта соль бескислородной кислотой. А(+) 2С1- -2е = С12|1
------------------------------------------------------------------------------
2Н2О + 2С1- = Н2 + 2ОН-+ С12
2КС1 + 2Н2О = 2КОН + Н2 + С12
Слайд 5
Электролиз расплава
На катоде:
Меn+ + nе = Ме0
На аноде:
Электрод инертный
(нерастворимый
Электролиз расплава
На катоде:
Меn+ + nе = Ме0
На аноде:
Электрод инертный
(нерастворимый
- золото, платина, графит).
окисляются кислотные остатки
Электрод растворимый (металлический).
если Еанода<Еаниона в растворе:
происходит растворение анода
2) если Еанода ≈ Еаниона в растворе:
Идет и растворение анода и разряд имеющихся анионов
окисляются кислотные остатки
Электрод растворимый (металлический).
если Еанода<Еаниона в растворе:
происходит растворение анода
2) если Еанода ≈ Еаниона в растворе:
Идет и растворение анода и разряд имеющихся анионов
Слайд 6
Например: Электролиз расплава СаС12 на:
а) инертном и б) медных электродах.
А)
Например: Электролиз расплава СаС12 на:
а) инертном и б) медных электродах.
А)
инертные электроды: К(-) Са2+ + 2е = Са0
А(+) 2С1- - 2е = С120
Б) медный анод –растворимый: К (-) Са2+ + 2е = Са0
А (+) 2С1- - 2е = С120
(+) Сu0 –2е = Сu2+
Первый закон Фарадея: Массы веществ, выделившихся на катоде и аноде (или образовавшихся в катодном или анодном пространстве), пропорциональны количеству прошедшего через раствор или расплав электричества: m =kQ
k – электрохимический эквивалент:
k = Мэ/F, Q = It.
F число Фарадея (96485 Кл ≈ 96500Кл)
А(+) 2С1- - 2е = С120
Б) медный анод –растворимый: К (-) Са2+ + 2е = Са0
А (+) 2С1- - 2е = С120
(+) Сu0 –2е = Сu2+
Первый закон Фарадея: Массы веществ, выделившихся на катоде и аноде (или образовавшихся в катодном или анодном пространстве), пропорциональны количеству прошедшего через раствор или расплав электричества: m =kQ
k – электрохимический эквивалент:
k = Мэ/F, Q = It.
F число Фарадея (96485 Кл ≈ 96500Кл)
Слайд 7
Второй закон Фарадея : равное количество электричества выделяют при электролизе эквивалентные
Второй закон Фарадея : равное количество электричества выделяют при электролизе эквивалентные
количества различных веществ.
Выход по току вещества -доля общего количества электричества (в%), которая расходуется на выделение вещества:
Вi = Qi *100 /Q
Выход по току вещества -доля общего количества электричества (в%), которая расходуется на выделение вещества:
Вi = Qi *100 /Q
- Предыдущая
Химическое равновесие Следующая -
Геохимия





 Автоматизация послеуборочной обработки зерна
Автоматизация послеуборочной обработки зерна “Безработица равна 100%, если безработный – это Вы”. Адам Смит
“Безработица равна 100%, если безработный – это Вы”. Адам Смит SkyDNS-облачный контент-фильтр
SkyDNS-облачный контент-фильтр Виды работ при построении триангуляции
Виды работ при построении триангуляции  Этапы разработки технического задания
Этапы разработки технического задания Авторитет и лидерство. Формы власти и влияния, стили руководства
Авторитет и лидерство. Формы власти и влияния, стили руководства Генетика и медицина О разрешите мне загадку жизни, Мучительно старинную загадку… Скажите, что такое человек. Г.Гейне Наши врачи должны, как азбуку, знать законы наследственности. И.П. Павлов
Генетика и медицина О разрешите мне загадку жизни, Мучительно старинную загадку… Скажите, что такое человек. Г.Гейне Наши врачи должны, как азбуку, знать законы наследственности. И.П. Павлов Уроки рисования пастелью
Уроки рисования пастелью Место игры в применяемых педагогических образовательных технологиях и ее влияние на укрепление здоровья детей
Место игры в применяемых педагогических образовательных технологиях и ее влияние на укрепление здоровья детей Всички плодове и зеленчуци си имат цвят. Едни са жълти, други зелени, червени, лилави оранжеви. - презентация
Всички плодове и зеленчуци си имат цвят. Едни са жълти, други зелени, червени, лилави оранжеви. - презентация Презентация Роль таможенно-тарифного регулирования в обеспечении экономической безопасности страны
Презентация Роль таможенно-тарифного регулирования в обеспечении экономической безопасности страны  Методы физической культуры
Методы физической культуры Дифференциальные уравнения Однородные дифференциальные уравнения Линейные дифференциальные уравнения Уравнения Бернулли
Дифференциальные уравнения Однородные дифференциальные уравнения Линейные дифференциальные уравнения Уравнения Бернулли Обменное взаимодействие. Симметрия координатных и спиновых функций
Обменное взаимодействие. Симметрия координатных и спиновых функций  Организация и проведение криминологического исследования
Организация и проведение криминологического исследования РЕШЕНИЕ НЕРАВЕНСТВ С ОДНИМ НЕИЗВЕСТНЫМ
РЕШЕНИЕ НЕРАВЕНСТВ С ОДНИМ НЕИЗВЕСТНЫМ  Выйдя на улицу, юный пешеход должен вежливо передвигаться только по тротуару или обочине! - презентация
Выйдя на улицу, юный пешеход должен вежливо передвигаться только по тротуару или обочине! - презентация Отраслевые информационные центры
Отраслевые информационные центры Публикация материалов на сервисе Calaméo © Збицкая Наталья Юрьевна, учитель математики МОУ «Средняя школа №13» г. Балаково Саратовской области
Публикация материалов на сервисе Calaméo © Збицкая Наталья Юрьевна, учитель математики МОУ «Средняя школа №13» г. Балаково Саратовской области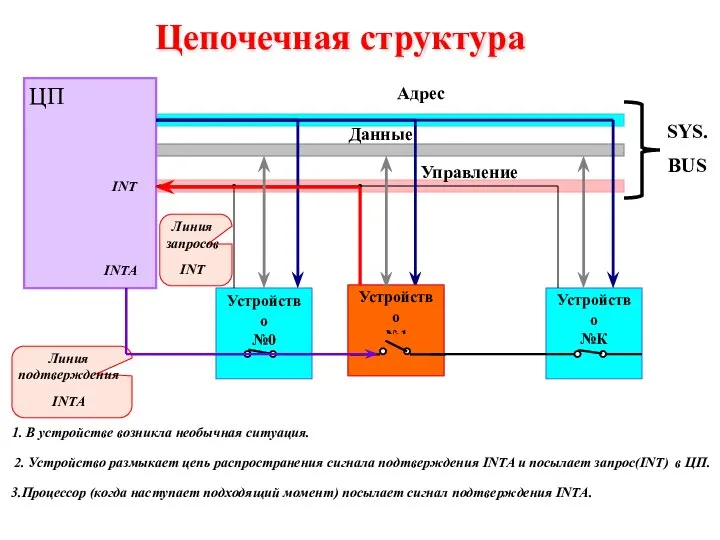 Цепочечная структура
Цепочечная структура Рейтинговая система оценивания достижений учащихся (материалы к выступлению на методическом семинаре) Выполнила зам.директора
Рейтинговая система оценивания достижений учащихся (материалы к выступлению на методическом семинаре) Выполнила зам.директора  Монтаж конструкций
Монтаж конструкций Права и свободы человека и гражданина РФ
Права и свободы человека и гражданина РФ Средства и методы физического воспитания
Средства и методы физического воспитания American versus British English
American versus British English Пример воздействия агрессивной среды на неметаллические конструкции
Пример воздействия агрессивной среды на неметаллические конструкции Презентация Актуальные вопросы административной ответственности за нарушение таможенных правил
Презентация Актуальные вопросы административной ответственности за нарушение таможенных правил  Презентация "Кредитный брокер - для физических лиц" - скачать презентации по Экономике
Презентация "Кредитный брокер - для физических лиц" - скачать презентации по Экономике