Содержание
- 3. Модель идеального газа Использую предположения: а) молекулы газа занимают малую долю объёма; б) молекулы газа не
- 4. Законы идеальных газов Закон Авогадро: Равные объемы газов при одинаковой температуре и давлении содержат одинаковое число
- 5. Реальные газы Существуют отклонения от газовых законов. Они растут с увеличением давления и понижением температуры. Причины
- 6. Плазма При температурах 104К и выше) образуется плазма. Газ содержит катионы и электроны за счет диссоциации
- 7. Жидкое состояние. Жидкое и твёрдое состояние –это конденсированное состояние вещества. 1) Молекулы находятся ближе друг к
- 8. Молекулярно-кинетическая теория строения жидкости. В жидкости присутствует «ближний порядк»: в среднем по времени ближайшие друг к
- 9. Частицы с высокой энергией, могут вырываться из жидкости и переходить в газообразное состояние - испарение. Склонность
- 10. Текучесть - направленное перемещение отдельных частиц жидкости (флуктуация её плотности) под действием внешних сил (например, силы
- 11. Силы межмолекулярного взаимодействия молекул, находящиеся на поверхности, не уравновешены. Результирующая сила взаимодействия поверхностных молекул направлена вглубь
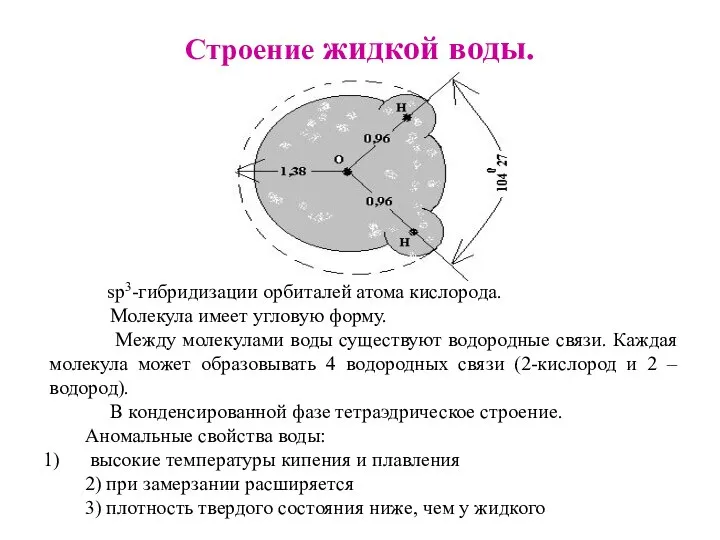
- 12. Строение жидкой воды. sр3-гибридизации орбиталей атома кислорода. Молекула имеет угловую форму. Между молекулами воды существуют водородные
- 13. Твердое состояние При охлаждении жидкости снижается кинетическая энергия частиц. Частицы утрачивают поступательное движение и только колеблются
- 14. Аморфное состояние. Не имеют упорядоченной структуры. Наблюдается «ближний» порядок. 3) Медленно текут. 4) Изотропны - имеют
- 15. Кристаллическое состояние 1) частицы расположены регулярно 2) имеется «дальний» порядок. 3) Плавятся при определенной температуре. Из
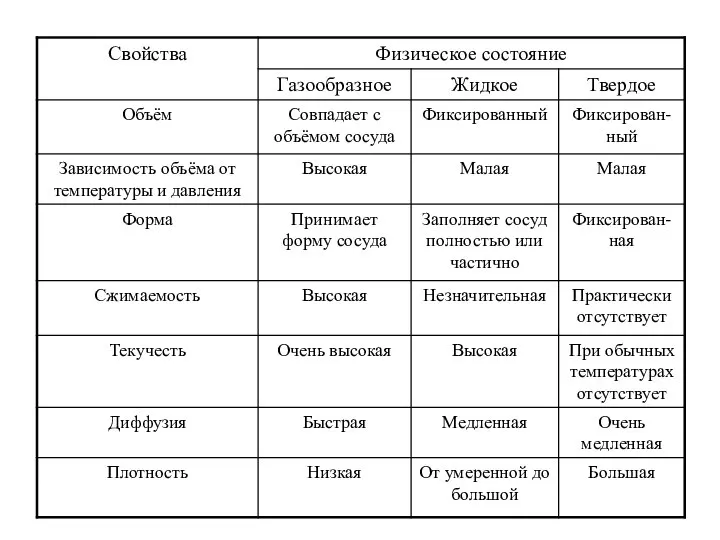
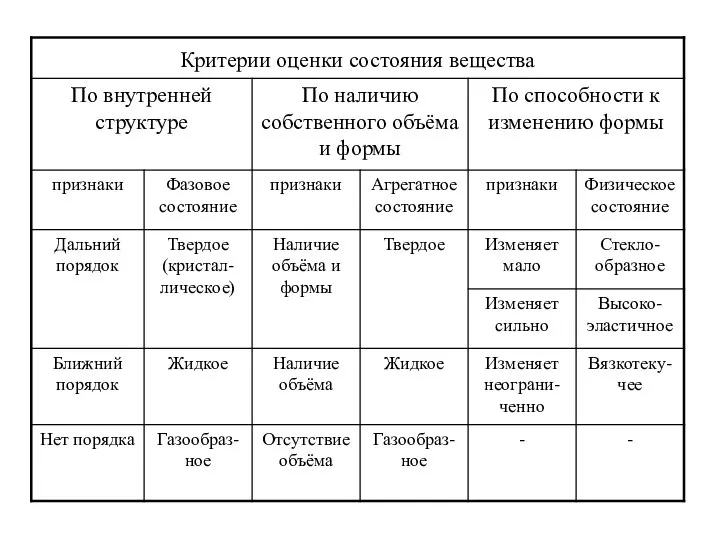
- 16. Различают агрегатное и фазовое состояния вещества. Агрегатное состояние вещества – определяется способностью его образца сохранять собственный
- 18. Мезомерное состояние Мезоморфное состояние промежуточное между твердым и жидким состоянием. Образуют вещества, состоящие из цепных молекул.
- 19. Различают: термотропные (плавление кристалла) и лиотропные (растворение вещества). По структуре жидкие кристаллы бывают: а) нематические (нить)
- 20. Характеристики кристаллов Координационное число - число частиц, непосредственно примыкающих у данной частице в кристалле. Чем больше
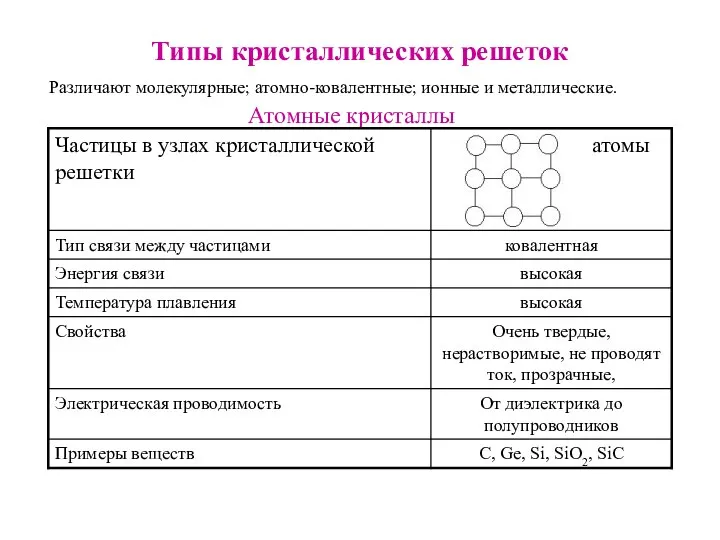
- 21. Типы кристаллических решеток Различают молекулярные; атомно-ковалентные; ионные и металлические. Атомные кристаллы
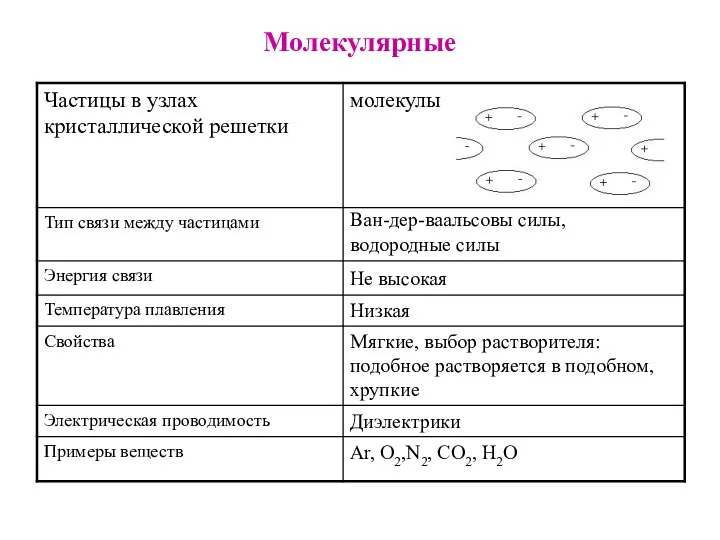
- 22. Молекулярные
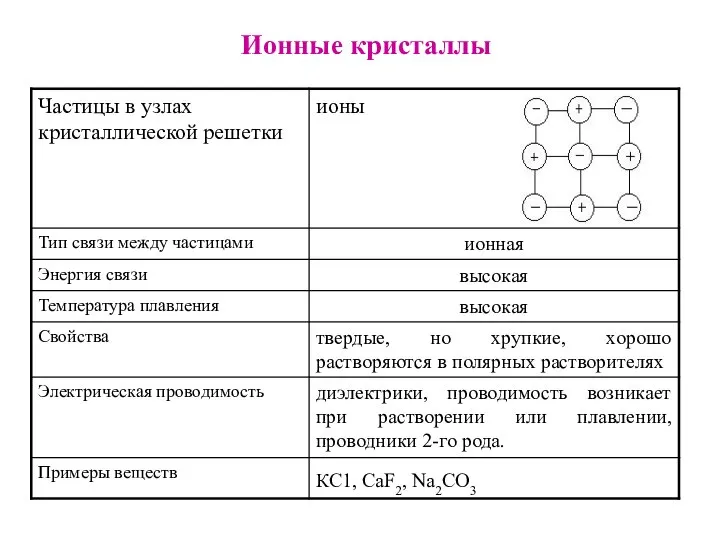
- 23. Ионные кристаллы
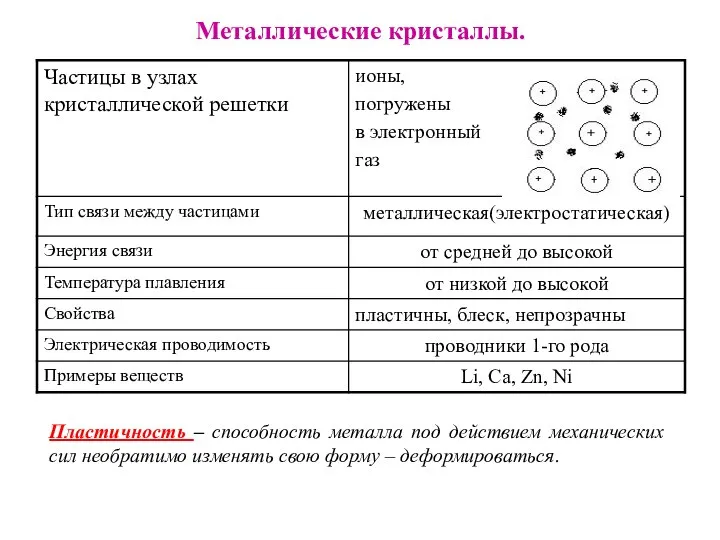
- 24. Металлические кристаллы. Пластичность – способность металла под действием механических сил необратимо изменять свою форму – деформироваться.
- 25. Кристаллы со смешанными связями Определенный вид химической связи в чистом виде в кристаллах встречается редко. Обычно
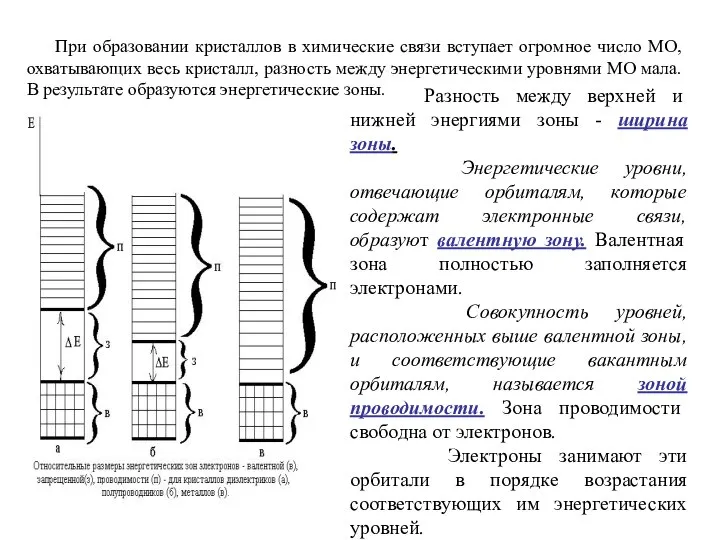
- 26. Зонная теория кристаллов В кристалле число МО равно сумме АО отдельных атомов. Если учитывать только внешние
- 27. При образовании кристаллов в химические связи вступает огромное число МО, охватывающих весь кристалл, разность между энергетическими
- 28. Из-за близости энергетических уровней электроны способны переходить с уровня на уровень, осуществляя между атомами нелокализованные связи.
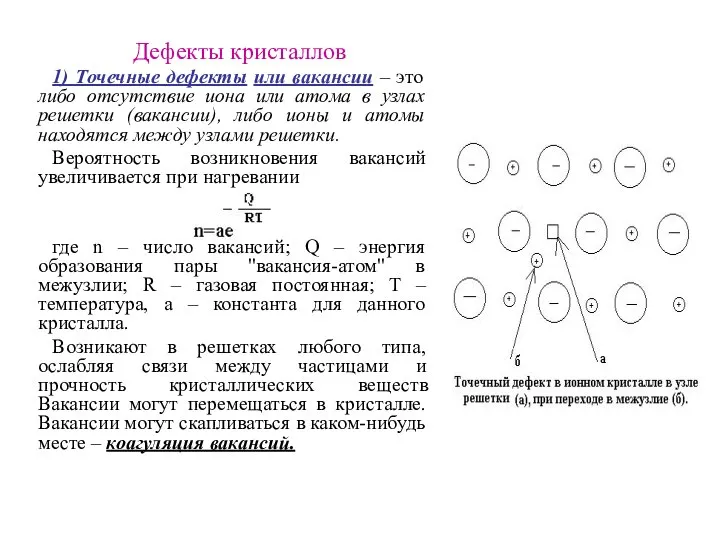
- 29. Дефекты кристаллов 1) Точечные дефекты или вакансии – это либо отсутствие иона или атома в узлах
- 30. Причины точечных дефектов: 1) тепловое движение частиц, Частицы, с высокими энергиями, вырываются из состояния равновесия (узла
- 31. 2) Линейные дефекты или дислокация –это нарушение идеального расположения групп частиц, которые можно расположить вдоль воображаемой
- 32. Кристаллы переменного состава. При образовании вакансии химический состав твердых тел изменяются. Например, TiO стабильно существeует при
- 34. Скачать презентацию






















 Культура 16 века
Культура 16 века Мозговое кровообращение
Мозговое кровообращение  Презентация "Поэзия повседневной жизни в искусстве разных народов" - скачать презентации по МХК
Презентация "Поэзия повседневной жизни в искусстве разных народов" - скачать презентации по МХК Синяя птица России. Гжель
Синяя птица России. Гжель Componente şi circuite electronice pasive - CCEP
Componente şi circuite electronice pasive - CCEP История иконы Блаженной Матроны Московской
История иконы Блаженной Матроны Московской Будда мүсіндері және храмдары
Будда мүсіндері және храмдары Аутоиммунный гепатит (АИГ)
Аутоиммунный гепатит (АИГ) Железобетонные тонкостенные пространственные конструкции покрытий
Железобетонные тонкостенные пространственные конструкции покрытий ОБЪЕДИНЕНИЕ РУССКИХ ЗЕМЕЛЬ ВОКРУГ МОСКВЫ (XIV—XVI) План. 1. Причины образования единого государства. 2. Усиление Московского кня
ОБЪЕДИНЕНИЕ РУССКИХ ЗЕМЕЛЬ ВОКРУГ МОСКВЫ (XIV—XVI) План. 1. Причины образования единого государства. 2. Усиление Московского кня ОСОБЕННОСТИ ОЦЕНКИ ФИНАНСОВЫХ ВЛОЖЕНИЙ
ОСОБЕННОСТИ ОЦЕНКИ ФИНАНСОВЫХ ВЛОЖЕНИЙ Охрана и управление геологической средой
Охрана и управление геологической средой  Анатомия и физиология органа зрения
Анатомия и физиология органа зрения Беріліс механизмдерді графикалық әдіспен кинематикалық талдау
Беріліс механизмдерді графикалық әдіспен кинематикалық талдау Правила гри в баскетбол
Правила гри в баскетбол Ангелы у престола
Ангелы у престола Функциональная модель коммуникации по Р.О. Якобсону
Функциональная модель коммуникации по Р.О. Якобсону Избирательные системы. Политические партии. Политические элиты
Избирательные системы. Политические партии. Политические элиты Электронная почта
Электронная почта Thanksgiving Traditions
Thanksgiving Traditions Природа России Автор: Зудина Н.Ф. ГОУ СОШ №337 г. Санкт-Петербург учитель начальных классов Урок по предмету «Окружа
Природа России Автор: Зудина Н.Ф. ГОУ СОШ №337 г. Санкт-Петербург учитель начальных классов Урок по предмету «Окружа Работа, мощность, механическая энергия
Работа, мощность, механическая энергия Alfresco ECM (Enterprise Content Management)
Alfresco ECM (Enterprise Content Management) Субъекты управления
Субъекты управления  ПРОГРАММА РАЗВИТИЯ ШКОЛЫ В ЛОГИКЕ НАЦИОНАЛЬНОЙ ОБРАЗОВАТЕЛЬНОЙ ИНИЦИАТИВЫ «НАША НОВАЯ ШКОЛА» РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ ПЕДАГ
ПРОГРАММА РАЗВИТИЯ ШКОЛЫ В ЛОГИКЕ НАЦИОНАЛЬНОЙ ОБРАЗОВАТЕЛЬНОЙ ИНИЦИАТИВЫ «НАША НОВАЯ ШКОЛА» РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ ПЕДАГ Зеркальце - презентация для начальной школы
Зеркальце - презентация для начальной школы История возникновения языка программирования Паскаль (Pascal)
История возникновения языка программирования Паскаль (Pascal) Тема 1.5 Світовий ринок праці. Міжнародна трудова міграція. Сутність і види міжнародної трудової міграції. Особливості формува
Тема 1.5 Світовий ринок праці. Міжнародна трудова міграція. Сутність і види міжнародної трудової міграції. Особливості формува