Содержание
- 2. Белки – биологические полимерные молекулы, мономерами которых являются аминокислоты, соединенные пептидными связями. Индивидуальность белковых молекул определяется
- 3. Содержание белков в тканях, % Животные Организм – 18-21 Мышцы – 19-23 Печень – 18-19 Почки
- 4. Элементарный состав белков, % Углерод – 49-55 Кислород – 21-23 Азот – 16 Водород – 6-8
- 5. Молекулярная масса (округленная) некоторых белков : Инсулин - 5 000 Рибонуклеаза - 13 000 Миоглобин –
- 6. Количество аминокислотных остатков Инсулин - 51 (21+30) Рибонуклеаза -130 Миоглобин – 170 Яичный альбумин – 440
- 7. Первичная структура проинсулина человека:
- 8. КЛАССИФИКАЦИЯ БЕЛКОВ:
- 9. Сложные белки 1) хромопротеины 2) нуклеопротеины 3) липопротеины 4) фосфоропротеины 5) гликопротеины 6) металлопротеины
- 10. Простые белки – протеины Состоят только из аминокислот 1) гистоны 2) протамины 3) проламины 4) глютелины
- 11. Белки, входящие в состав хроматина. У животных выделяют 5 главных типов: Н1, Н2a, H2b, H3, H4
- 12. Протамины Молек. масса – 5 кДа ИЭТ (рI) – рН 9,0 - 12,0 На 60 –
- 13. Проламины Белки зерен злаков. Молек.масса – 28 - 50 кДа. ИЭТ (рI) – рН 4 -
- 14. Глютелины Белки зерен. ИЭТ (рI) - 6 - 8 Содержание пролина – 10 -15%, глютаминовой кислоты
- 15. Молекулярная масса – 66 кДа ИЭТ (рI) – 4,7 («кислые») Содержат мало глицина, но много лейцина.
- 16. Молек.масса – от 100 кДа до 5 МДа ИЭТ (рI) - 5,5 - 7,3 Содержат глицина
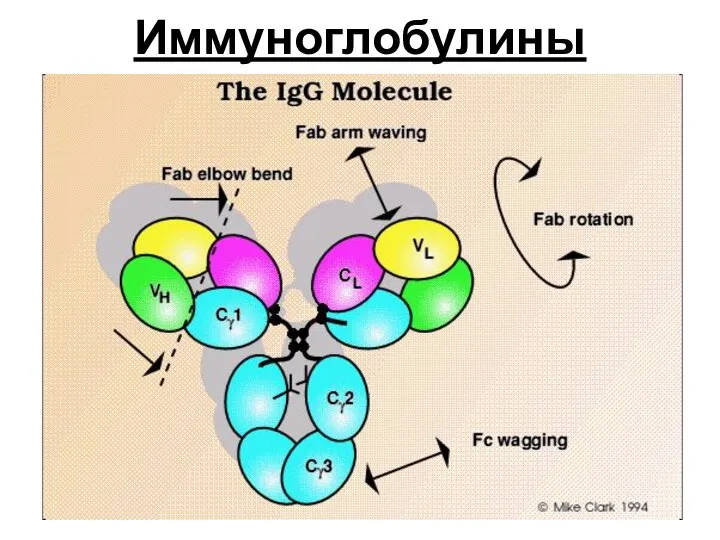
- 17. Иммуноглобулины
- 18. Фибриллярные белки опорных тканей (кости, хрящи, сухожилия, шерсть, копыта). Растворимость – нерастворимы в воде. Содержат много
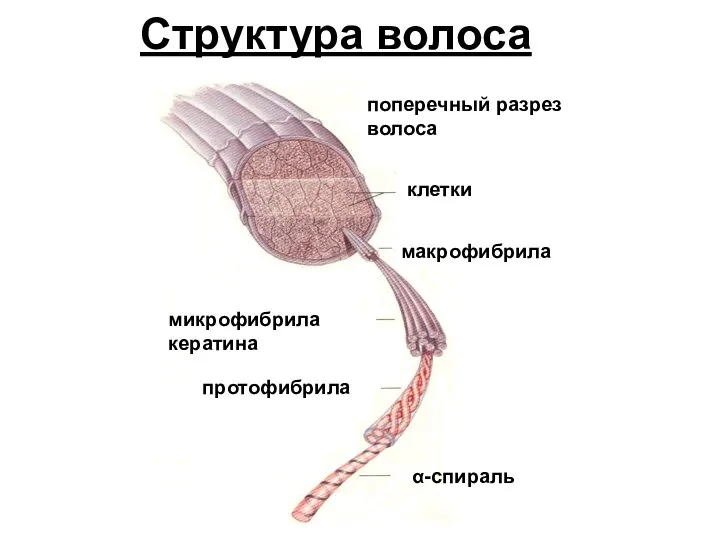
- 19. клетки поперечный разрез волоса макрофибрила микрофибрила кератина протофибрила α-спираль Структура волоса
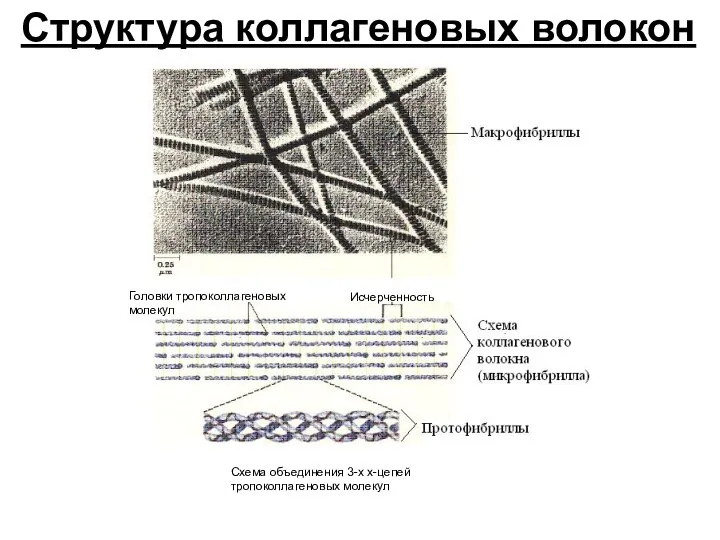
- 20. Исчерченность Головки тропоколлагеновых молекул Схема объединения 3-х х-цепей тропоколлагеновых молекул Структура коллагеновых волокон Исчерченность Головки тропоколлагеновых
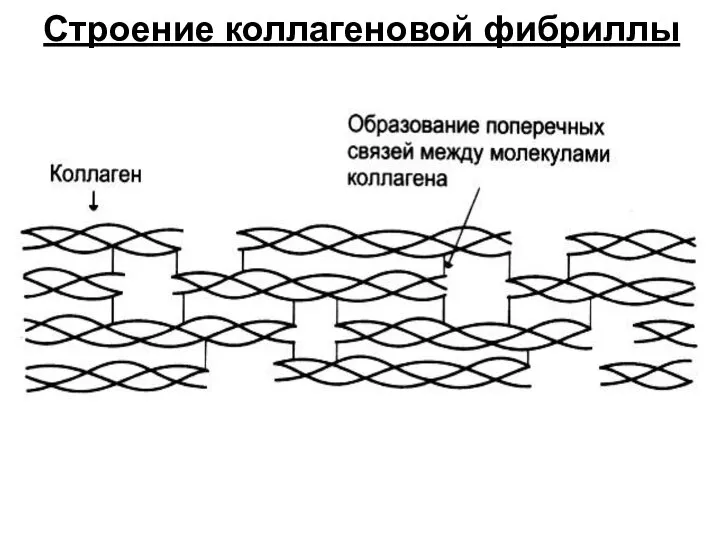
- 21. Строение коллагеновой фибриллы
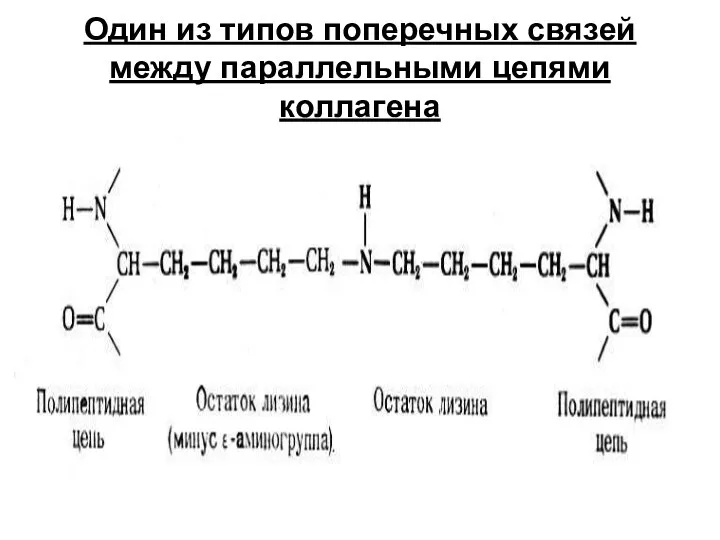
- 22. Один из типов поперечных связей между параллельными цепями коллагена
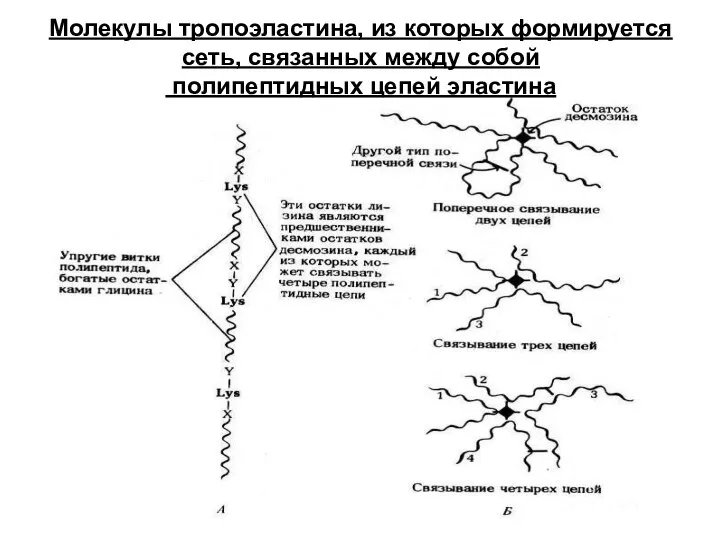
- 23. Молекулы тропоэластина, из которых формируется сеть, связанных между собой полипептидных цепей эластина
- 24. Вторичная структура и свойства фибриллярных белков
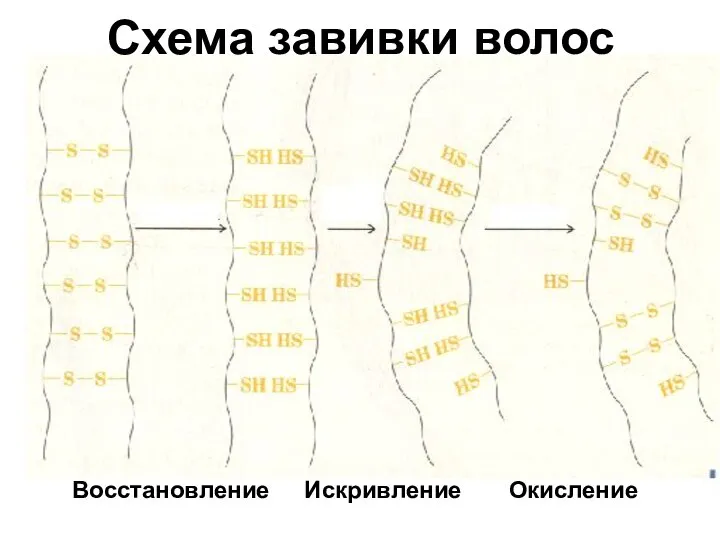
- 25. Восстановление Окисление Искривление Схема завивки волос
- 26. Сложные белки 1) хромопротеины 2) нуклеопротеины 3) липопротеины 4) фосфоропротеины 5) гликопротеины 6) металлопротеины
- 27. Сложные протеины Простой белок + небелковое вещество (простетическая группа) 1) хромопротеины (простой белок + окрашенное вещество)
- 28. Хромопротеины Небелковое вещество, обуславливающее окраску: а) гемсодержащие гемоглобин миоглобин цитохромы каталаза Пероксидаза б) флавосодержащие (вит. В2)
- 29. Гемоглобин Молек.масса – 67 - 70 кДа, из них 96 % состовляет белок и 4 %
- 30. Строение гема
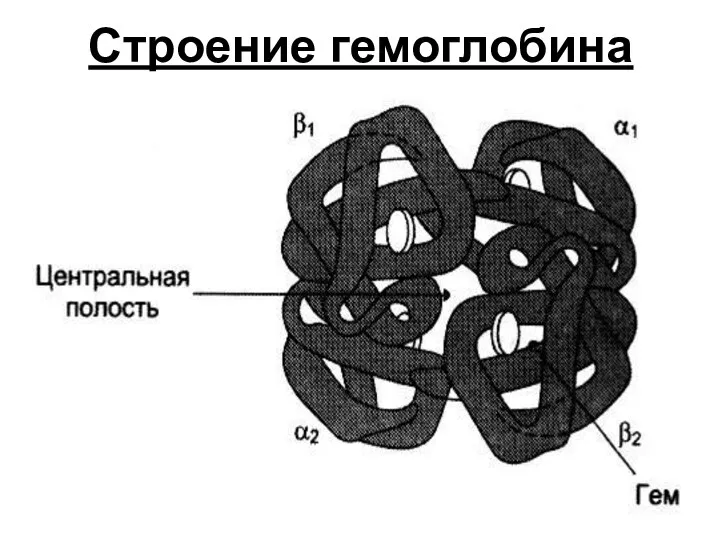
- 31. Строение гемоглобина
- 32. Виды гемоглобина HbО2 - оксигемоглобин (Fe2+) HbСО2 - карбгемоглобин (Fe2+) HbСО - карбоксигемоглобин (Fe3+) HbF3+ -
- 33. Миоглобин Содержится в красных мышцах. Молек.масса - 17 кДа Содержит 153 аминокислотных остатка + ГЕМ На
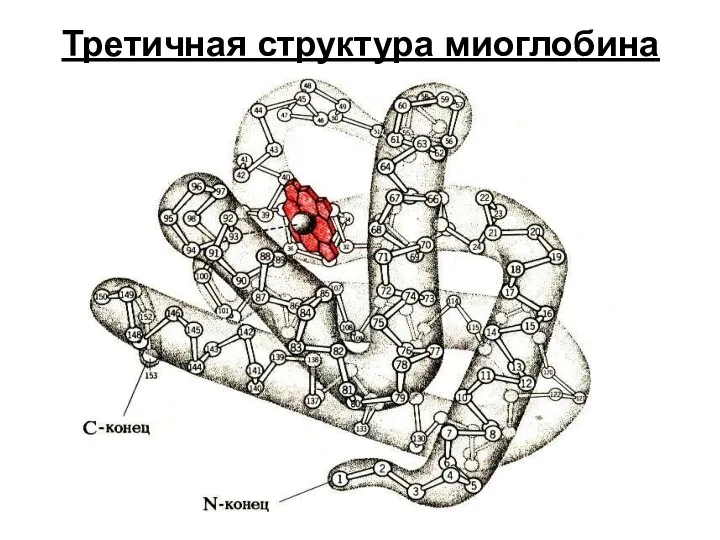
- 34. Третичная структура миоглобина
- 35. Гемсодержащие ферменты Переносчики электронов в дыхательной цепи митохондрий. Различают семейства: а, b, с, а в них
- 36. Конечный компонент дыхательной цепи. Переносит электроны на кислород. Молек.масса – 12 - 14 кДа Содержит Fe
- 37. Нуклеопротеины Протеины + Нуклеиновые кислоты гистоны негистоновые белки ДНК протамины РНК ДНП - ДезоксирибоНуклеоПротеины РНП -
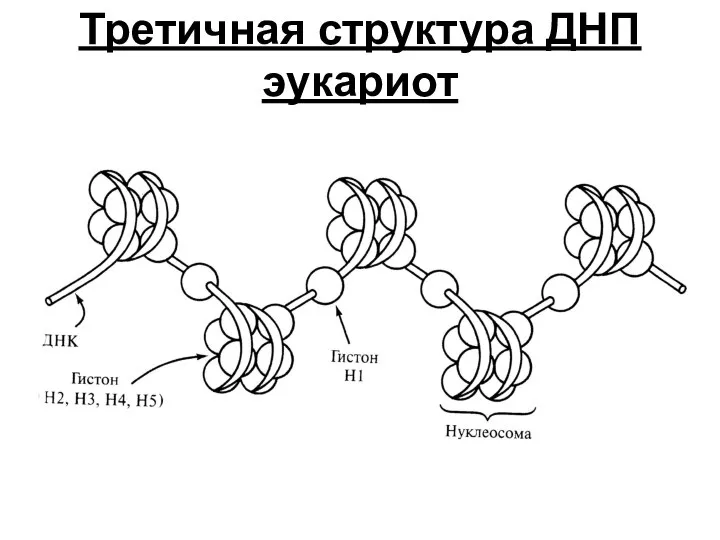
- 38. Третичная структура ДНП эукариот
- 39. Липопротеины (простой белок + липид) Липиды в водной среде (а значит, и в крови) нерастворимы, поэтому
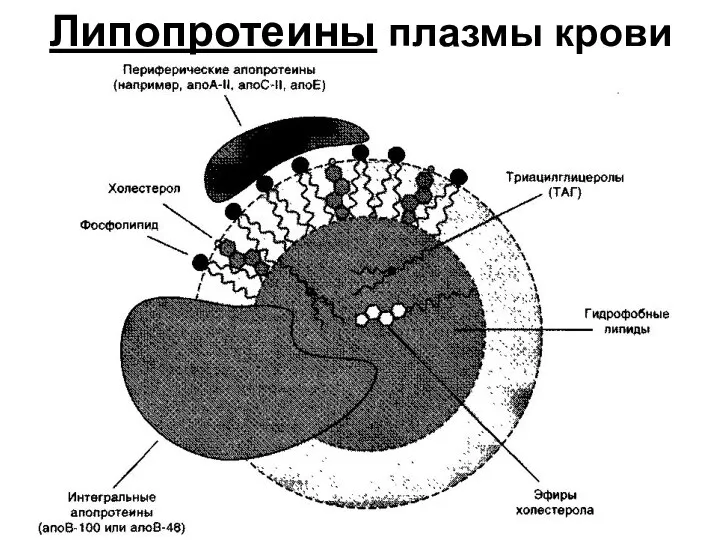
- 40. Липопротеины плазмы крови
- 41. Липопротеины В организме синтезируются следующие типы липопротеинов: хиломикроны (ХМ) липопротеины очень низкой плотности (ЛПОНП) липопротеины промежуточной
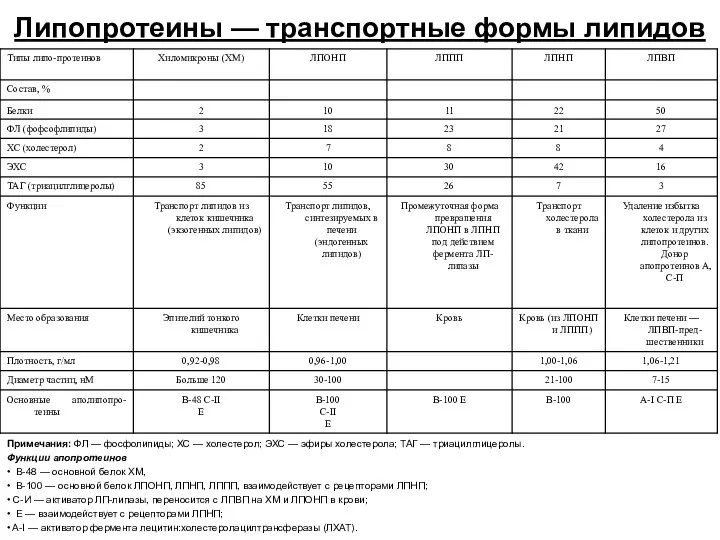
- 42. Липопротеины — транспортные формы липидов Примечания: ФЛ — фосфолипиды; ХС — холестерол; ЭХС — эфиры холестерола;
- 43. Фосфопротеины (Белок + остаток фосфорной кислоты) Представители: - Казеиноген (молока) - Ововиттелин желтка яйца - Фосвитин
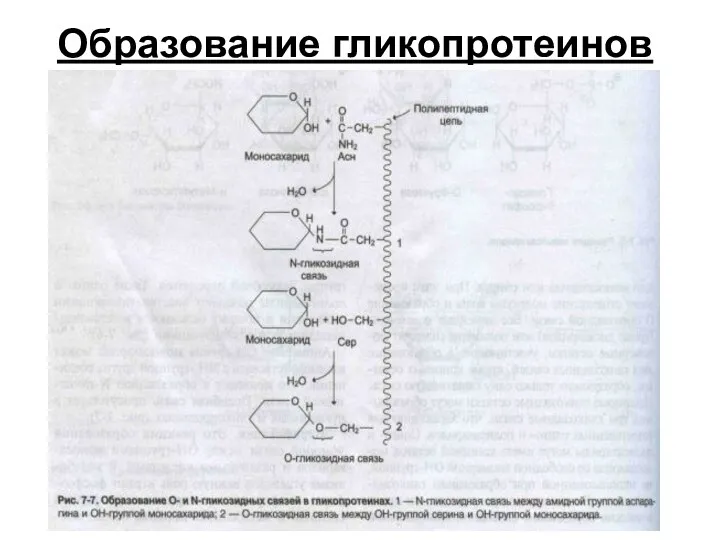
- 44. Гликопротеины (простой белок + углевод) - фибриноген (свертывание крови) - муцины (структура слизистых, предохранение их от
- 45. Функции гликопротеинов: Свертываемость – протромбин, фибриноген. Смазочные и защитные вещества – муцины, слизистые секреты. Транспорт витаминов,
- 46. Образование гликопротеинов
- 47. Протеогликаны Если белковая часть составляет меньше 50% массы молекулы, а углеводная часть больше 50% - это
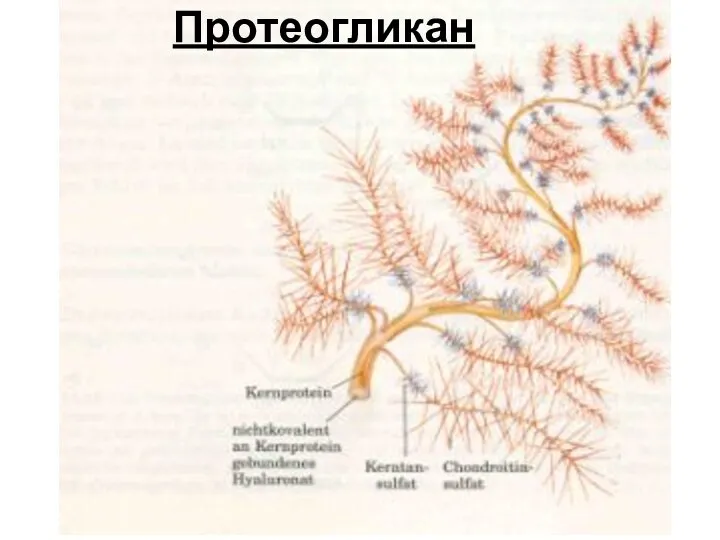
- 48. Протеогликаны Протеогликаны (мукополисахариды, гликозаминогликаны) – высокомолекулярные углеводно-белковые соединения. Образуют основную массу межклеточного матрикса соединительной ткани. Составляют
- 49. Протеогликан
- 50. Строение экстрацеллюлярного матрикса
- 51. Металлопротеины (Белок + металл) Функции: Способ удержания и защиты от осадка. Теряют токсичность. Обеспечивают ферментативную активность.
- 53. Скачать презентацию




































 Презентация на тему "Пищевые связи" - скачать презентации по Биологии
Презентация на тему "Пищевые связи" - скачать презентации по Биологии Буроголовая гаичка – птица 2017 года. Паровозик из Синичкино
Буроголовая гаичка – птица 2017 года. Паровозик из Синичкино Почему шишки закрываются?
Почему шишки закрываются? Тағамның энергиялық құндылығы
Тағамның энергиялық құндылығы Введение в курс Общей биологии. Часть 4
Введение в курс Общей биологии. Часть 4 Полушария большого мозга
Полушария большого мозга Презентация на тему Удобрения
Презентация на тему Удобрения Подснежник
Подснежник Семейство Злаки Обширное семейство злаков - одно из семейств класса однодольных. Злаки отличаются от других растений этого класса
Семейство Злаки Обширное семейство злаков - одно из семейств класса однодольных. Злаки отличаются от других растений этого класса Эволюционная парадигма
Эволюционная парадигма Внутреннее строение птицы
Внутреннее строение птицы ПЕРЕЛОМИ І ВИВИХИ. ПЕРША ДОПОМОГА ПРИ ПЕРЕЛОМАХ І ВИВИХАХ.
ПЕРЕЛОМИ І ВИВИХИ. ПЕРША ДОПОМОГА ПРИ ПЕРЕЛОМАХ І ВИВИХАХ.  Аутизм расстройства аутистического спектра Устименко Л.Н. –учитель-логопед г. Смоленск
Аутизм расстройства аутистического спектра Устименко Л.Н. –учитель-логопед г. Смоленск  Презентация на тему Семейства Крестоцветные и Паслёновые.
Презентация на тему Семейства Крестоцветные и Паслёновые. Кто живёт в земле
Кто живёт в земле Особенности высшей нервной деятельности человека. Познавательные процессы
Особенности высшей нервной деятельности человека. Познавательные процессы Эмбрион человека
Эмбрион человека Виды ежей
Виды ежей Активизация познавательной деятельности учащихся на уроках биологии
Активизация познавательной деятельности учащихся на уроках биологии Презентация на тему "ШМО" - скачать презентации по Биологии
Презентация на тему "ШМО" - скачать презентации по Биологии Турбота про потомство у тварин
Турбота про потомство у тварин Гены развития дрозофилы
Гены развития дрозофилы Грибы. Урок-соревнование
Грибы. Урок-соревнование Грибы. Царство грибов
Грибы. Царство грибов История развития животного мира
История развития животного мира Биологические ритмы. Фотопериодизм.
Биологические ритмы. Фотопериодизм.  Единство химической организации живых организмов. Углеводы
Единство химической организации живых организмов. Углеводы Функционирование популяции и динамика ее численности в природе
Функционирование популяции и динамика ее численности в природе