Содержание
- 2. Биологические функции белков. 1. Пластическая, структурная. 2. Регуляторная: а) ферменты - регуляторы химических реакций. б) гормоны
- 3. Белки-высокомолекулярные азотосодержащие органические соединения, состоящие из аминокислот, соединенных пептидной связью и имеющие сложную структурную организацию. Элементарный
- 4. Структурная единица белка - аминокислоты Белок гидролиз (кислотный) (щелочной) (ферментативный) смесь аминокислот Свойства аминокислот (АК) 1.
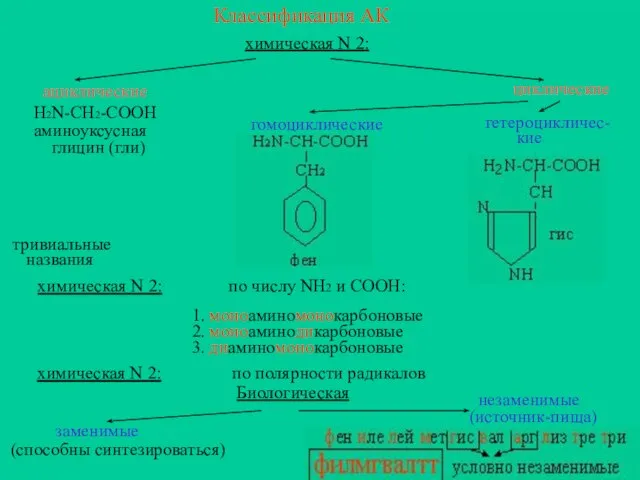
- 5. Классификация АК химическая N 2: ациклические H2N-CH2-COOH аминоуксусная глицин (гли) циклические гомоциклические гетероцикличес- кие тривиальные названия
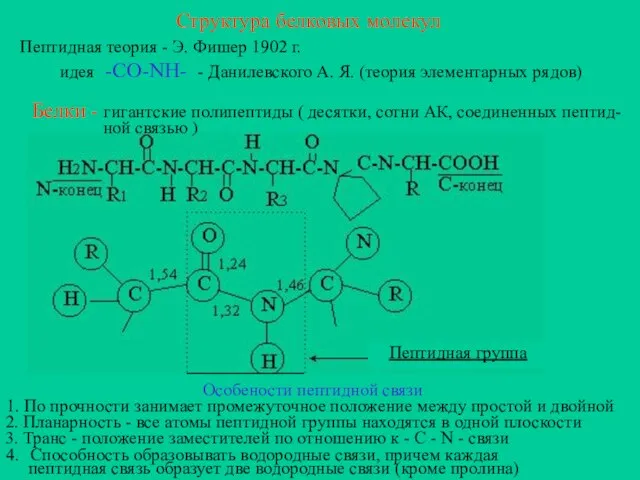
- 6. Структура белковых молекул Пептидная теория - Э. Фишер 1902 г. идея -CO-NH- - Данилевского А. Я.
- 7. Доказательства наличия пептидной связи. 1. В природных белках мало свободных СООН и NН2 групп. 2. В
- 8. Уровни организации белковой молекулы. К. Линдерстрем - Ланг (1952г) | Под первичной структурой подразумевают строго определенную
- 9. Вторичная структура По конфигурации вторичная структура спиральная (альфа-спираль право и левовращающие) слоисто-складчатая (бета-структура. кросс-бета-форма) | Вторичная
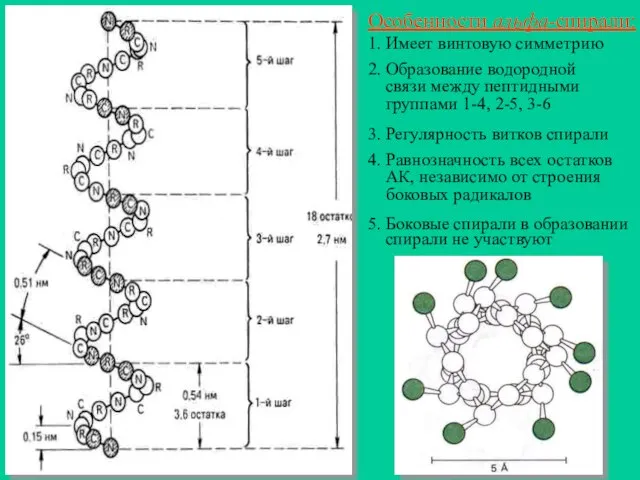
- 10. Особенности альфа-спирали: 1. Имеет винтовую симметрию 2. Образование водородной связи между пептидными группами 1-4, 2-5, 3-6
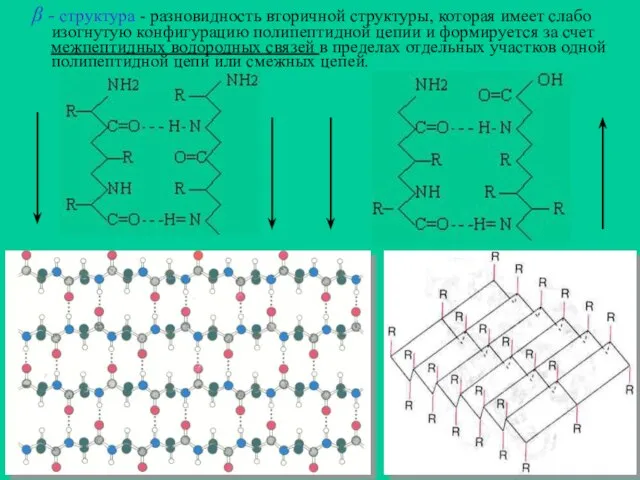
- 11. - структура - разновидность вторичной структуры, которая имеет слабо изогнутую конфигурацию полипептидной цепии и формируется за
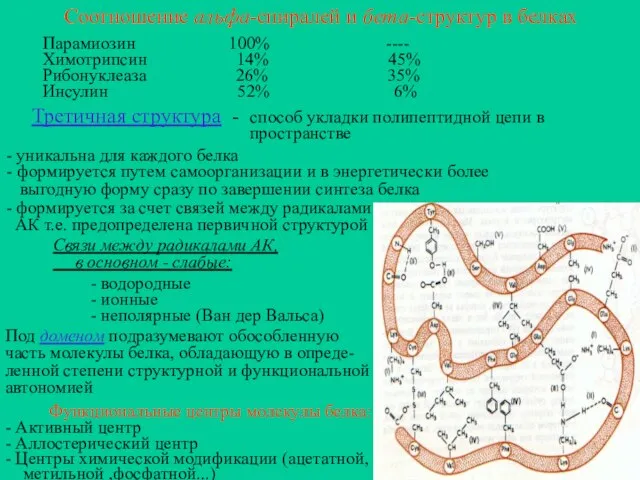
- 13. Соотношение альфа-спиралей и бета-структур в белках Парамиозин 100% ---- Химотрипсин 14% 45% Рибонуклеаза 26% 35% Инсулин
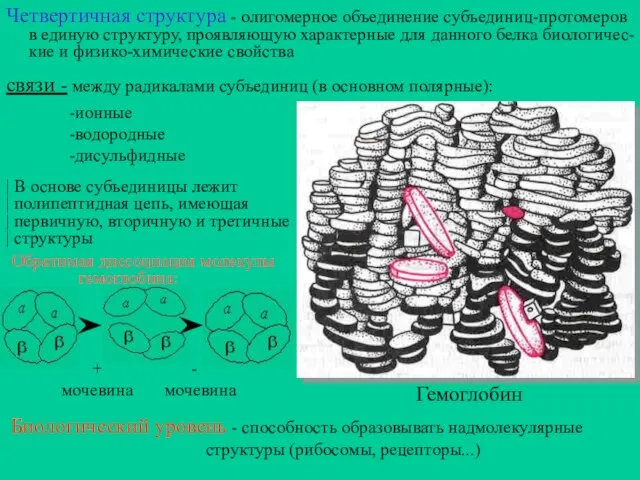
- 14. Четвертичная структура - олигомерное объединение субъединиц-протомеров в единую структуру, проявляющую характерные для данного белка биологичес- кие
- 15. Расшифровка структур белковой молекулы | Изучение структуры белковой молекулы-основная задача | биохимии белка и необходимо для
- 16. Методы изучения структур белка Первичная структура: 1. определение АК состава а) полный гидролиз б) ионнообменная хроматография
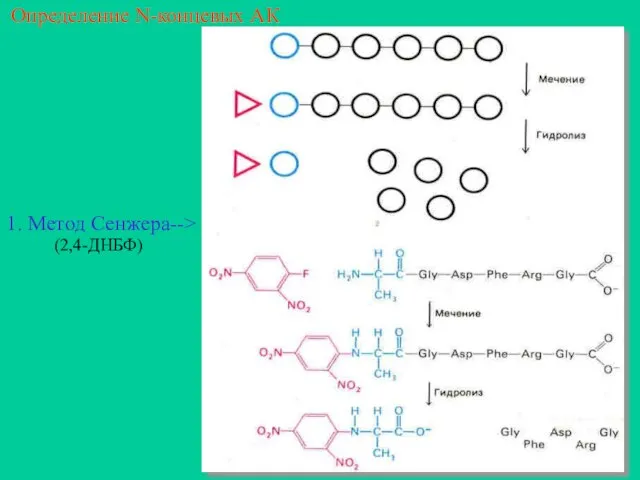
- 17. Определение N-концевых АК 1. Метод Сенжера--> (2,4-ДНБФ)
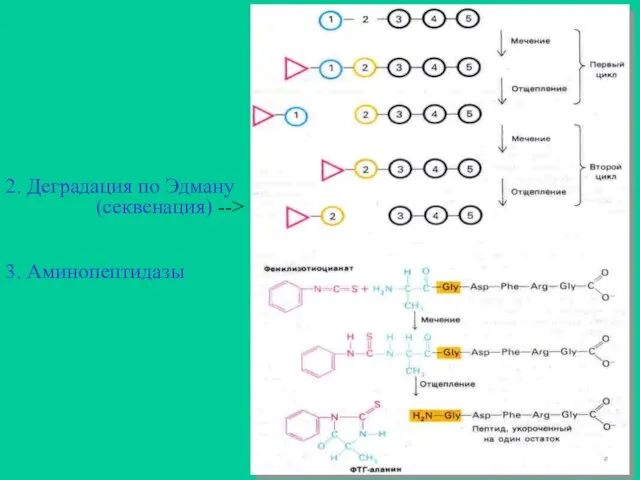
- 18. 2. Деградация по Эдману (секвенация) --> 3. Аминопептидазы
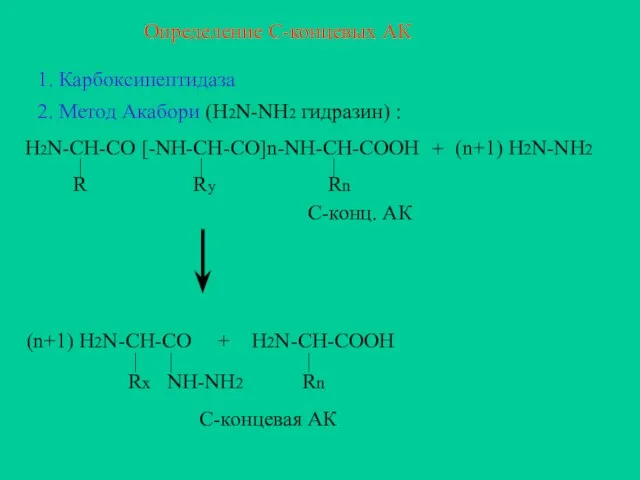
- 19. Определение С-концевых АК 1. Карбоксипептидаза 2. Метод Акабори (H2N-NH2 гидразин) : + (n+1) H2N-NH2 (n+1) H2N-CH-CO
- 21. Скачать презентацию









 Биосоциальная природа человека
Биосоциальная природа человека Пути развития цветка покрытосеменных растений
Пути развития цветка покрытосеменных растений Общая характеристика типа Членистоногие
Общая характеристика типа Членистоногие Классификация, морфология и цитология микроорганизмов
Классификация, морфология и цитология микроорганизмов Презентация на тему "Кожа" - скачать презентации по Биологии
Презентация на тему "Кожа" - скачать презентации по Биологии Физиология цветовосприятия
Физиология цветовосприятия Высшие споровые. Плауны, хвощи, папоротники
Высшие споровые. Плауны, хвощи, папоротники Углерод Carboneum происходит от лат. carbo — уголь.
Углерод Carboneum происходит от лат. carbo — уголь. Простейшие Саркодовые
Простейшие Саркодовые Изменчивость
Изменчивость Вирусы и человек. Противостояние длиной в тысячелетия
Вирусы и человек. Противостояние длиной в тысячелетия Внутреннее строение птицы Презентация к уроку биологии Отряскиной Т.А.
Внутреннее строение птицы Презентация к уроку биологии Отряскиной Т.А. Физиология возбудимых тканей. Часть 2
Физиология возбудимых тканей. Часть 2 Обмін вуглеводів
Обмін вуглеводів Lebka jako celek
Lebka jako celek Химический состав клетки. Неорганические соединения.
Химический состав клетки. Неорганические соединения. СИНКВЕЙН Кто он? Опасный, коварный Пугает, заражает, уничтожает Необъяснимая загадка природы Враг
СИНКВЕЙН Кто он? Опасный, коварный Пугает, заражает, уничтожает Необъяснимая загадка природы Враг Эпителиальные ткани
Эпителиальные ткани Вирустардың нәсілдік қасиеттері, олардың өзгергіштігі.мутация түрлері. Гендік инженерия
Вирустардың нәсілдік қасиеттері, олардың өзгергіштігі.мутация түрлері. Гендік инженерия Дрейф генов в человеческих популяциях
Дрейф генов в человеческих популяциях Опыление цветковых растений
Опыление цветковых растений 20140422_domashnie_zhivotnye2
20140422_domashnie_zhivotnye2 Нейрофизиологические основы поведения. Классификация форм научения
Нейрофизиологические основы поведения. Классификация форм научения Характеристика основних рослин декоративних лук. Родина осокові Cyperaceae Juss
Характеристика основних рослин декоративних лук. Родина осокові Cyperaceae Juss Презентация на тему Генетика пола
Презентация на тему Генетика пола Гормони
Гормони  Розмноження та його значення. Форми розмноження тварин
Розмноження та його значення. Форми розмноження тварин Класс Паукообразные
Класс Паукообразные