Содержание
- 2. Основные вопросы лекции: 1.Изменения основных биохимических констант крови и химического состава плазмы крови. 2.Белки плазмы крови.
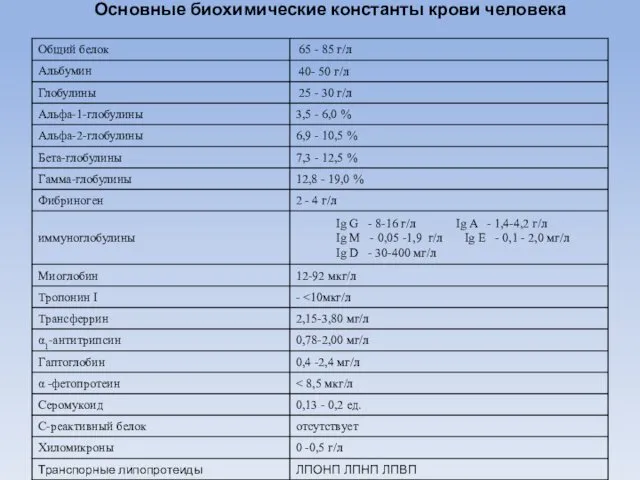
- 3. Основные биохимические константы крови человека
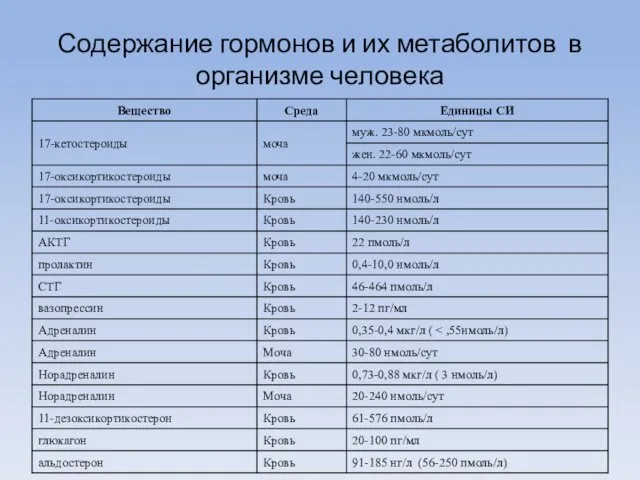
- 4. Содержание гормонов и их метаболитов в организме человека
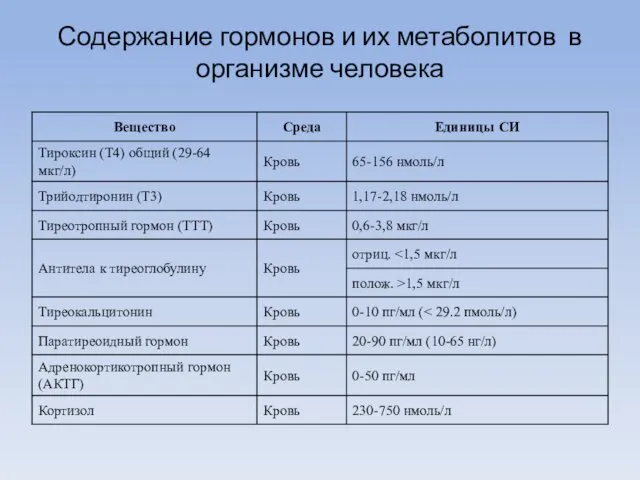
- 5. Содержание гормонов и их метаболитов в организме человека
- 7. Биохимия крови Кровь представляет собой жидкую ткань, состоящей из клеток (форменные элементы) и внеклеточной жидкости -
- 8. Плазма крови человека характеризуется следующими физико-химическими константами: плотность - 1,024- 1,030 ; рН - 7,36- 7,44
- 9. Все химические вещества плазмы крови можно поделить на следующие группы: минеральные вещества плазмы крови органические вещества
- 10. Клетки крови в основном представлены эритроцитами (5млн в мл) и лейкоцитами (7 тыс. в одном мл.).
- 11. Эритроциты Эритроцит представляет собой безъядерный дериват эритробласта. В зрелом эритроците нет ядра, хроматина и аппарата синтеза
- 12. Функции эритроцитов обеспечиваются белками и ферментами, которые синтезируются на стадии ретикулоцита, эритробласта и даже на более
- 13. Главная биологическая функция эритроцитов состоит в транспорте газов (кислорода и двуокиси углерода). Считается, что эритроциты участвуют
- 14. Основным химическим компонентом эритроцитов является белок гемоглобин. 95% массы сухого вещества эритроцитов приходится на гемоглобин. У
- 15. Кроме гемоглобина в эритроцитах содержатся белки - ферменты обеспечивающие анаэробный гликолиз и пентозный путь катаболизма глюкозы,
- 16. Особенности обмена веществ в эритроцитах В эритроцитах катаболизм глюкозы идет анаэробным дихотомическим и апотомическим путями. В
- 18. 10% глюкозы в эритроцитах разрушается гексозомонофосфатным механизмом. Ключевым ферментом этого пути окисления является глюкозо-6-фосфатдегидрогеназа, кофермент которой
- 19. Как показали наблюдения, гексозомонофосфатный путь (пентозный цикл) для эритроцитов имеет особо важное значение, поскольку является источником
- 20. В связи с низким уровнем синтеза АТФ, в эритроцитах имеет место своеобразный экономичный путь реутилизации АМФ
- 21. В эритроцитах аденозин подвергается гидролитическому дезаминированию с образованием инозина и аммиака. Далее инозин подвергается фосфоролизу с
- 22. Известно, что 5-фосфорибозил-1-пирофосфат является исходным субстратом для синтеза пуриновых нуклеотидов. Это соединение в эритроцитах может под
- 25. В эритроцитах человека могут присутствовать несколько типов гемоглобинов - от эмбрионального до взрослого состояния: примитивные гемоглобины
- 26. Важным аллостерическим эффектором для гемоглобина является 2,3-дифосфоглицерат. Присутствует 2,3-дифосфоглицерат в необычайно высоких концентрациях в эритроцитах человека
- 27. Низкий уровень 2,3-дифосфоглицерата в легочных капиллярах приводит к снижению содержания этого аллостерического эффектора в эритроцитах и
- 28. Более высокое сродство фетального гемоглобина к кислороду, чем HbA, связано с меньшей чувствительностью HbF к 2,3-дифосфоглицерату,
- 29. Карбоксигемоглобин (HbCO) относится патологическим производным гемоглобина. При концентрации угарного газа во вдыхаемом воздухе около 10 мл
- 30. Кислород может не только быть использован для образования оксигемоглобина, но и вызвать не ферментативное окисление гемоглобина
- 31. Образование метгемоглобина происходит постоянно: ежедневно около 0,5% всего гемоглобина превращается в метгемоглобин. Метгемоглобин снова восстанавливается в
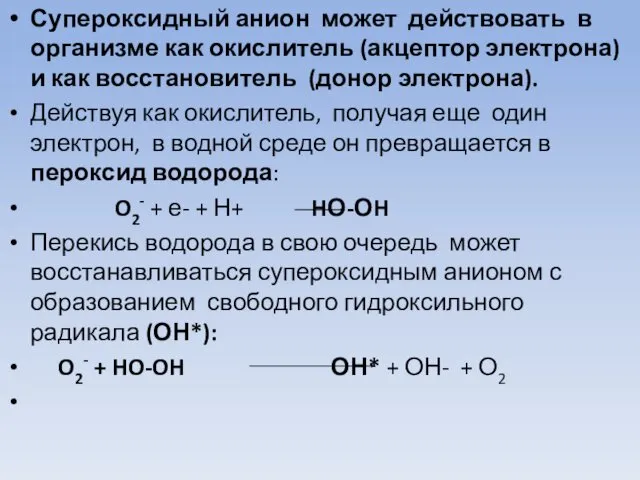
- 32. Супероксидный анион может действовать в организме как окислитель (акцептор электрона) и как восстановитель (донор электрона). Действуя
- 33. Гидроксильный радикал при взаимодействии с супероксидным анионом образует синглетный кислород ("О2), в молекуле которого оба электрона
- 34. Супероксид (О2-), гидроксильный радикал (ОН*), перекись водорода и синглетный кислород ("О2) имеют высокую химическую активность и
- 35. Пероксидное окисление липидов уменьшает гидрофобность липидов, изменяет их конформацию, приводит к образованию ковалентных сшивок между молекулами
- 36. Во всех клетках, в том числе и в эритроцитах, имеются механизмы защиты от токсического действия кислорода.
- 37. Особо важное значение для сохранения целостности мембран эритроцитов занимают глутатион и ферменты глутатионового цикла: глутатионпероксидаза и
- 38. Окисленный глутатион восстанавливается под воздействием фермента глутатионредуктазы с использованием НАДФН2, образующимся в пентозном цикле под воздействием
- 39. Антиоксидантное действие оказывает альфа-токоферол (витамин Е), который может служить донором электронов и может прерывать реакции пероксидного
- 40. Гемолитическая готовность эритроцитов связана с уменьшением не только восстановленного глутатиона, но сульфгидрильных групп белков клеточной мембраны
- 41. Особенности обмена веществ и функций нейтрофилов. Наличие в нейтрофилах большого количества лизосом, содержащие протеиназы типа коллагеназа,
- 42. В нейтрофилах содержится железосвязывающий белок лактоферрин, который может ингибировать рост ряда бактерий и вовлекаться в регуляцию
- 43. В нейтрофилах синтезируется активатор плазминогена. Активная форма плазминогена - плазмин осуществляет процесс разрушения фибрина в тромбе.
- 44. В нейтрофилах имеется особый фермент - миелопероксидаза, которая разрушает перекись водорода с образованием активной гипохлорной кислоты
- 45. Нейтрофилы и пероксинитрит Нейтрофилы, курсирующие в этой неблагоприятной среде, активируются, прилипают к репефузированной ткани, генерируют супероксидные
- 46. Благодаря наличию у нейтрофилов факторов хемотаксиса (белки системы комплемента и селектины) происходит скопление нейтрофилов (хемотаксис нейтрофилов)
- 47. Инозитолтрифосфат повышает уровень Са++ в клетке за счет его выхода из эндоплазматического ретикулума. Ионы кальция активируют
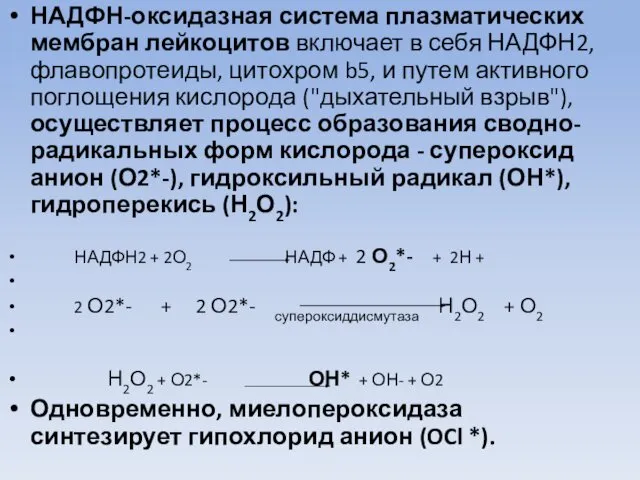
- 48. НАДФН-оксидазная система плазматических мембран лейкоцитов включает в себя НАДФН2, флавопротеиды, цитохром b5, и путем активного поглощения
- 49. Все эти активные свободно-радикальные формы кислорода, образующиеся при "дыхательном взрыве", используются для уничтожения чужеродных клеток (бактерий).
- 50. Активируется фосфолипаза А2, которая высвобождает из фосфолипидов мембран арахидоновую кислоту, из которой синтезируются простагландины, тромбоксаны и
- 51. Оксид азота (NO) вызывает расслабление гладкой мускулатуры сосудов, снижает артериальное давление. В больших количествах оксид азота
- 52. Оксид азота в клетках эндотелия гладких мышц сосудов, связывается со специфическими рецепторными цитоплазматической гуанилатциклазы, активирует этот
- 53. Сигнал оксида азота может имитироваться органическими нитратами (нитроглицерин), которые используются для лечения стенокардии, инфаркта миокарда и
- 54. Эффекты оксида азота Оксид азота играет двойственную роль в патогенезе септического шока. Он оказывает защитный антибактериальный
- 55. Оксид азота соединяется с супероксидом, образует пероксинитрит анион (ОNОО-), который индуцирует повреждение ДНК и мутацию. Такая
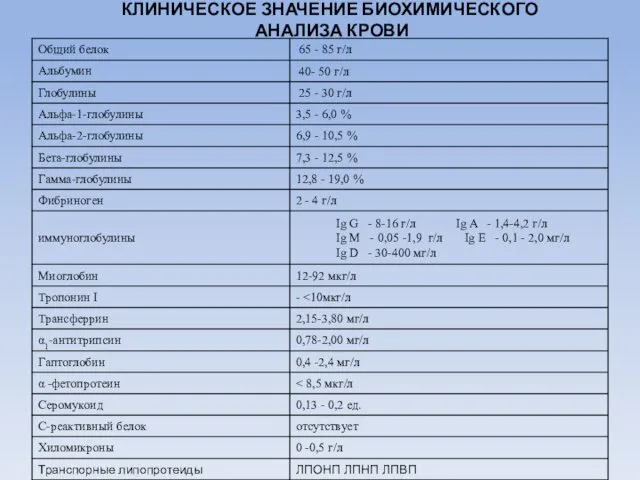
- 56. Биохимический анализ крови обычно включает определение следующих показателей: Общий белок Билирубин; Креатинин; КФК (креатинофосфокиназа); ЛДГ; Липаза;
- 57. Показатели углеводного обмена: 1. Глюкоза крови. 2. Серомукоиды. 3. Сиаловые кислоты. 4. Молочная кислота 5. Пируват
- 58. Показатели липидного обмена: 1. Общий холестерин. 2. Бета-липопротеиды 3. Общие липиды. 4. Триацилглицериды. 5. Фосфолипиды. 6.
- 59. Показатели белкового обмена: 1. Общий белок и его фракции. 2. Остаточный азот. 3. Креатинин. 4. Индикан.
- 60. Показатели пигментного обмена 1. Билирубин и его фракции. 2. Уропорфирины. 3. Копропорфирины.
- 61. Показатели водно-солевого обмена: 1. Определение натрия. 2. Определение калия. 3. Определение кальция. 4. Определение магния. 5.
- 62. Читая лабораторный анализ, врач должен ответить на следующие четыре вопроса 1.Какие изменения имеют место в анализах
- 63. КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ БИОХИМИЧЕСКОГО АНАЛИЗА КРОВИ
- 64. Альбумины - самые легкие белки крови, относительная молекулярная масса - 70 000. Благодаря высокой концентрации в
- 65. Повышение уровня альбуминов в крови имеет место при дегидратации, шоке, внутривенном введении больших концентраций альбумина. Любая
- 66. Глобулины крови представлены α1-, α2-, β-, γ - фракциями белков α1-глобулиновая фракция представлена: α-липопротеидами (ЛПВП), гликопротеидами,
- 67. β -глобулиновая фракция белков сыворотки крови включает в себя β-липопротеиды (ЛПНП), β-гликопротеины (гемсвязывающий белок гемопексин), β1-гликопротеин
- 68. γ-глобулиновая фракция содержит антитела (иммуноглобулины). Повышение γ-глобулинов происходит при острых воспалительных состояниях, хроническом гепатите, циррозе печени,
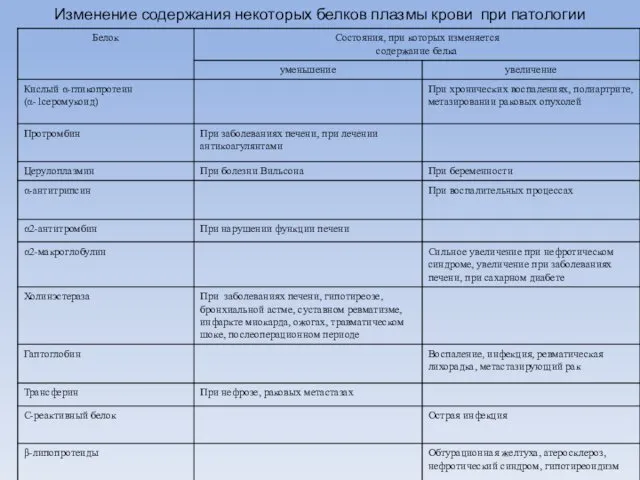
- 69. Белки острой фазы Гаптоглобин - типичный представитель белков острой фазы, т.е. группы плазменных белков, гликопротеидов, концентрация
- 70. С-реактивный белок в сыворотке крови здорового человека отсутствует, но обнаруживается при патологических состояниях, сопровождающихся воспалением и
- 71. Белки острой фазы α1-гликопротеин имеет высокое сродство к полианионам и к гепарину, обладает антихимотрипсиновым эффектом. Имеются
- 72. Церулоплазмин - это гликопротеид, медь содержащий белок, проявляет свойства оксидазы полифенолов и диаминов. Принимает участие в
- 73. Тропонин J - кардиоспецифический белок тропонинового комплекса (тропонин J, тропонин T, тропонин C) участвующий в пусковом
- 74. Миоглобин - гемопротеид мышц. Уровень в крови повышается при воспалительных поражениях мышц, инфаркте миокарда, травмах, судорогах,
- 75. Изменение содержания некоторых белков плазмы крови при патологии
- 76. Диспротеинемические пробы
- 77. Диспротеинемии при острых воспалительных процессах (начальная стадия пневмонии, острый полиартрит, экссудативный туберкулез легких, острые инфекционные заболевания,
- 78. типы гиперлипопротеинемий 1 тип - гиперхиломикронемия. Увеличено содержание хиломикронов и слегка повышено содержание ЛПОНП. В крови
- 79. типы гиперлипопротеинемий 3 тип - флотирующая гиперлипопротеинемия. Нарушено превращение пре-β-липопротеинов (ЛПОНП) в β-липопротеины (ЛПНП). Появляются необычные
- 80. типы гиперлипопротеинемий 1 тип - гиперхиломикронемия. Увеличено содержание хиломикронов и слегка повышено содержание ЛПОНП. В крови
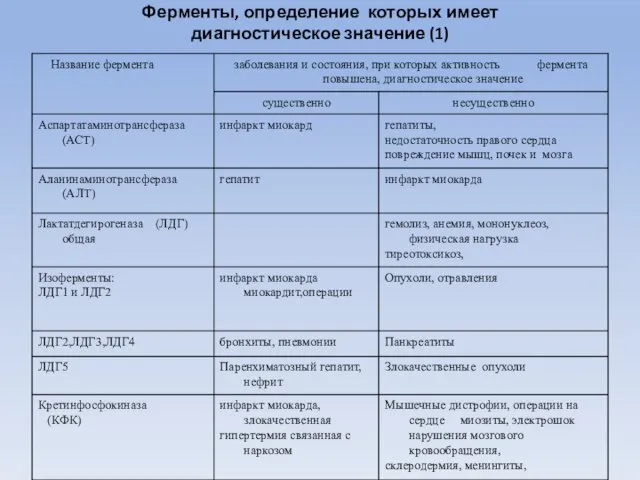
- 81. Ферменты, определение которых имеет диагностическое значение (1)
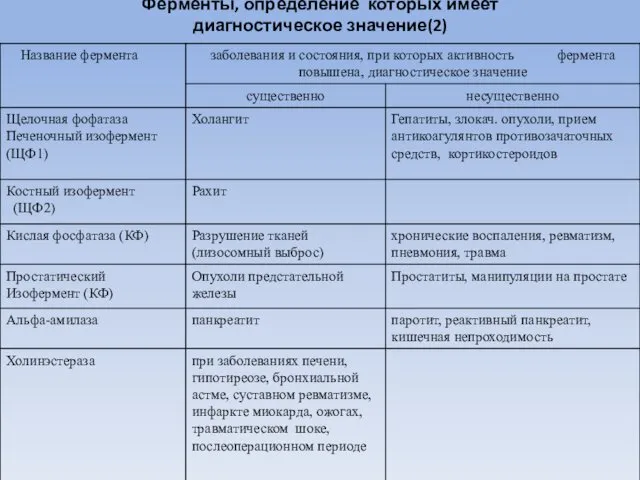
- 82. Ферменты, определение которых имеет диагностическое значение(2)
- 83. Альдолаза (КФ 4.1.2.13)- фермент катализирующий разрушение фруктозо 1.6 дифосфата на фосфотриозы. Активность фермента повышается при остром
- 84. α-амилаза ( КФ 3.2.1.1) - фермент (диастаза, птиалин) разрушает крахмал (гликоген) до мальтозы. Содержится в слюне,
- 85. Трансаминазы ферменты катализирующие реакции переаминирования - перенос аминогрупп от альфа-аминокислот на альфа-кетокислот Наибольшее диагностическое значение имеет
- 86. γ- глутаминилтранспептидаза (ГГТП) (КФ 2.3.2.2) фермент катализирует перенос глутамильного радикала с γ- глутаминил-пептида на аминокислоты (пептиды)
- 87. Сорбитолдегидрогеназа (СДГ) (КФ 1.1.1.14)- фермент катализирует обратимое окисление сорбитола. Фермент специфичен для печени, почек и простаты.
- 88. Креатинфосфокиназа (КФ 2.7.3.3) Креатинфосфокиназа (КФК) катализирует реакцию переноса фосфатного остатка с АТФ на креатин. АТФ +
- 89. Лактатдегидрогеназа (ЛДГ) (КФ 1.1.1.27) . ЛДГ в диагностике инфаркта миокарда Через несколько часов после инфаркта миокарда
- 90. Изменения активности некоторых ферментов при остром инфаркте миокарда
- 91. ЛДГ при заболевания желчевыводящей системы. Болезнь Боткина - общая активность ЛДГ повышена в течение первой недели
- 92. Липаза (КФ3.1.1.3) катализируюет гидролиз триацилглицеридов. Повышение активности липазы в сыворотке крови наблюдается при панкреатитах, желчной колике,
- 93. 5`-нуклеотидаза (КФ 3.1.3.5)- катализирует гидролиз нуклеотидов, в частности АМФ. Активность этого фермента повышается при гепатитах, раке
- 94. Фосфатазы - ферменты, катализирующие отщепление фосфорной кислоты от ее органических эфиров. Различают щелочную и кислую фосфатазы.
- 95. Фосфатаза кислая Фосфомоноэстераза II или кислая фосфатаза (КФ 3.1.3.2). Оптимум рН кислой фосфатазы 5,0-5,5. Кислая фосфатаза
- 96. Холинэстераза (КФ 3.1.1.8). Холинэстераза (ХЭ) обладает относительной специфичностью. Катализирует гидролиз различных эфиров холина (ацетилхолин, бутирилхолин и
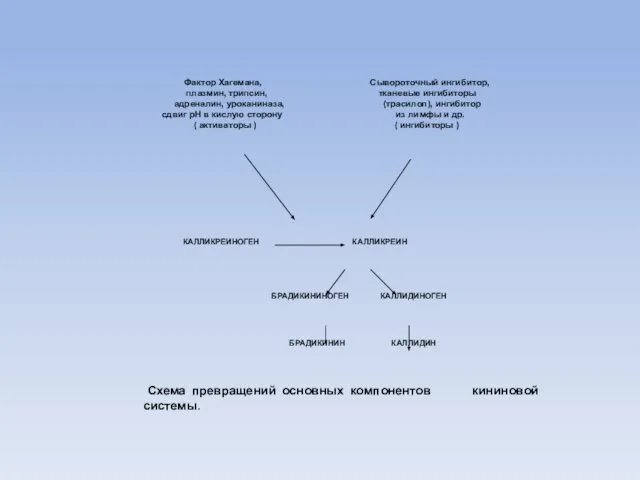
- 97. Кинины Кинины иногда называют местными гормонами. Они вырабатываются не в специфических железах внутренней секреции, а освобождаются
- 98. Кинины - калликреины Образование кининов из кининогенов происходит под воздействием специфических ферментов - кининогеназ, называемых калликреинами.
- 99. Фактор Хагемана, Сывороточный ингибитор, плазмин, трипсин, тканевые ингибиторы адреналин, уроканиназа, (трасилол), ингибитор сдвиг рН в кислую
- 100. Кинины Физиологическая роль кининов: -регулируют местный кровоток -регулируют кровяное давление -вызывают гиперемию тканей -стимулируют сердечно-сосудистую деятельность
- 101. Участие кининов в формировании патологического процесса: усиливают воспаление (панкреатиты,артриты, аллергии, ожоги, инфекции, облучение) способствуют развитию шока
- 102. Фармакологическое действие кининов: -расширяют просвет кровеносных сосудов -снижают кровяное давление -снижают кровяное давление -повышают проницаемость капилляров
- 104. Скачать презентацию



























































































 Презентация на тему "Гмо(Генетически модифицированный организм)" - скачать презентации по Биологии
Презентация на тему "Гмо(Генетически модифицированный организм)" - скачать презентации по Биологии Сапропель, как ценное кормовое сырье в комбикормах для карпа
Сапропель, как ценное кормовое сырье в комбикормах для карпа Дидактическая игра по теме «Растения Красной книги» Окружающий мир, 2 класс Автор: Кулакова Наталья Ивановна, учитель начальны
Дидактическая игра по теме «Растения Красной книги» Окружающий мир, 2 класс Автор: Кулакова Наталья Ивановна, учитель начальны Физические изменения у подростков
Физические изменения у подростков Презентация на тему Эволюция органического мира урок – путешествие 9, 11 класс
Презентация на тему Эволюция органического мира урок – путешествие 9, 11 класс Как прекрасен этот мир
Как прекрасен этот мир Движущие силы эволюции. Борьба за существование. 11 класс Тема урока:
Движущие силы эволюции. Борьба за существование. 11 класс Тема урока:  Анатомия и физиология нервной системі
Анатомия и физиология нервной системі Анатомия и физиология мужской половой системы
Анатомия и физиология мужской половой системы Гормональная регуляция
Гормональная регуляция Презентация на тему Деление клетки -митоз
Презентация на тему Деление клетки -митоз  Б Е Л К И
Б Е Л К И  Презентация на тему "Типы нервной системы. Типы темперамента. Характер. Самооценка" - скачать презентации по Биологии
Презентация на тему "Типы нервной системы. Типы темперамента. Характер. Самооценка" - скачать презентации по Биологии Визначення оптимальних параметрів приготування поживних розчинів. Їх використання при вирощуванні екологічно чистої продукції
Визначення оптимальних параметрів приготування поживних розчинів. Їх використання при вирощуванні екологічно чистої продукції Формы размножения организмов. Жизненный цикл организмов и характер смены поколений
Формы размножения организмов. Жизненный цикл организмов и характер смены поколений Выход позвоночных на сушу
Выход позвоночных на сушу Строение стебля
Строение стебля Основы гистологии
Основы гистологии Презентация на тему "Оплодотворение. Образование плодов семян" - скачать презентации по Биологии
Презентация на тему "Оплодотворение. Образование плодов семян" - скачать презентации по Биологии Photosynthesis
Photosynthesis Увеличительные приборы. Строение живых организмов.
Увеличительные приборы. Строение живых организмов. Презентация на тему Агроценозы
Презентация на тему Агроценозы  Зоологія. Холоднокровні
Зоологія. Холоднокровні Витамины
Витамины Презентация Биотические факторы
Презентация Биотические факторы  Презентация по биологии Лилейные и злаковые растения
Презентация по биологии Лилейные и злаковые растения  Жизненный цикл клетки
Жизненный цикл клетки Индивидуальное развитие животных. Урок биологии 6 класс по УМК Сферы
Индивидуальное развитие животных. Урок биологии 6 класс по УМК Сферы