Содержание
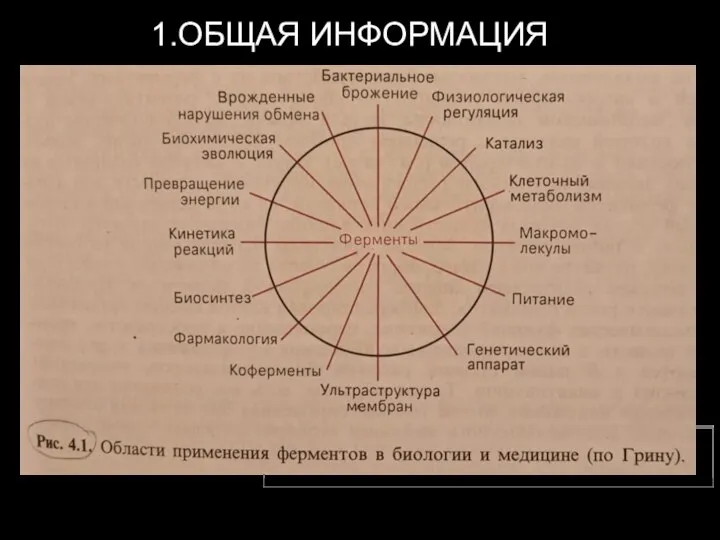
- 2. 1.ОБЩАЯ ИНФОРМАЦИЯ
- 3. 2. ХИМИЧЕСКАЯ ПРИРОДА ФЕРМЕНТОВ Экспериментально было доказано, что ферменты имеют белковую природу. Ферменты при гидролизе распадаются
- 5. 3.СТРОЕНИЕ ФЕРМЕНТОВ Существуют простые и сложные ферменты. Простые ферменты являются полипептидными цепями и при гидролизе распадаются
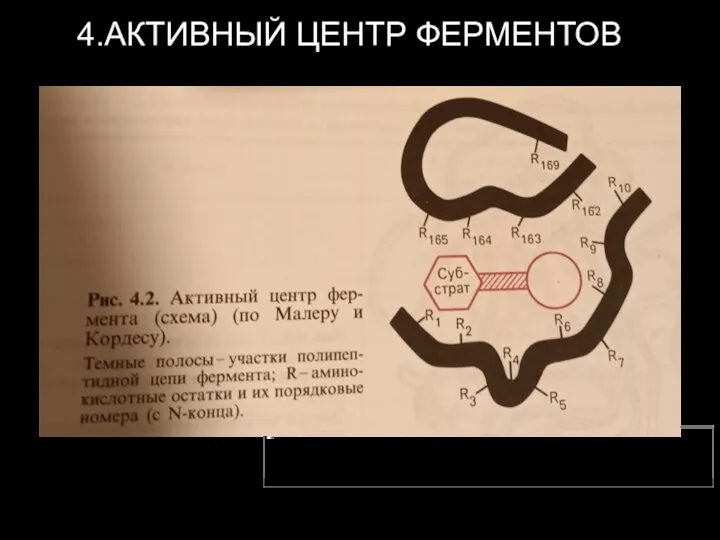
- 7. 4.АКТИВНЫЙ ЦЕНТР ФЕРМЕНТОВ
- 8. 5.ИЗОФЕРМЕНТЫ Изоферменты — множественные формы фермента, катализирующие одну и ту же реакцию, но отличающиеся друг от
- 9. 6.МУЛЬТИМОЛЕКУЛЯРНЫЕ ФЕРМЕНТНЫЕ СИСТЕМЫ В надмолекулярные/мультимолекулярные ферментные комплексы входят разные ферменты, катализирующие последовательные ступени превращения какого-либо субстрата.
- 10. 7.МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ При энзиматическом катализе фермент (Е) соединяется с субстратом (S), образуя нестойкий промежуточный фермент-субстратный
- 12. 8.ОСНОВНЫЕ СВОЙСТВА ФЕРМЕНТОВ
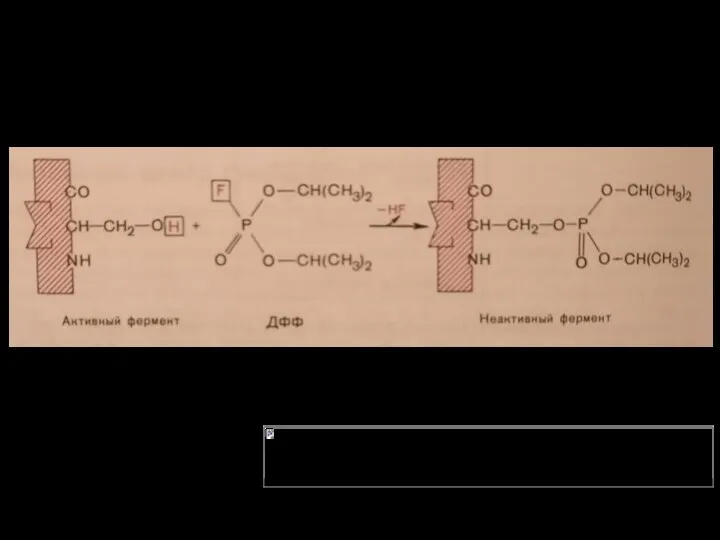
- 13. 9.АКТИВИРОВАНИЕ И ИНГИБИРОВАНИЕ ФЕРМЕНТОВ Существует два типа веществ: активаторы — повышают скорость реакции (как орагнические, так
- 14. 10.ТИПЫ ИНГИБИРОВАНИЯ Необратимое Обратимое: -Конкурентное -Неконкурентное -Бесконкурентное Смешанное
- 15. 11.РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТА -Влияние закона действия масс. - Изменение количества фермента -Проферменты -Химическая модификация фермента -Аллостерическая
- 17. Скачать презентацию











 Польза сна
Польза сна Лекарственные травы на пришкольном участке
Лекарственные травы на пришкольном участке Презентация на тему "Типы экологических взаимоотношений" - скачать презентации по Биологии
Презентация на тему "Типы экологических взаимоотношений" - скачать презентации по Биологии Ткани организма человека. Эпителиальная
Ткани организма человека. Эпителиальная Кишечнополостные
Кишечнополостные Презентация на тему "Размножение и развитие животных (3 класс)" - скачать презентации по Биологии
Презентация на тему "Размножение и развитие животных (3 класс)" - скачать презентации по Биологии «Когда-то, где-то на Землю упал луч солнца, но он упал не на бесплодную почву, он упал на зелёную былинку пшеничного ростка, или, лучше сказать, на хлорофилловое зерно. Ударяясь о него, он потух, перестал быть светом, но не исчез… В той или другой форме о
«Когда-то, где-то на Землю упал луч солнца, но он упал не на бесплодную почву, он упал на зелёную былинку пшеничного ростка, или, лучше сказать, на хлорофилловое зерно. Ударяясь о него, он потух, перестал быть светом, но не исчез… В той или другой форме о Взаємозв’язок процесів обміну речовин в організмі (інтеграція метаболізму)
Взаємозв’язок процесів обміну речовин в організмі (інтеграція метаболізму) Строение растения
Строение растения Пауль Лангерганс
Пауль Лангерганс Презентация на тему: «Исчезающие виды растений». Красота растений не в букетах, а там, где они растут! Не рви растения! Лучше научис
Презентация на тему: «Исчезающие виды растений». Красота растений не в букетах, а там, где они растут! Не рви растения! Лучше научис Адаптация и физическая работоспособность
Адаптация и физическая работоспособность Путешествие по книге. Семейство мотыльковых (бобовые)
Путешествие по книге. Семейство мотыльковых (бобовые)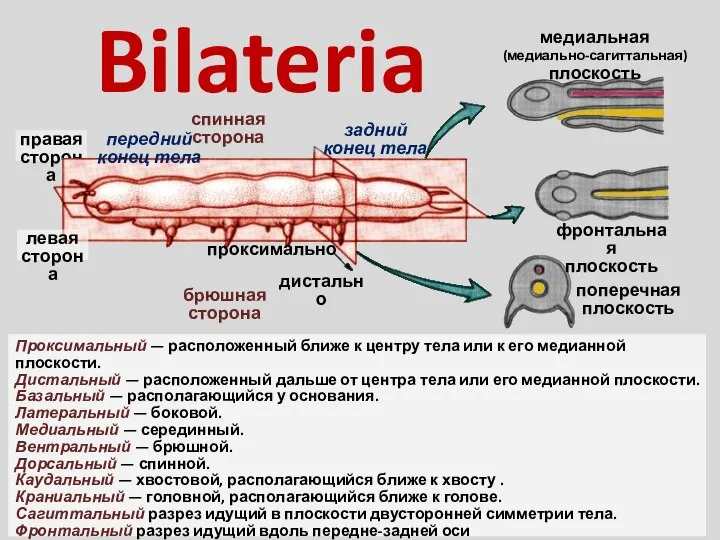 Bilateria
Bilateria Практическая работа №1
Практическая работа №1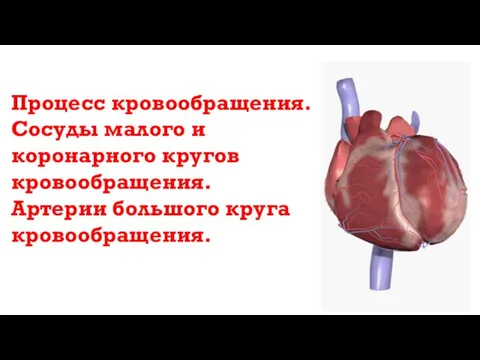 Процесс кровообращения. Сосуды малого и коронарного кругов кровообращения. Артерии большого круга кровообращения
Процесс кровообращения. Сосуды малого и коронарного кругов кровообращения. Артерии большого круга кровообращения Виды лягушек
Виды лягушек Онтогенез Выполнила: Семерня Лидия Михайловна.
Онтогенез Выполнила: Семерня Лидия Михайловна. Повзаючі тварини
Повзаючі тварини Перечень таблиц Перечень таблиц 2.Многообразие живых организмов 3. Эволюционное древо 4. Строение клетки 5. Деление клетки 6. Уров
Перечень таблиц Перечень таблиц 2.Многообразие живых организмов 3. Эволюционное древо 4. Строение клетки 5. Деление клетки 6. Уров Презентация на тему "Царство животные" - скачать презентации по Биологии
Презентация на тему "Царство животные" - скачать презентации по Биологии Удивительные свойства лимона. 1 класс
Удивительные свойства лимона. 1 класс Редкие виды пресмыкающихся Краснодарского края. Характеристика местообитаний. Причины исчезновения, мотивы охраны
Редкие виды пресмыкающихся Краснодарского края. Характеристика местообитаний. Причины исчезновения, мотивы охраны Многообразие насекомых, их роль в природе, жизни человека и охрана
Многообразие насекомых, их роль в природе, жизни человека и охрана Клеточное строение организмов
Клеточное строение организмов Презентация на тему "Лишайник - симбиотический организм" - скачать презентации по Биологии
Презентация на тему "Лишайник - симбиотический организм" - скачать презентации по Биологии Презентация на тему "Побеги и почки" - скачать презентации по Биологии
Презентация на тему "Побеги и почки" - скачать презентации по Биологии Значение растений в природе и жизни человека
Значение растений в природе и жизни человека