Содержание
- 2. 1. Введение Ферменты – самый крупный и наиболее специализированный класс белковых молекул. Ферменты являются тем рабочим
- 3. 2. Строение ферментов Ферменты – это специфические белки, выполняющие роль биокатализаторов. История изучения: В 17 веке
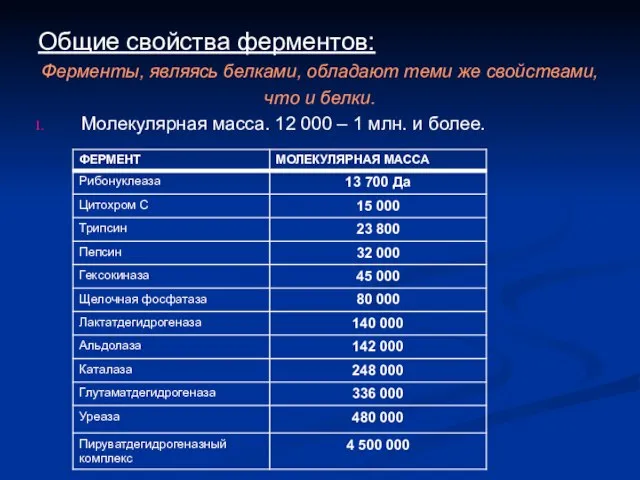
- 4. Общие свойства ферментов: Ферменты, являясь белками, обладают теми же свойствами, что и белки. Молекулярная масса. 12
- 5. 2. Ферменты имеют первичную , 2 – , 3 - , 4 – ю структуры РНКаза
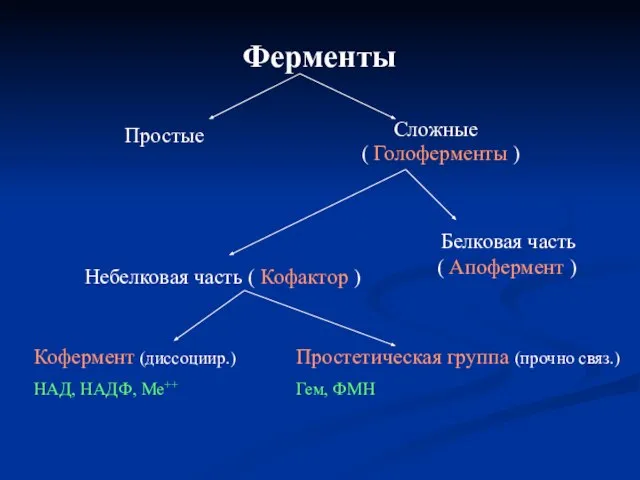
- 6. Ферменты Простые Сложные ( Голоферменты ) Белковая часть ( Апофермент ) Небелковая часть ( Кофактор )
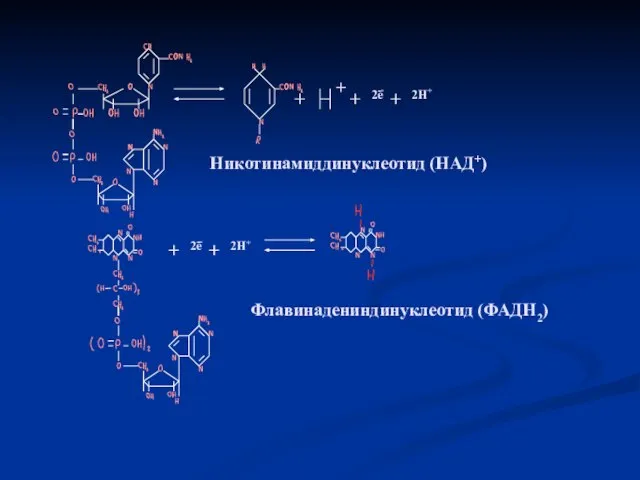
- 7. + 2е 2Н+ Никотинамиддинуклеотид (НАД+) 2е 2Н+ Флавинадениндинуклеотид (ФАДН2)
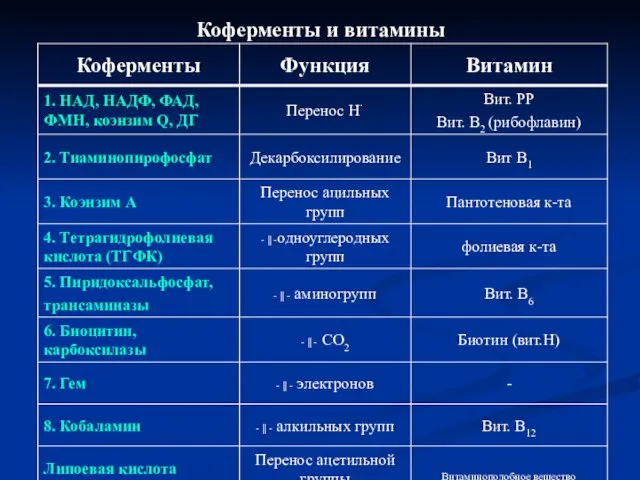
- 8. Коферменты и витамины
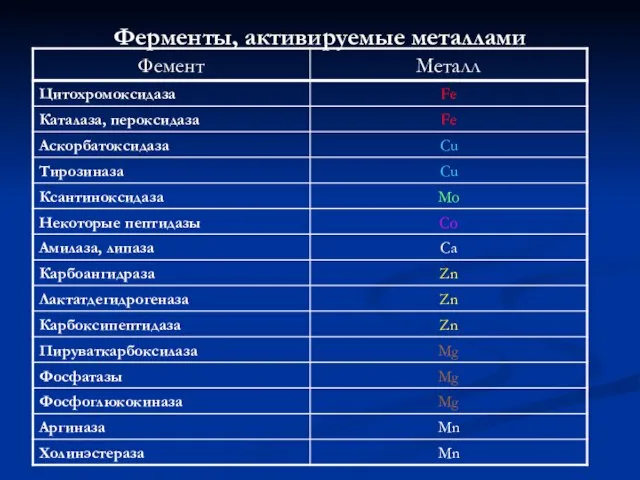
- 9. Ферменты, активируемые металлами
- 10. Механизм действия ферментов [по А. Кантарову, Б. Шепартцу] + + + + Субстрат ( S )
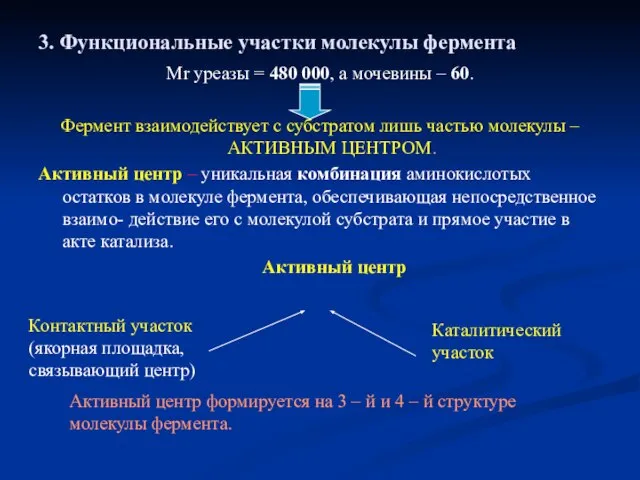
- 11. 3. Функциональные участки молекулы фермента Мr уреазы = 480 000, а мочевины – 60. Фермент взаимодействует
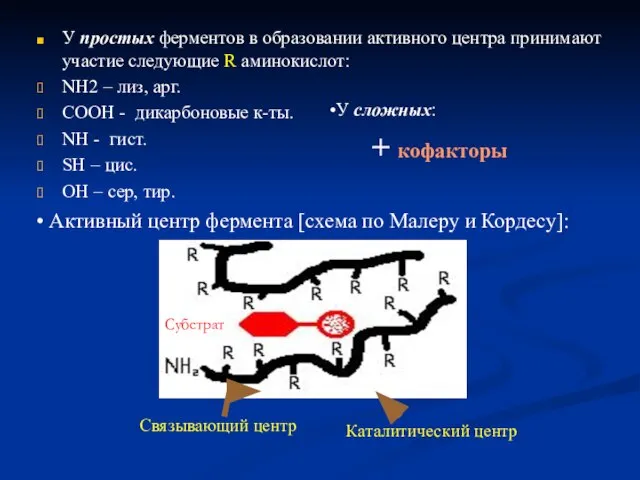
- 12. У простых ферментов в образовании активного центра принимают участие следующие R аминокислот: NH2 – лиз, арг.
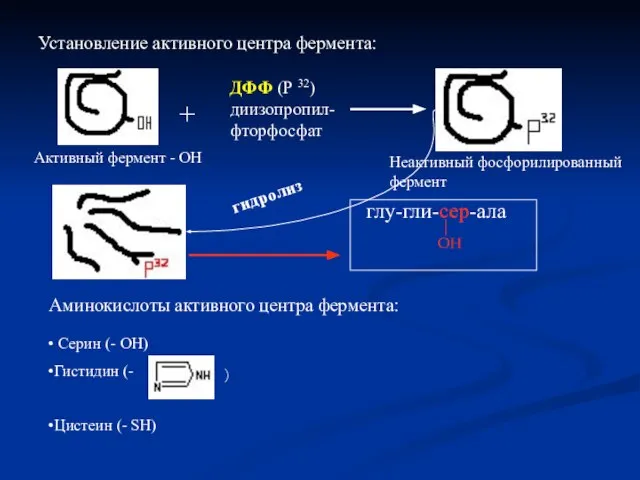
- 13. Установление активного центра фермента: Активный фермент - ОН + ДФФ (Р 32) диизопропил- фторфосфат глу-гли-сер-ала ОН
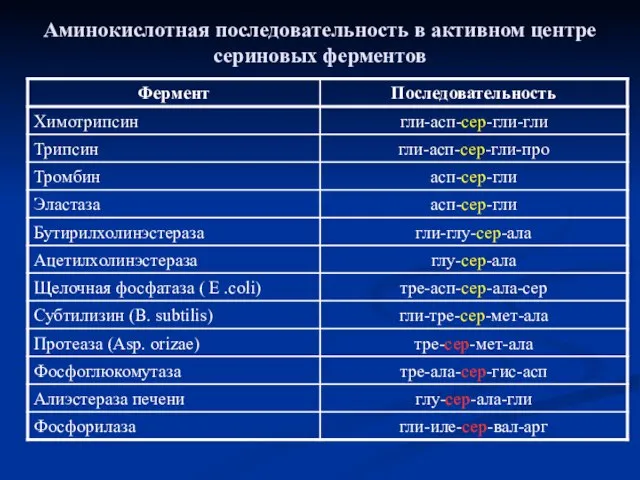
- 14. Аминокислотная последовательность в активном центре сериновых ферментов
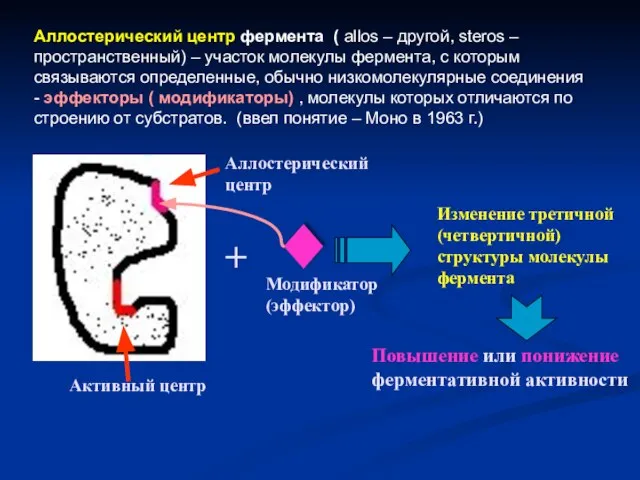
- 15. Аллостерический центр фермента ( allos – другой, steros – пространственный) – участок молекулы фермента, с которым
- 16. Участки в молекуле фермента: 1) Активный центр и аллостерический центры 2) Участки химической (постсинтетической) модификации фермента
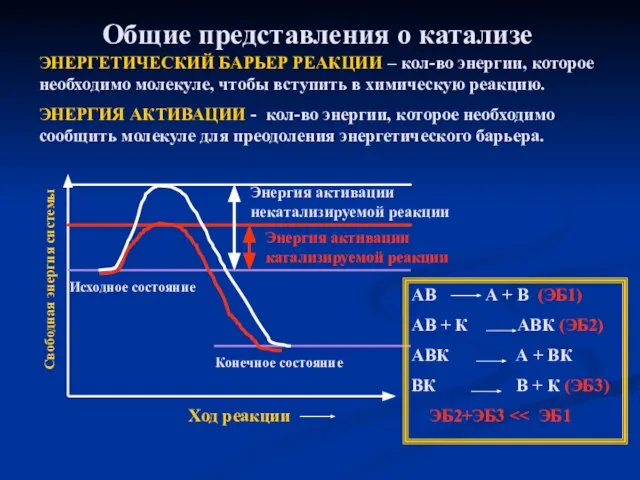
- 17. Общие представления о катализе ЭНЕРГЕТИЧЕСКИЙ БАРЬЕР РЕАКЦИИ – кол-во энергии, которое необходимо молекуле, чтобы вступить в
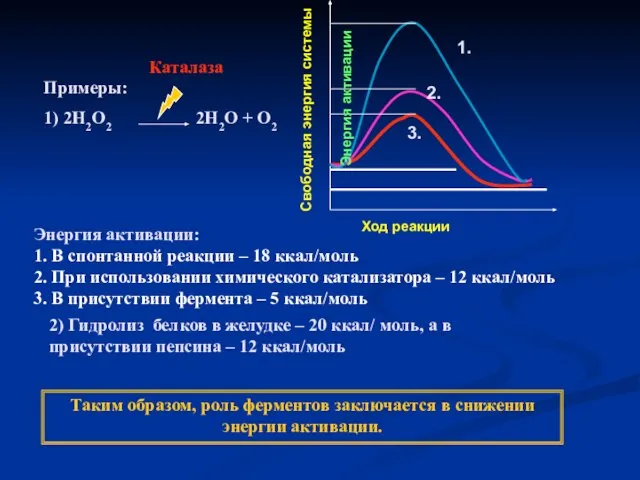
- 18. Примеры: 1) 2Н2О2 2Н2О + О2 Каталаза Энергия активации: 1. В спонтанной реакции – 18 ккал/моль
- 19. Различия ферментов и неорганических катализаторов Значительно большая активность ( Строгая специфичность 100 % выход конечных продуктов
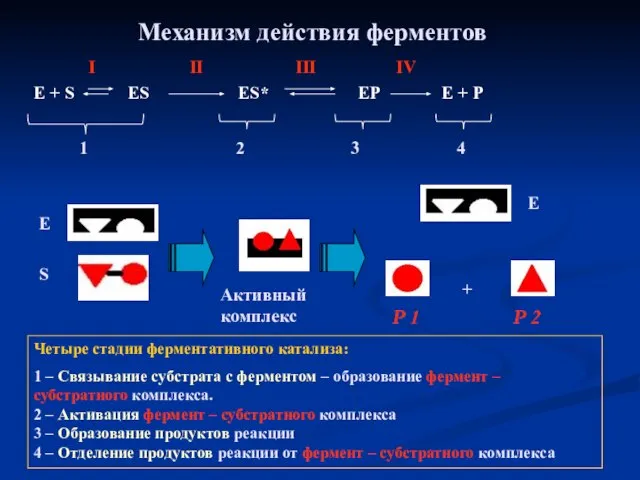
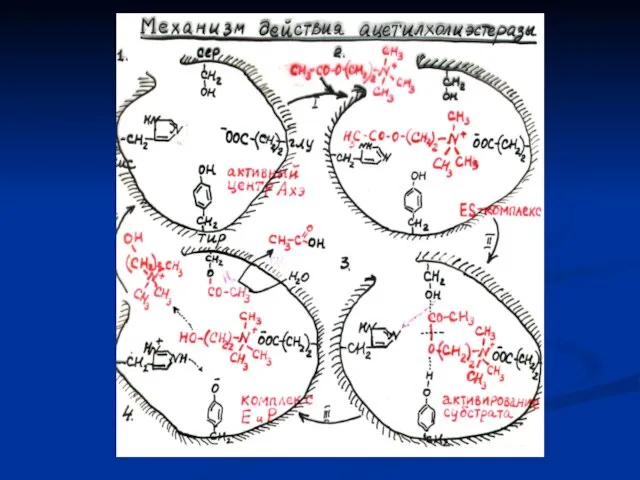
- 20. Механизм действия ферментов Е + S ES ES* EP E + P II I III IV
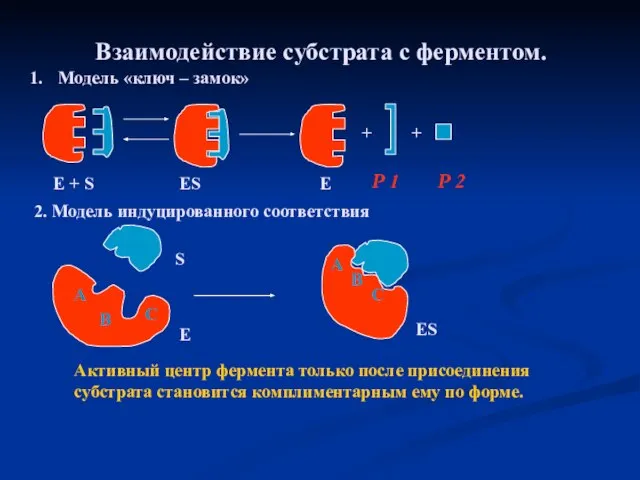
- 21. Взаимодействие субстрата с ферментом. Модель «ключ – замок» 2. Модель индуцированного соответствия Активный центр фермента только
- 23. Молекулярный механизм действия ферментов СБЛИЖЕНИЕ И ОРИЕНТАЦИЯ – активный центр фермента связывается с субстратом НАПРЯЖЕНИЕ И
- 24. Классификация ферментов ( V Международный Биохимический конгресс в Москве) ОКСИДОРЕДУКТАЗЫ: А) дегидрогеназы -аэробные -анаэробные Б) цитохромы
- 25. Номенклатура ферментов
- 27. Скачать презентацию



![Механизм действия ферментов [по А. Кантарову, Б. Шепартцу] + + +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/514105/slide-9.jpg)





 Растительные ткани
Растительные ткани Классификация и номенклатура.Витамерия. Провитаминация
Классификация и номенклатура.Витамерия. Провитаминация Презентация на тему "Общий обзор организма человека" - скачать бесплатно презентации по Биологии
Презентация на тему "Общий обзор организма человека" - скачать бесплатно презентации по Биологии Окружающий мир 2 класс. Животные дикие и домашние
Окружающий мир 2 класс. Животные дикие и домашние Птахи занесені до Червоної книги України
Птахи занесені до Червоної книги України  Детям о собаках
Детям о собаках «Значение, строение и функционирование нервной системы» Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировн
«Значение, строение и функционирование нервной системы» Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировн Антропогенез. Тупайи и шерстокрылы: родня. (часть 1)
Антропогенез. Тупайи и шерстокрылы: родня. (часть 1) Лісові культури
Лісові культури Развитие ода, двигательных качеств адаптация к физическим нагрузкам
Развитие ода, двигательных качеств адаптация к физическим нагрузкам Изучение жизненного цикла цветковых растений
Изучение жизненного цикла цветковых растений Отряд хищные (carnivora). Подотряд собакообразные (caniformia)
Отряд хищные (carnivora). Подотряд собакообразные (caniformia) Презентация на тему Цветок, его строение и значение
Презентация на тему Цветок, его строение и значение Царство одноклеточные. Строение простейших
Царство одноклеточные. Строение простейших Глава 1. Человечество в биосфере Влияние экологических факторов на развитие человечества. Воздействие человечества на биосферу.
Глава 1. Человечество в биосфере Влияние экологических факторов на развитие человечества. Воздействие человечества на биосферу. Роль птиц в природе и жизни человека
Роль птиц в природе и жизни человека Редкие растения Ярославской области Авторы: ученики 4-а класса лицея № 1 Веселов Александр Ильина Анастасия © г.Тутаев
Редкие растения Ярославской области Авторы: ученики 4-а класса лицея № 1 Веселов Александр Ильина Анастасия © г.Тутаев Одномембранные органоиды клетки
Одномембранные органоиды клетки Законы Менделя
Законы Менделя  Кайнозойская эра текущая эра геологической истории Земли. Началась 66,0 миллионов лет и продолжается до сих пор. Название перево
Кайнозойская эра текущая эра геологической истории Земли. Началась 66,0 миллионов лет и продолжается до сих пор. Название перево Условия прорастания семян
Условия прорастания семян Кто что ест?
Кто что ест? Биосфера как единая экосистема Земли Структура и состав биосферы. Функции живого вещества. Соотношение массы живых организмов и
Биосфера как единая экосистема Земли Структура и состав биосферы. Функции живого вещества. Соотношение массы живых организмов и  Цитоплазма и органеллы
Цитоплазма и органеллы Нервная система
Нервная система В помощь учителю биологии
В помощь учителю биологии Деление клетки. Митоз
Деление клетки. Митоз Бәсекелестік бір немесе бірнеше түрге
Бәсекелестік бір немесе бірнеше түрге