Содержание
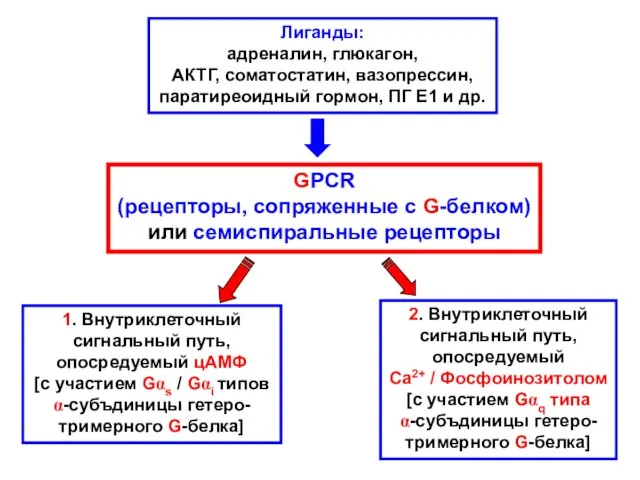
- 2. Лиганды: адреналин, глюкагон, АКТГ, соматостатин, вазопрессин, паратиреоидный гормон, ПГ Е1 и др. GPCR (рецепторы, сопряженные с
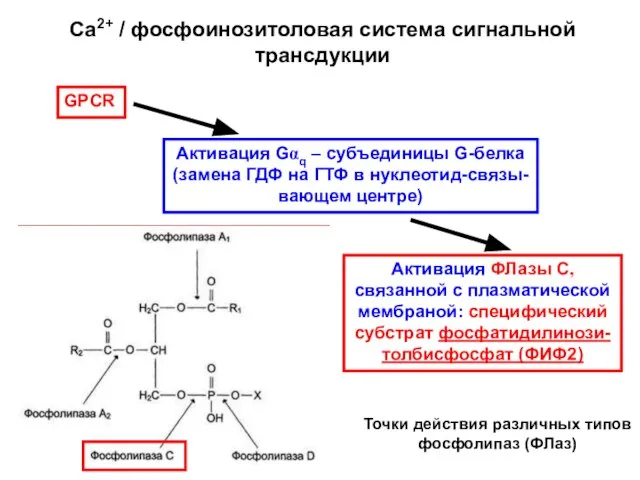
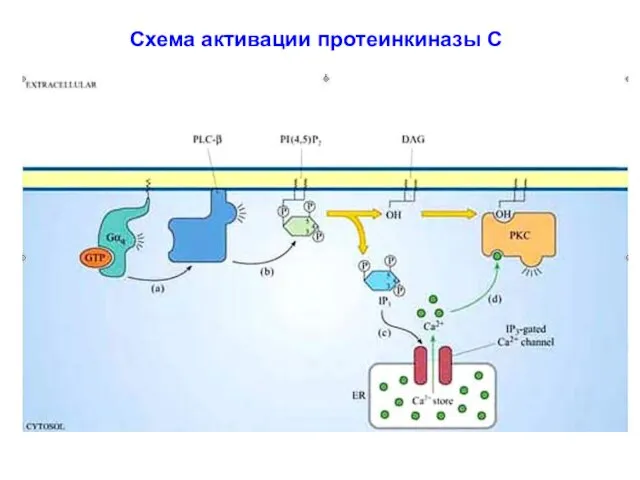
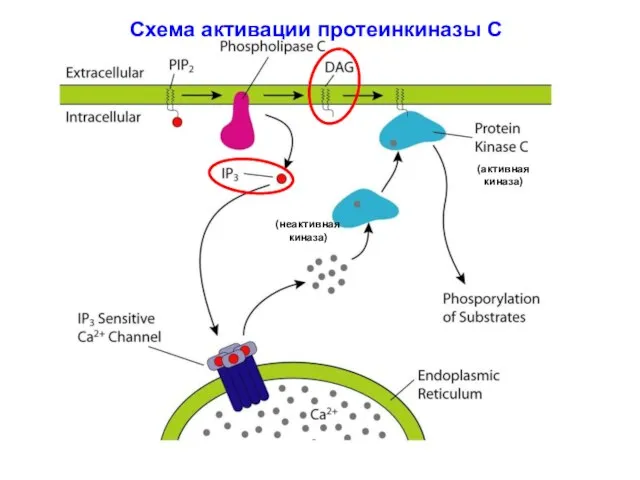
- 4. Са2+ / фосфоинозитоловая система сигнальной трансдукции GPCR Активация ФЛазы С, связанной с плазматической мембраной: специфический субстрат
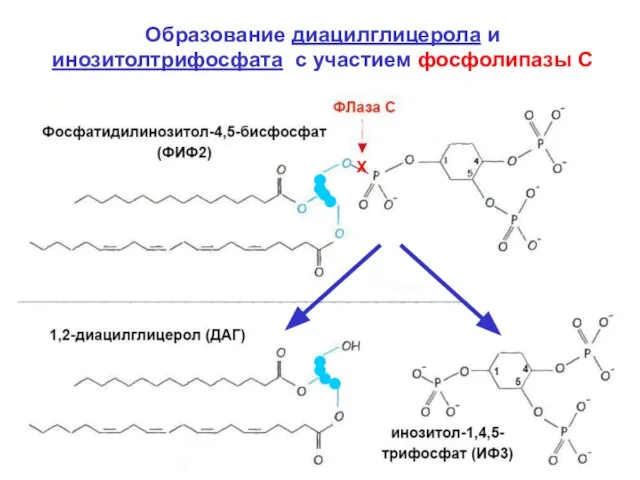
- 5. Образование диацилглицерола и инозитолтрифосфата с участием фосфолипазы С Х
- 6. Липид-модифицирующие ферменты Внутренний слой цитоплазматической мембраны – компартмент, где с участием липид модифицирующих ферментов (связаных с
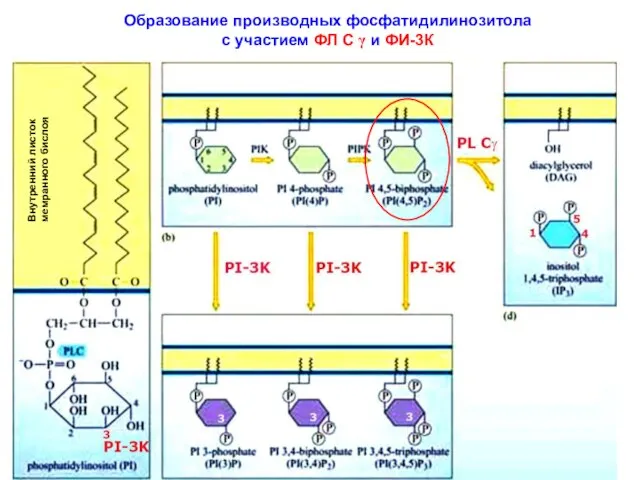
- 7. Образование производных фосфатидилинозитола с участием ФЛ С γ и ФИ-3К Внутренний листок мемранного бислоя
- 8. Жирнокислотные цепи молекулы ИФ внедрены в цитозольный слой плазматической мембраны. Его инозитольное кольцо проеци-ровано в сторону
- 9. Роль ФИ-3К в образовании PI(3,4,5)P3 и активации протеинкиназы В (ПКВ) ФЛаза С β удерживается на внутренней
- 10. Вторичные мессенджеры липидного происхождения: ДАГ и ИФ3 Вторичный мессенджер: инозитол-1,4,5-трифосфат (ИФ3). Гидрофилен благодаря –q, которые сообщают
- 11. Вторичный мессенджер: 1,2-диацилглицерол (ДАГ). Молекула гидрофобна, в силу чего остается во внутреннем слое клеточной мембраны. Благодаря
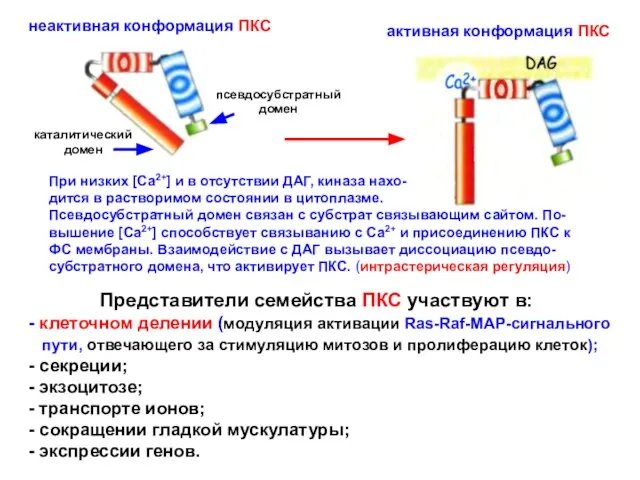
- 12. Схема активации протеинкиназы С
- 13. Схема активации протеинкиназы С (неактивная киназа) (активная киназа)
- 14. Структура и свойства ПКС Фермент является мономером с массой 77 кДа. Полипептидная цепь включает 670-690 аминокислотных
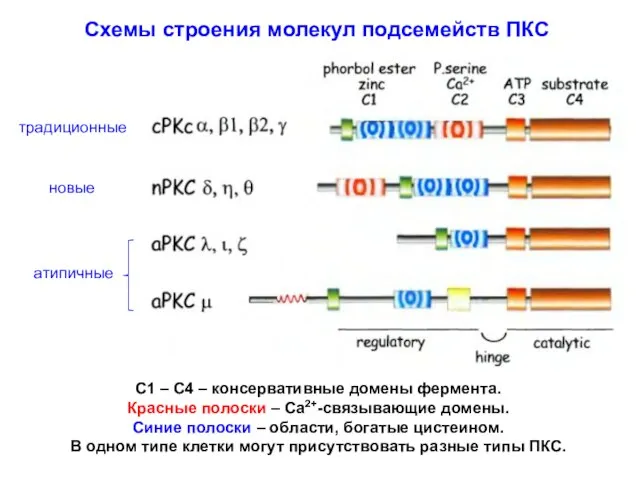
- 15. Схемы строения молекул подсемейств ПКС C1 – C4 – консервативные домены фермента. Красные полоски – Са2+-связывающие
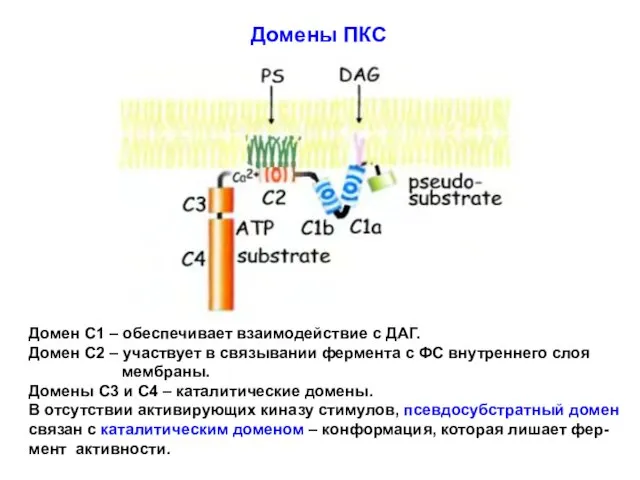
- 16. Домены ПКС Домен С1 – обеспечивает взаимодействие с ДАГ. Домен С2 – участвует в связывании фермента
- 17. Представители семейства ПКС участвуют в: - клеточном делении (модуляция активации Ras-Raf-MAP-сигнального пути, отвечающего за стимуляцию митозов
- 18. Одна из изоформ атипичной ПКС (ПКС-ζ) способна запускать сигнальный путь, опосредуемый ядерным транскрипционным фактором kB (NFkB).
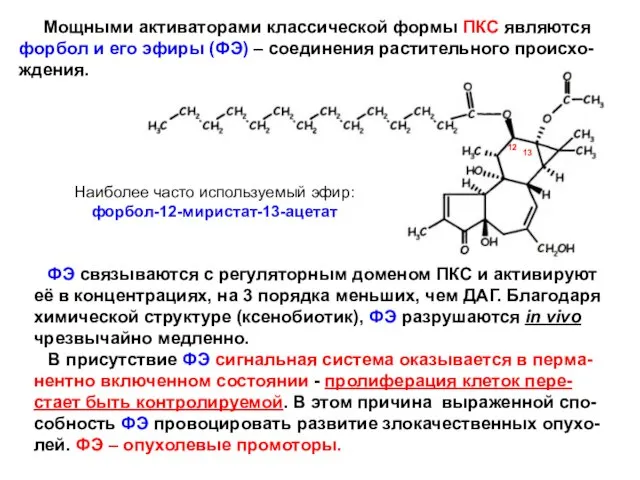
- 19. Мощными активаторами классической формы ПКС являются форбол и его эфиры (ФЭ) – соединения растительного происхо-ждения. Наиболее
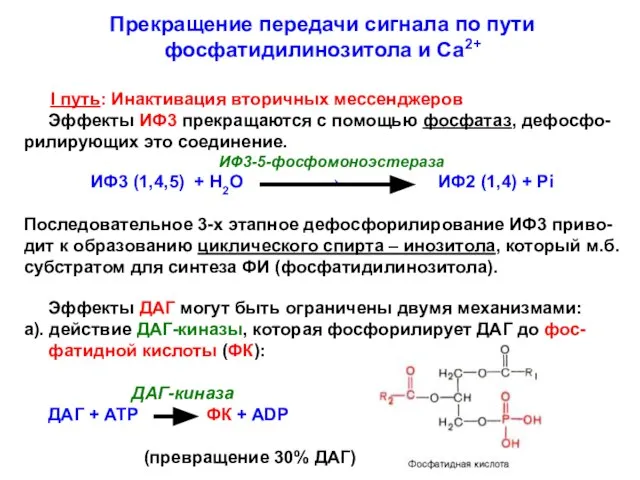
- 20. Прекращение передачи сигнала по пути фосфатидилинозитола и Са2+ I путь: Инактивация вторичных мессенджеров Эффекты ИФ3 прекращаются
- 21. б). Действие ДАГ-липазы - гидролиз мессенджера с отщеплением арахидоновой кислоты: ДАГ-липаза ДАГ + Н2О 2-арахидоноил-глицерол +
- 23. Скачать презентацию









 Витамины
Витамины В программе посещения 4 залов музея: 1. История развития Жизни на Земле. 2. Природные зоны Земли.
В программе посещения 4 залов музея: 1. История развития Жизни на Земле. 2. Природные зоны Земли. Возникновение и эволюция циркуляторных систем животных
Возникновение и эволюция циркуляторных систем животных Значение ракообразных в природе и жизни человека
Значение ракообразных в природе и жизни человека Опасные хищники планеты
Опасные хищники планеты Презентация на тему Земноводные общая характеристика и строение
Презентация на тему Земноводные общая характеристика и строение Вегетативное размножение комнатных растений
Вегетативное размножение комнатных растений Общая характеристика галогенов.
Общая характеристика галогенов. Общая экология. (Лекция 3)
Общая экология. (Лекция 3) Плоские черви – паразиты человека и животных
Плоские черви – паразиты человека и животных  Зоология— наука о животных
Зоология— наука о животных Усложнения в Эволюции. Формы отбора. Помехоустойчивость. Искусственный отбор
Усложнения в Эволюции. Формы отбора. Помехоустойчивость. Искусственный отбор Обмен вещеста
Обмен вещеста Класс земноводные (амфибии) Земноводные – исторически первый класс наземных позвоночных или, как их еще называют, четвероногих. П
Класс земноводные (амфибии) Земноводные – исторически первый класс наземных позвоночных или, как их еще называют, четвероногих. П Терпены и терпеноиды
Терпены и терпеноиды Решение генетических задач. Анализ и составление родословных
Решение генетических задач. Анализ и составление родословных Исследование чувствительности
Исследование чувствительности Презентация на тему Арахнология
Презентация на тему Арахнология  Лишайники Особенности, многообразие и значение
Лишайники Особенности, многообразие и значение Красная книга Крыма
Красная книга Крыма Презентация на тему "Всем вам знакомые разнообразные насекомые" - скачать презентации по Биологии
Презентация на тему "Всем вам знакомые разнообразные насекомые" - скачать презентации по Биологии Рептилии пригородного леса г. Железногорск
Рептилии пригородного леса г. Железногорск Синичкин день
Синичкин день Органы кровообращения
Органы кровообращения Движущий и направляющий фактор эволюции
Движущий и направляющий фактор эволюции Иммунитет Виды иммунитета
Иммунитет Виды иммунитета  Растительные сообщества
Растительные сообщества Роль кожи в терморегуляции организма
Роль кожи в терморегуляции организма