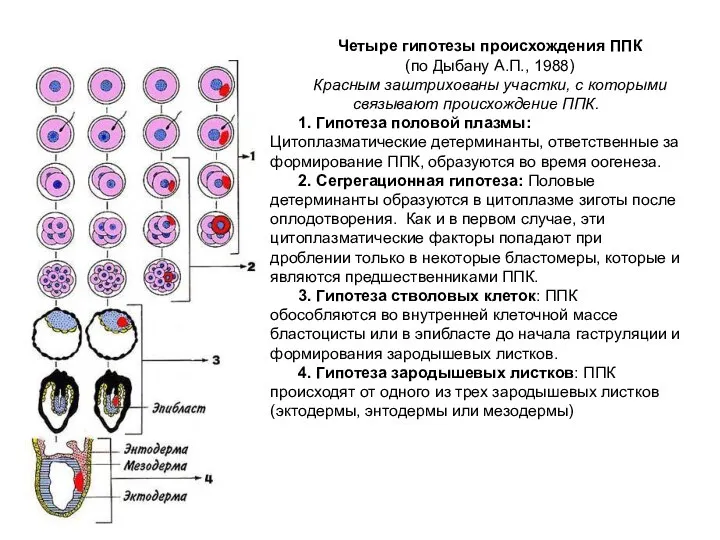
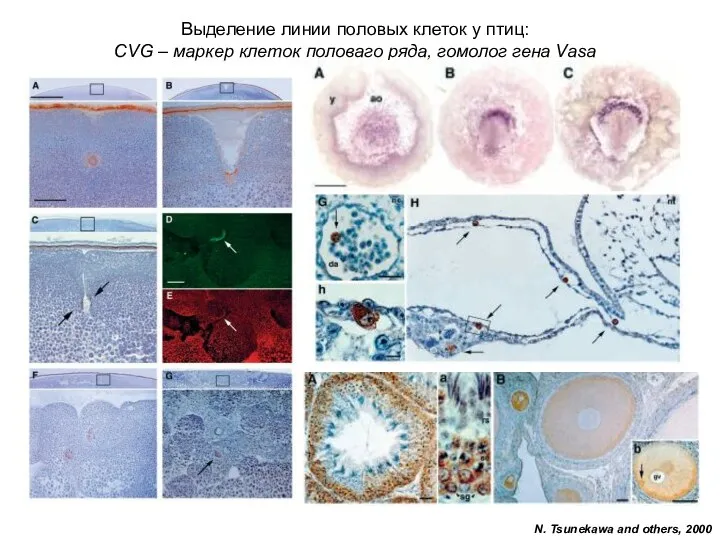
Содержание
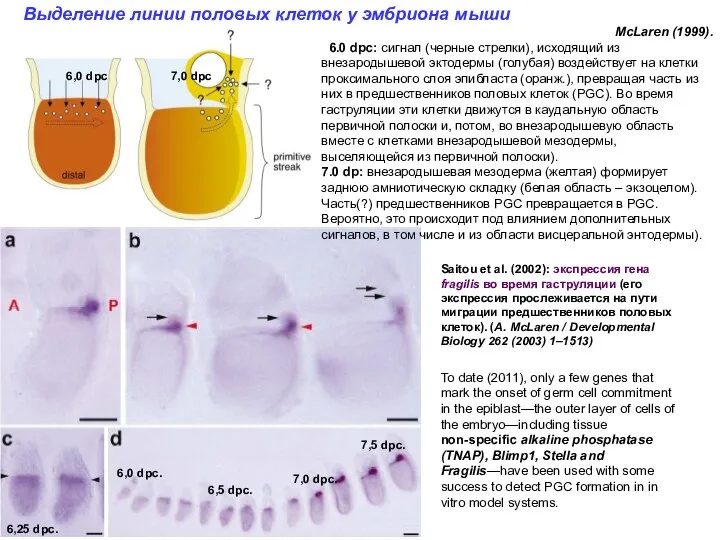
- 4. Saitou et al. (2002): экспрессия гена fragilis во время гаструляции (его экспрессия прослеживается на пути миграции
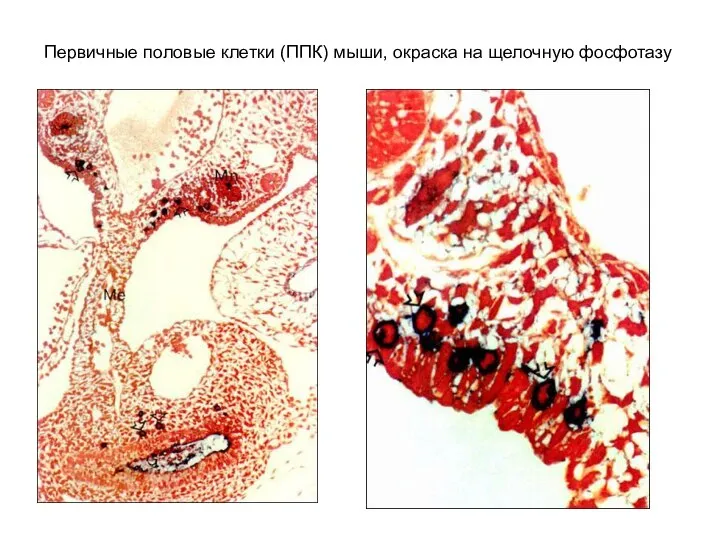
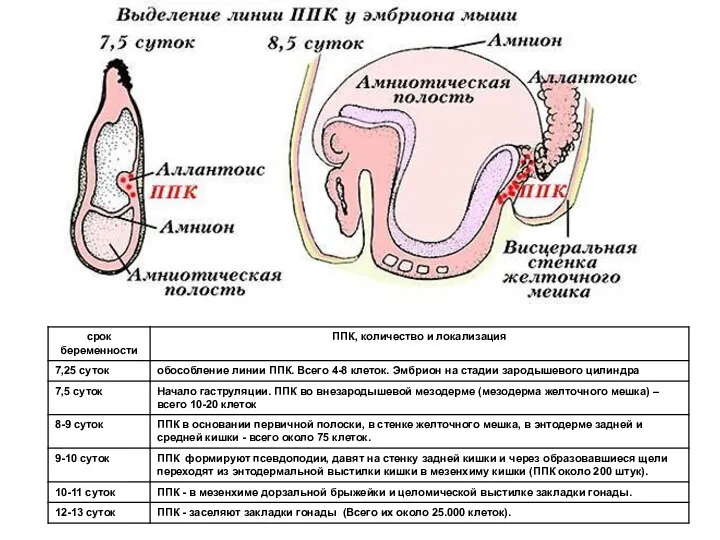
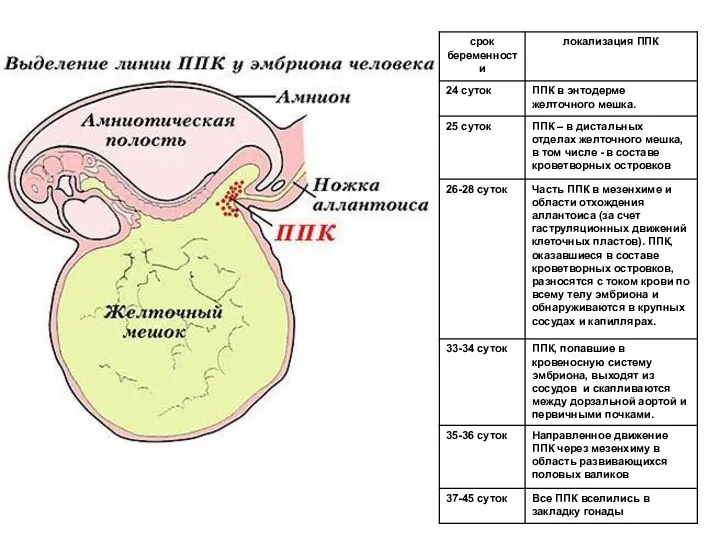
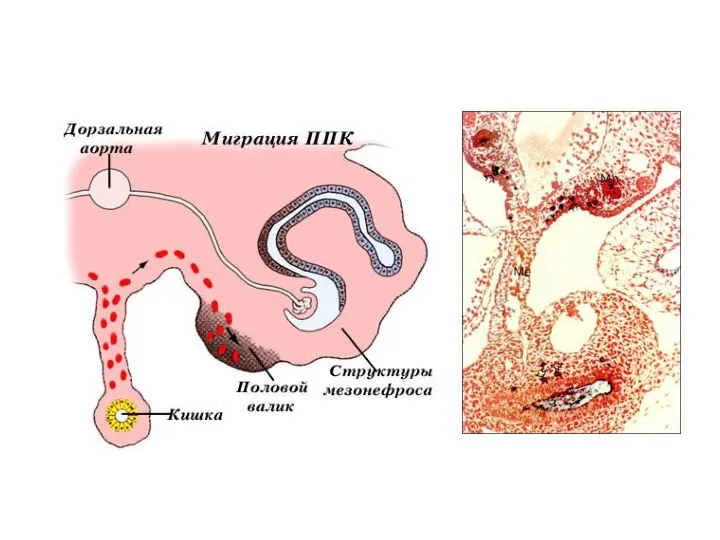
- 5. Первичные половые клетки (ППК) мыши, окраска на щелочную фосфотазу
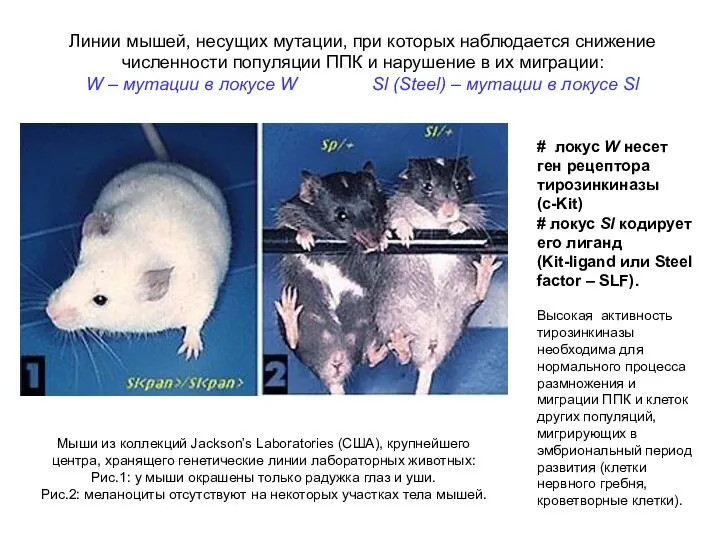
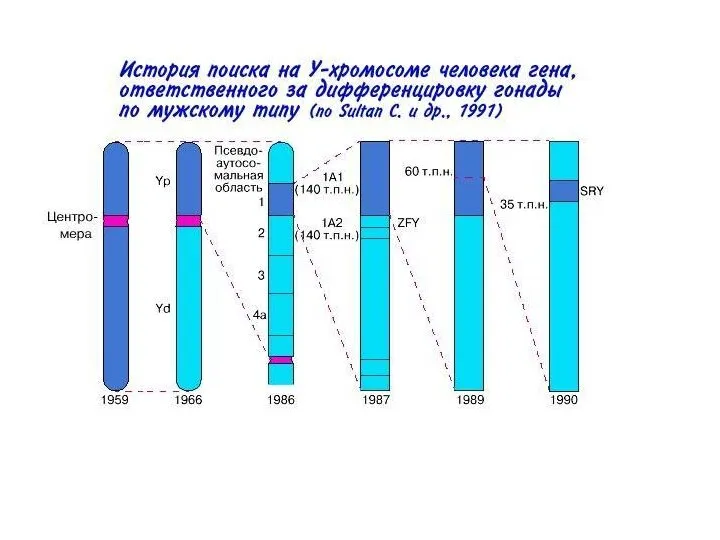
- 8. Мыши из коллекций Jackson’s Laboratories (США), крупнейшего центра, хранящего генетические линии лабораторных животных: Рис.1: у мыши
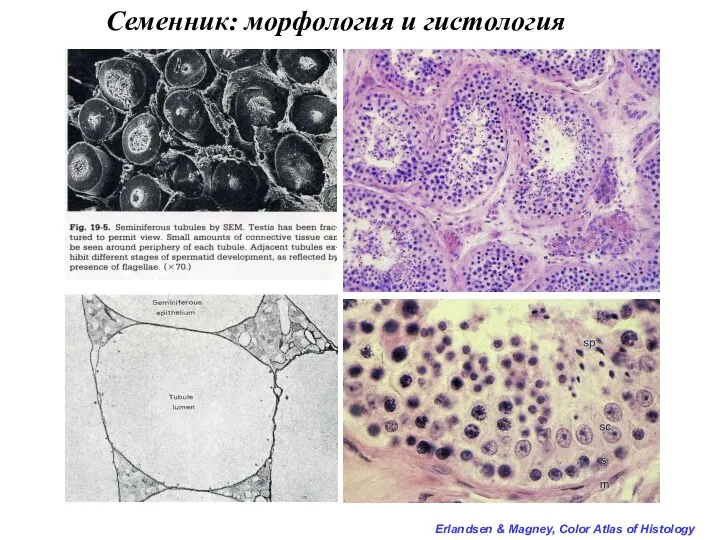
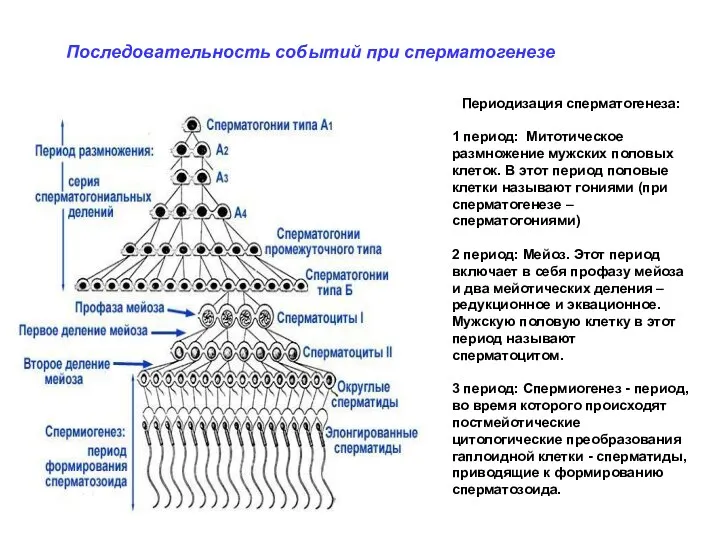
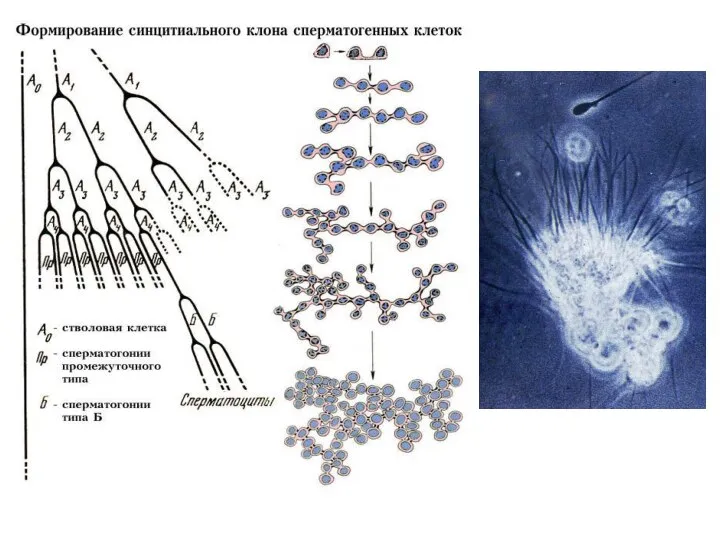
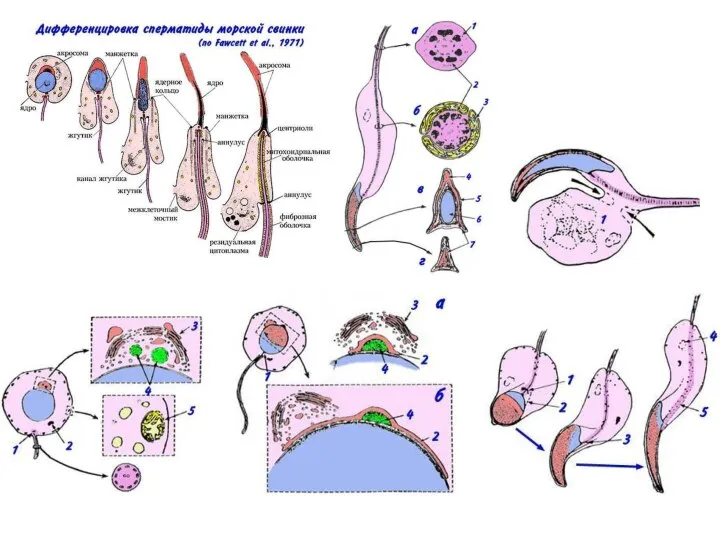
- 10. С П Е Р М А Т О Г Е Н Е З
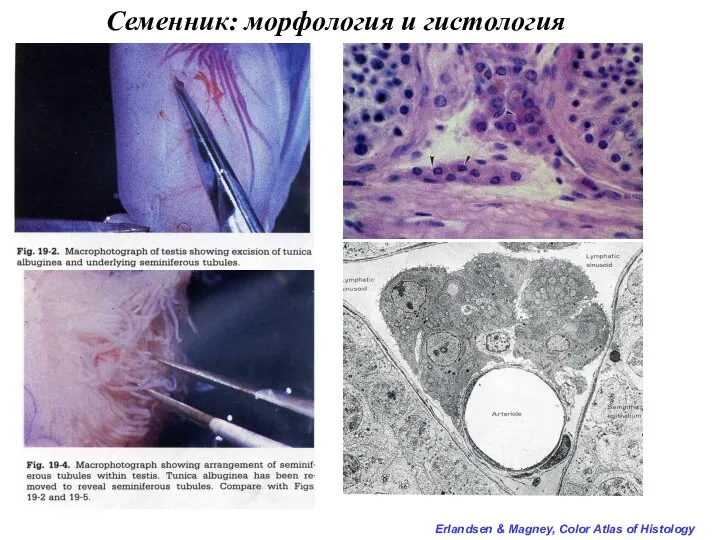
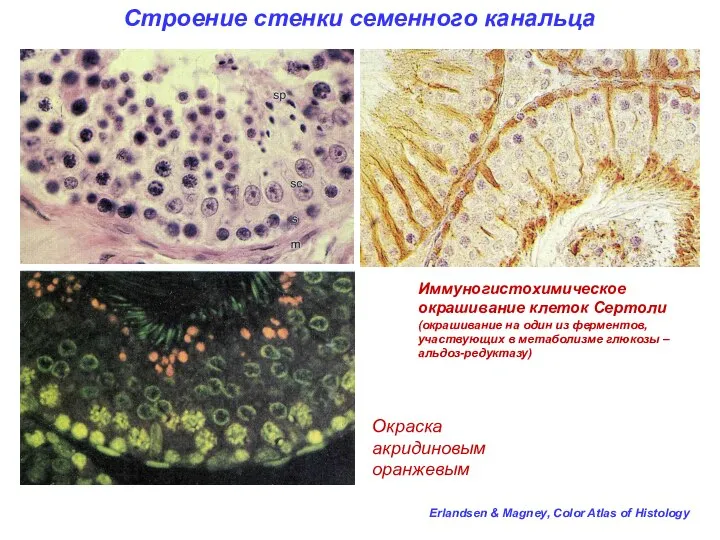
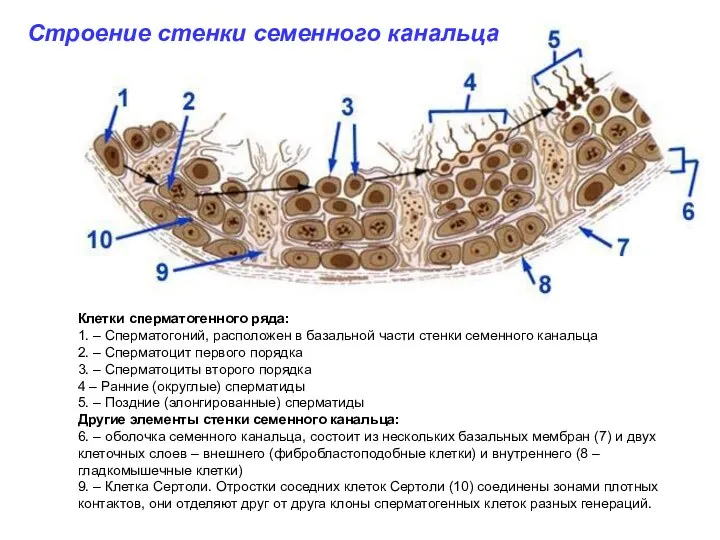
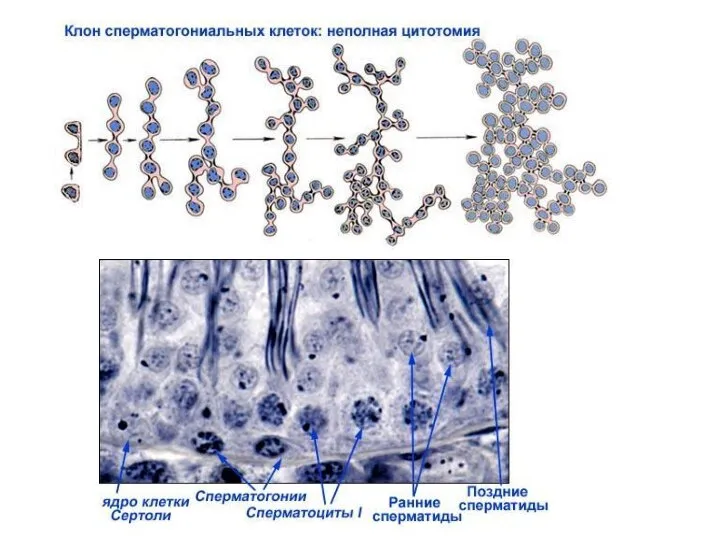
- 15. Строение стенки семенного канальца Окраска акридиновым оранжевым Erlandsen & Magney, Color Atlas of Histology Иммуногистохимическое окрашивание
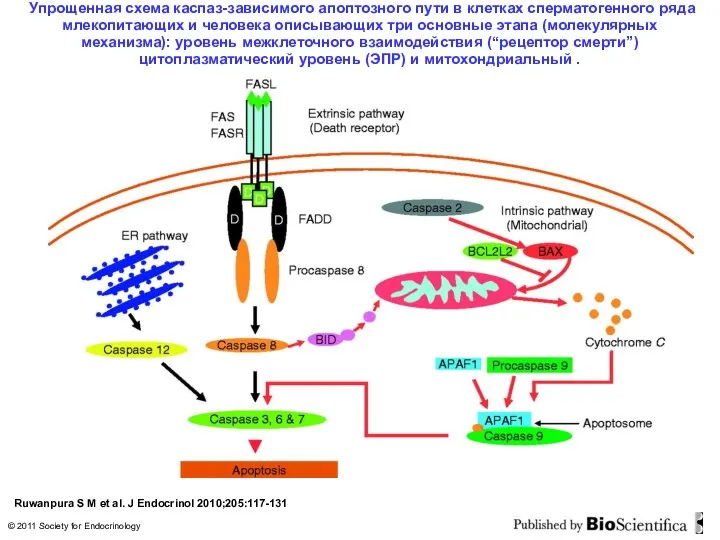
- 17. Упрощенная схема каспаз-зависимого апоптозного пути в клетках сперматогенного ряда млекопитающих и человека описывающих три основные этапа
- 18. Периодизация сперматогенеза: 1 период: Митотическое размножение мужских половых клеток. В этот период половые клетки называют гониями
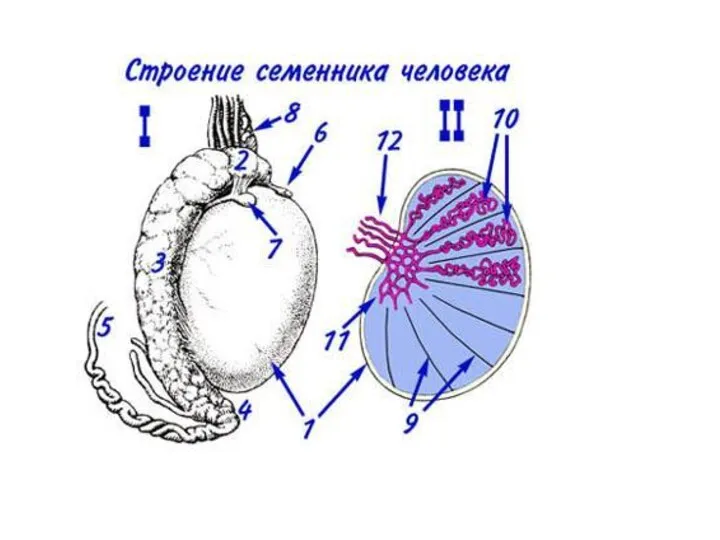
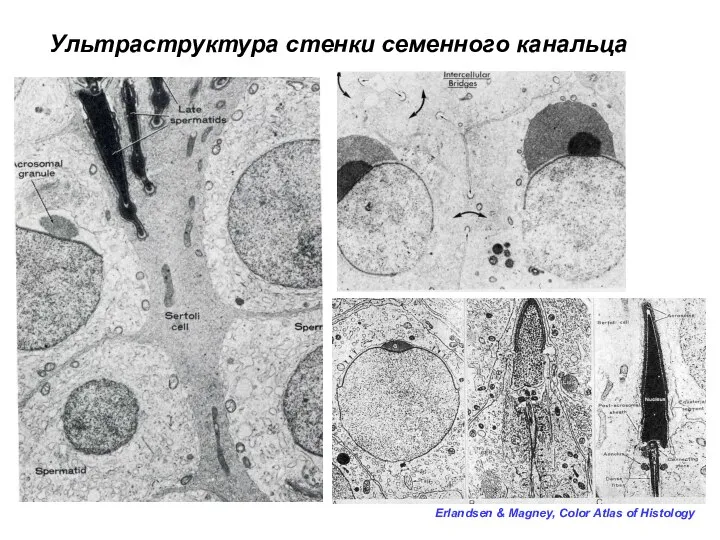
- 21. Erlandsen & Magney, Color Atlas of Histology Ультраструктура стенки семенного канальца
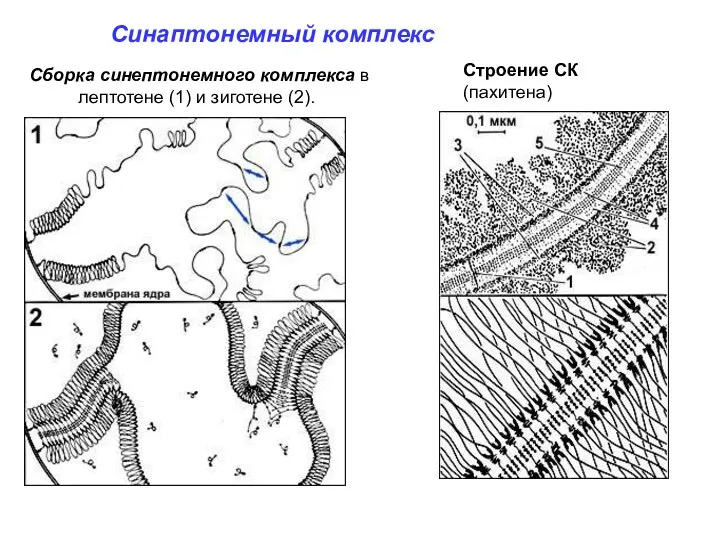
- 24. Синаптонемный комплекс Сборка синептонемного комплекса в лептотене (1) и зиготене (2). Строение СК (пахитена)
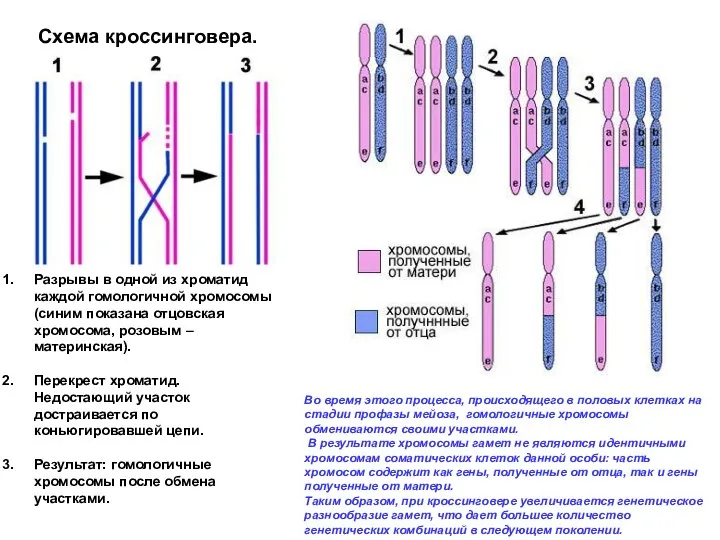
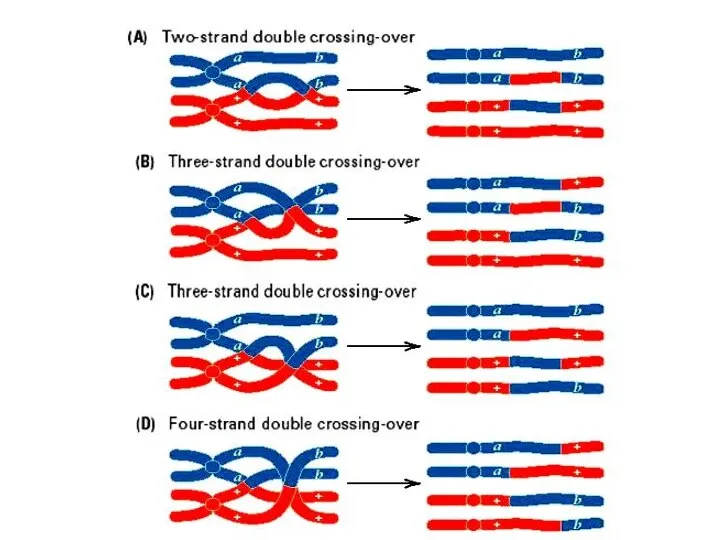
- 25. Разрывы в одной из хроматид каждой гомологичной хромосомы (синим показана отцовская хромосома, розовым – материнская). Перекрест
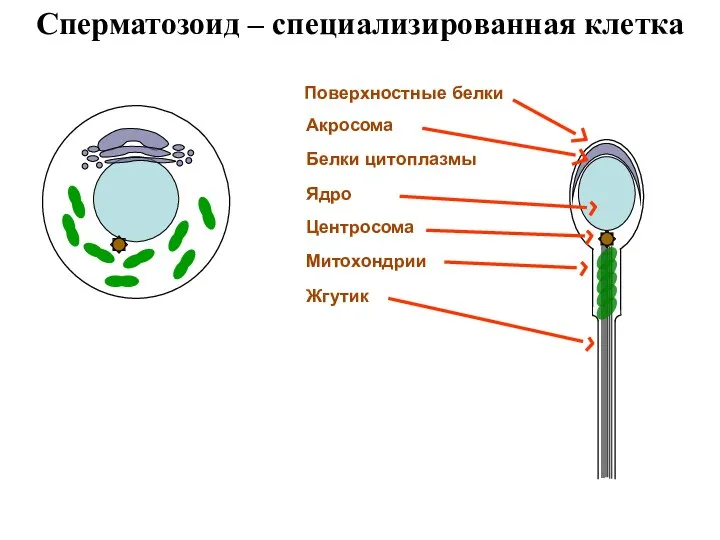
- 28. Сперматозоид – специализированная клетка Поверхностные белки Акросома Ядро Белки цитоплазмы Центросома Митохондрии Жгутик
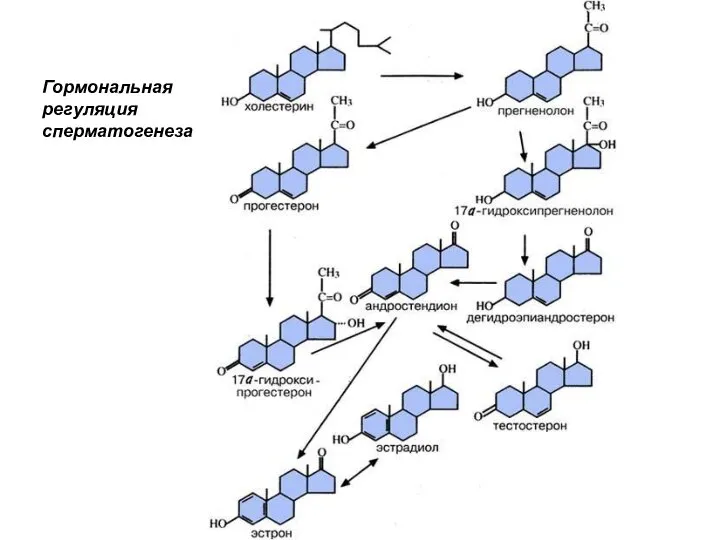
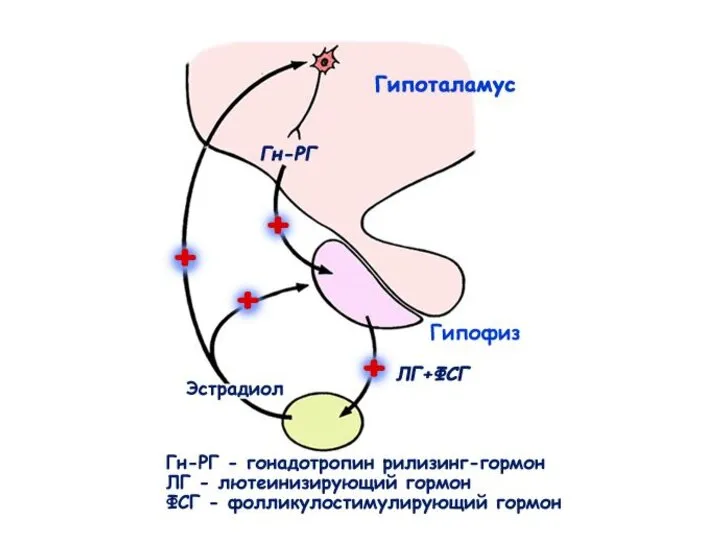
- 29. Гормональная регуляция сперматогенеза
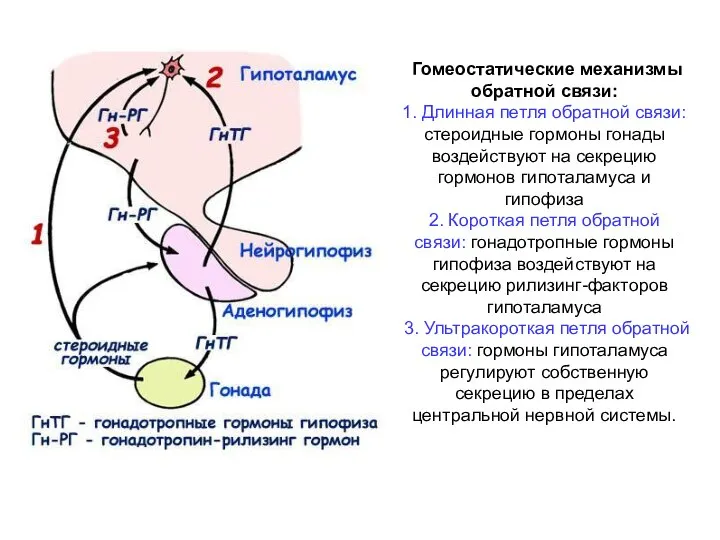
- 30. Гомеостатические механизмы обратной связи: 1. Длинная петля обратной связи: стероидные гормоны гонады воздействуют на секрецию гормонов
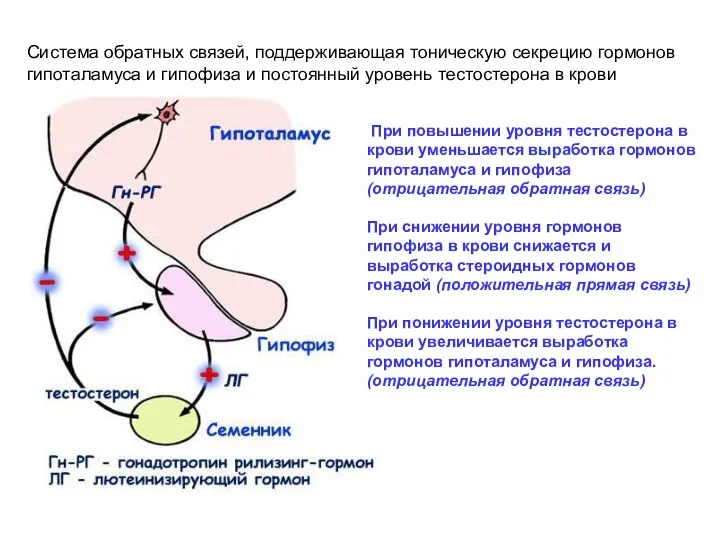
- 31. Система обратных связей, поддерживающая тоническую секрецию гормонов гипоталамуса и гипофиза и постоянный уровень тестостерона в крови
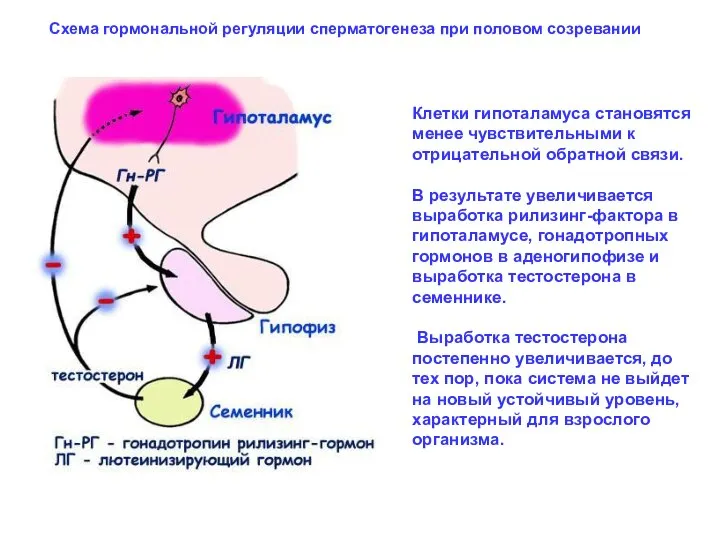
- 32. Схема гормональной регуляции сперматогенеза при половом созревании Клетки гипоталамуса становятся менее чувствительными к отрицательной обратной связи.
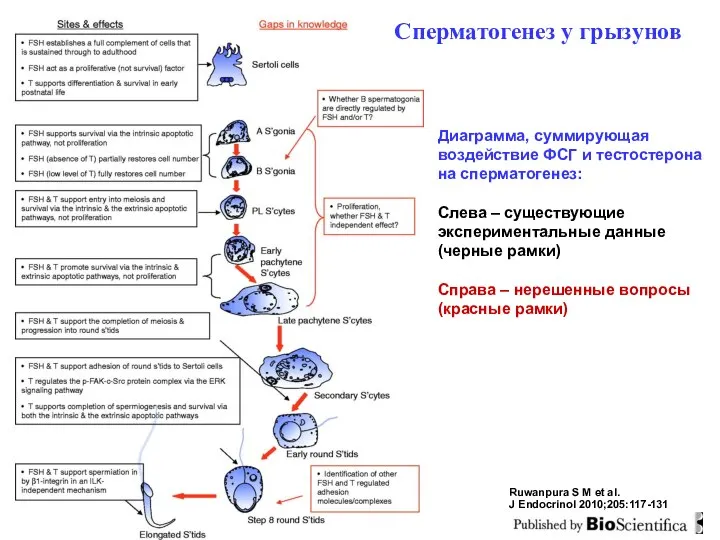
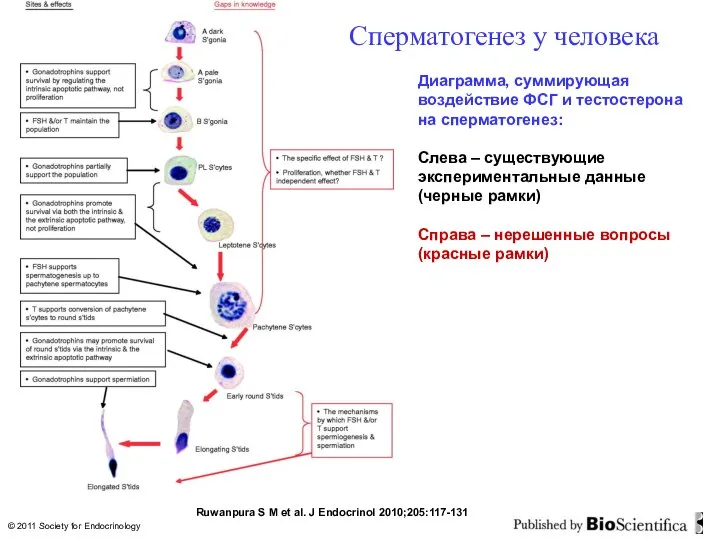
- 33. Ruwanpura S M et al. J Endocrinol 2010;205:117-131 Сперматогенез у грызунов Диаграмма, суммирующая воздействие ФСГ и
- 34. Ruwanpura S M et al. J Endocrinol 2010;205:117-131 © 2011 Society for Endocrinology Сперматогенез у человека
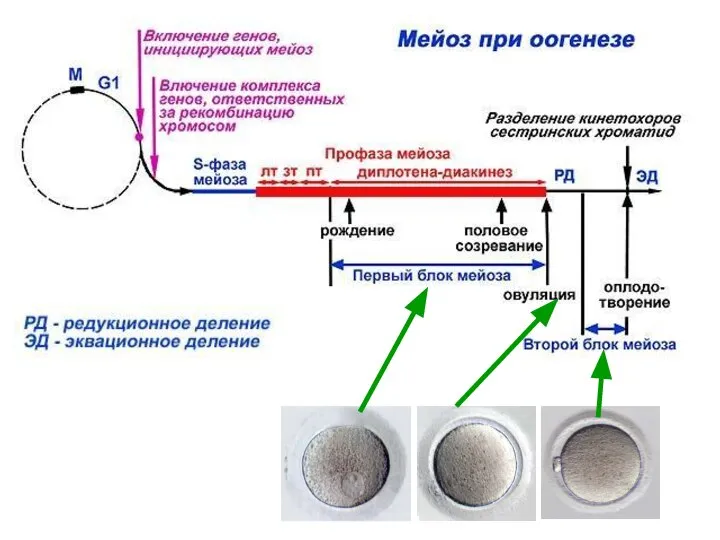
- 35. О О Г Е Н Е З
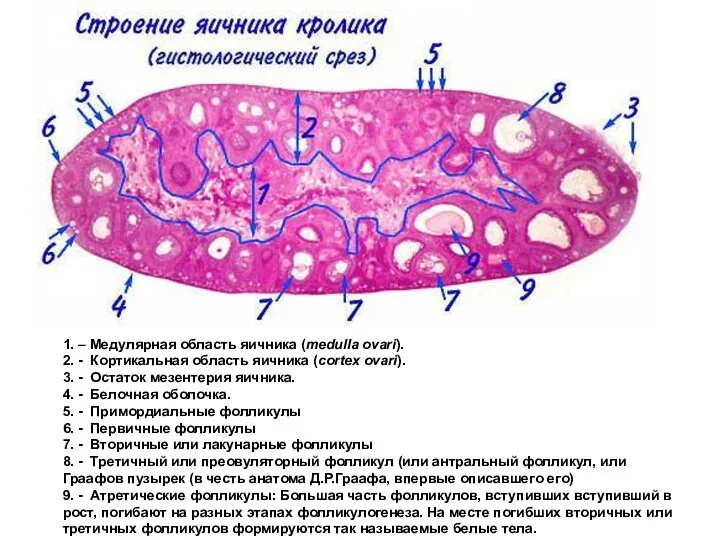
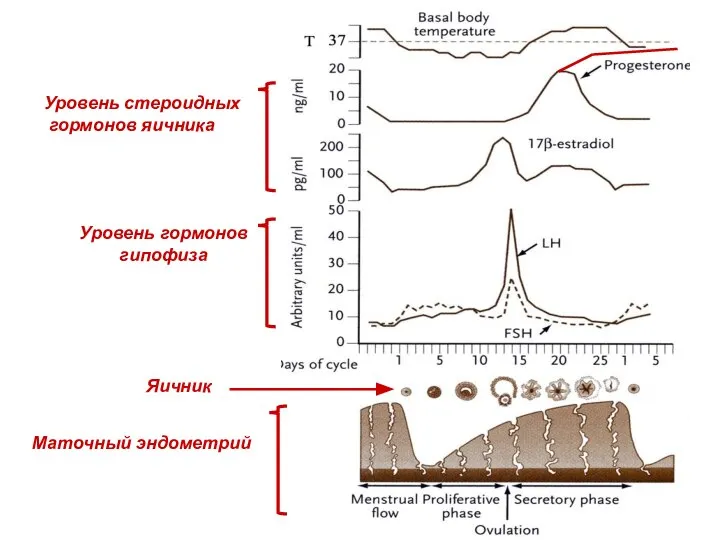
- 36. 1. – Медулярная область яичника (medulla ovari). 2. - Кортикальная область яичника (cortex ovari). 3. -
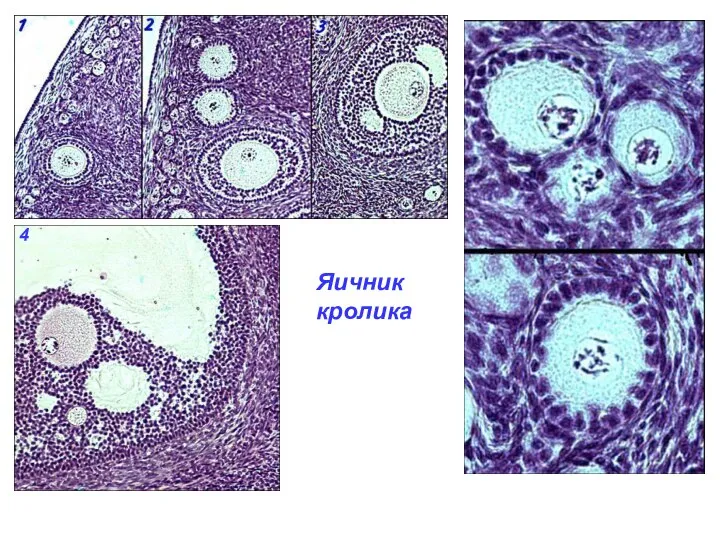
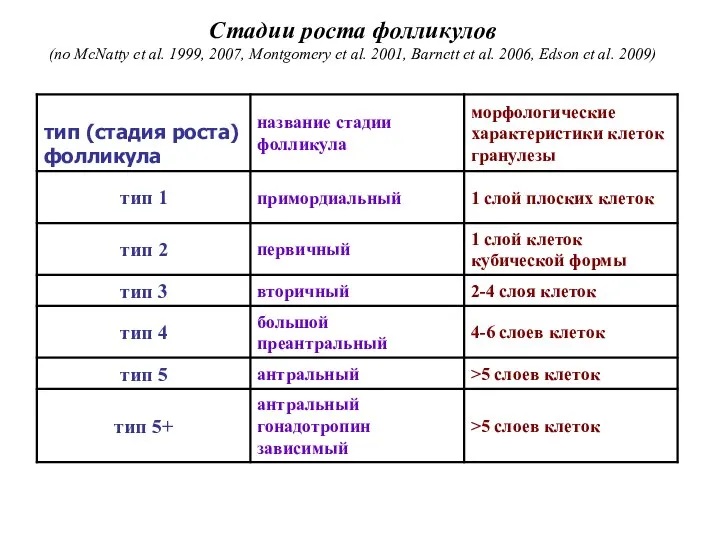
- 38. Стадии роста фолликулов (по McNatty et al. 1999, 2007, Montgomery et al. 2001, Barnett et al.
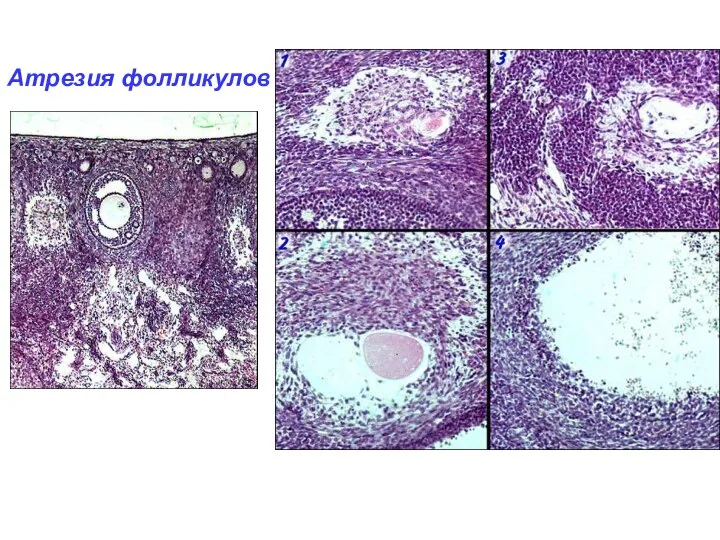
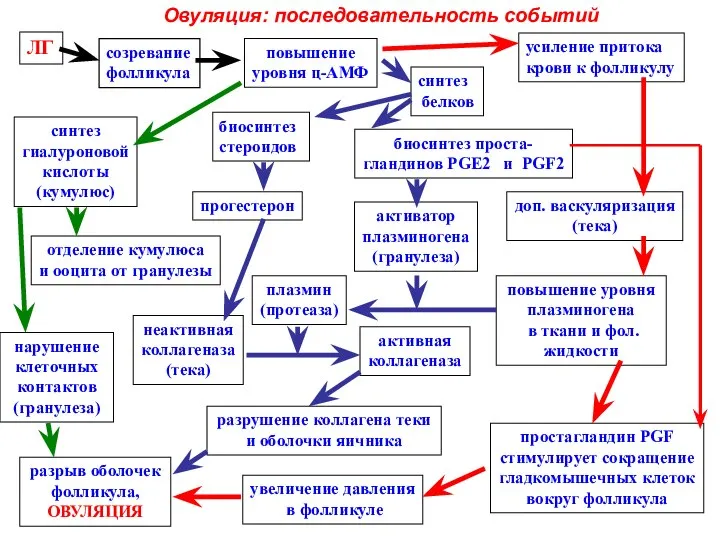
- 39. Атрезия фолликулов
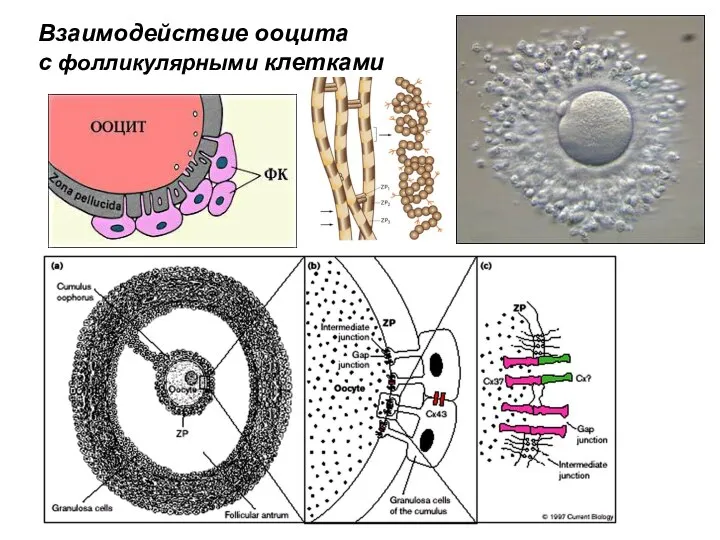
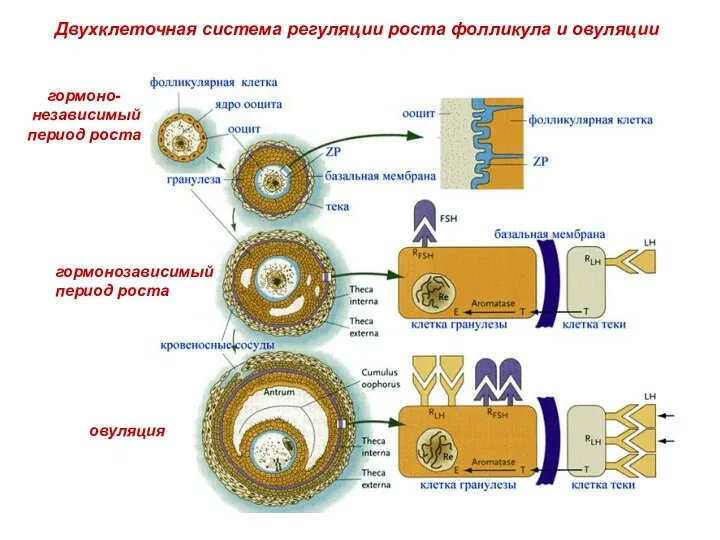
- 42. Взаимодействие ооцита с фолликулярными клетками
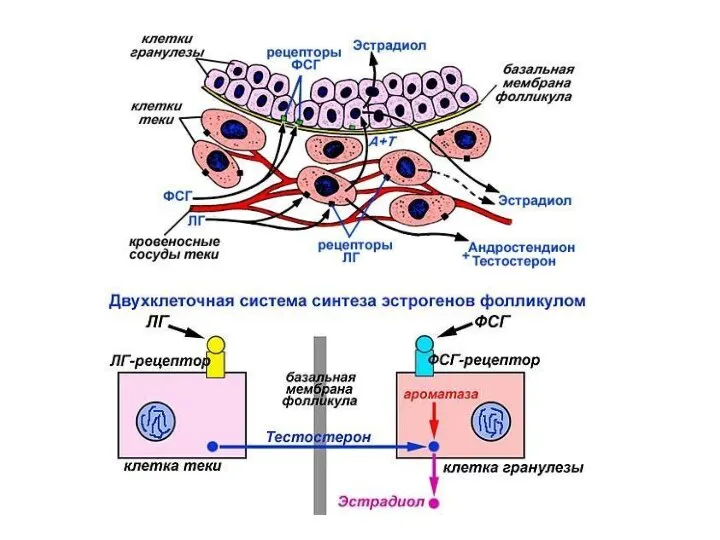
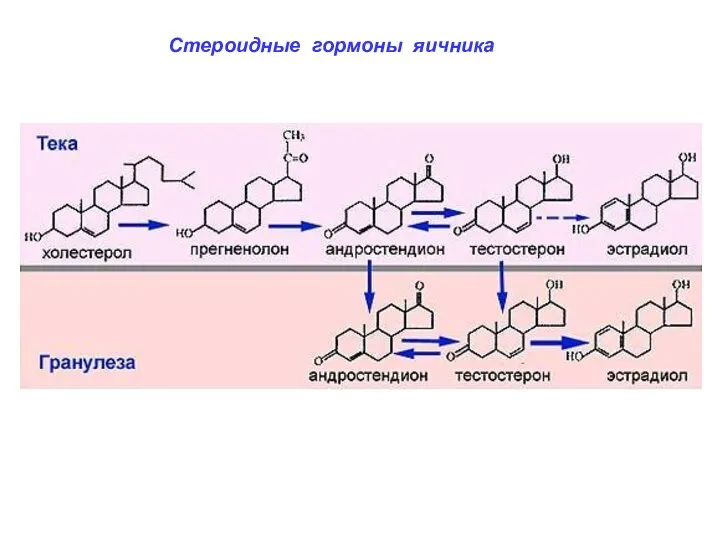
- 45. Стероидные гормоны яичника
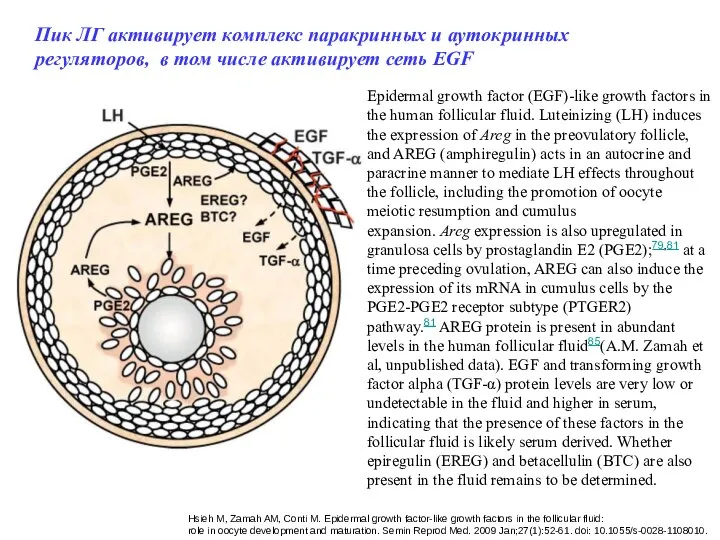
- 47. Epidermal growth factor (EGF)-like growth factors in the human follicular fluid. Luteinizing (LH) induces the expression
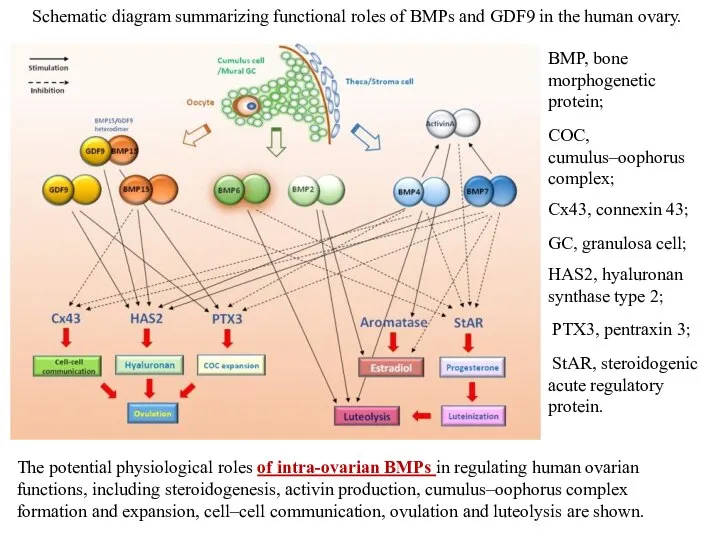
- 48. The potential physiological roles of intra-ovarian BMPs in regulating human ovarian functions, including steroidogenesis, activin production,
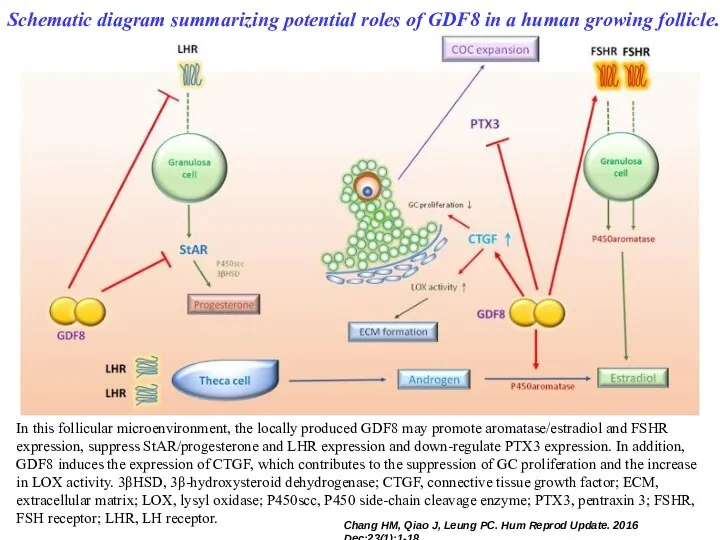
- 49. Schematic diagram summarizing potential roles of GDF8 in a human growing follicle. In this follicular microenvironment,
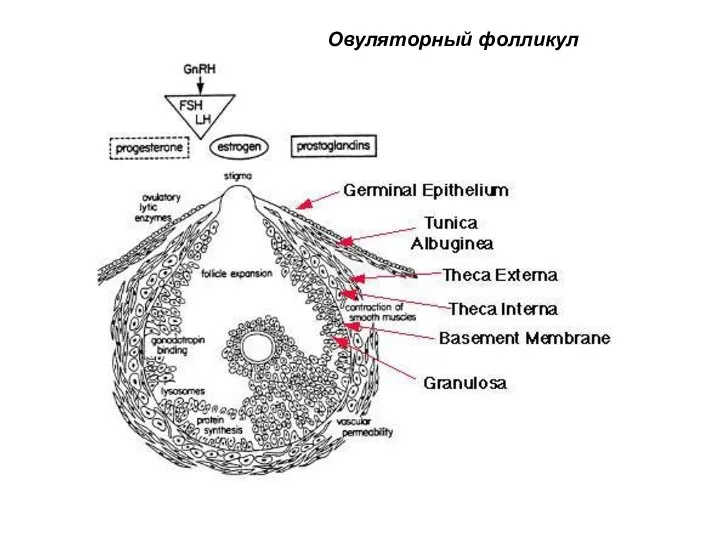
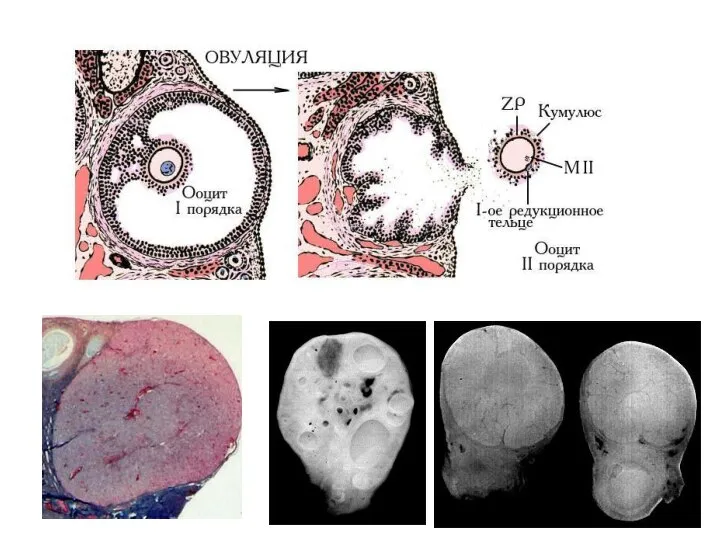
- 52. Овуляторный фолликул
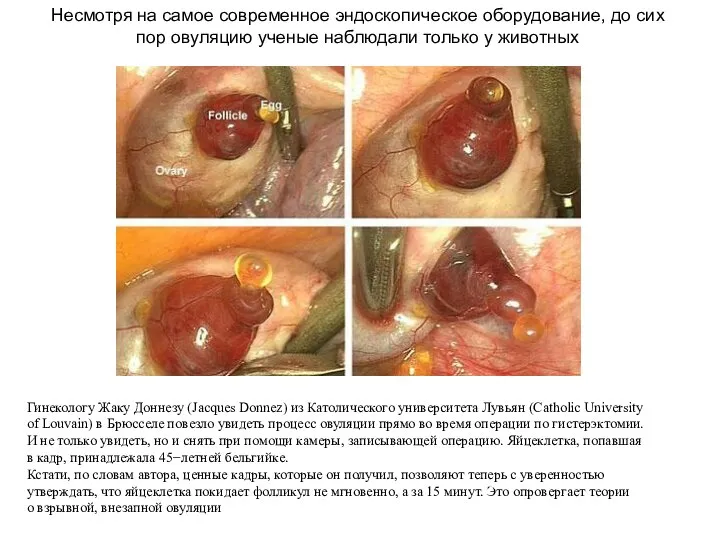
- 53. Гинекологу Жаку Доннезу (Jacques Donnez) из Католического университета Лувьян (Catholic University of Louvain) в Брюсселе повезло
- 55. Морфология ооцита человека (клиническая практика ВРТ) Ооцит с зародышевым пузырьком (germinal vesicule): диплотена-диакинез профазы мейоза (2n4c)
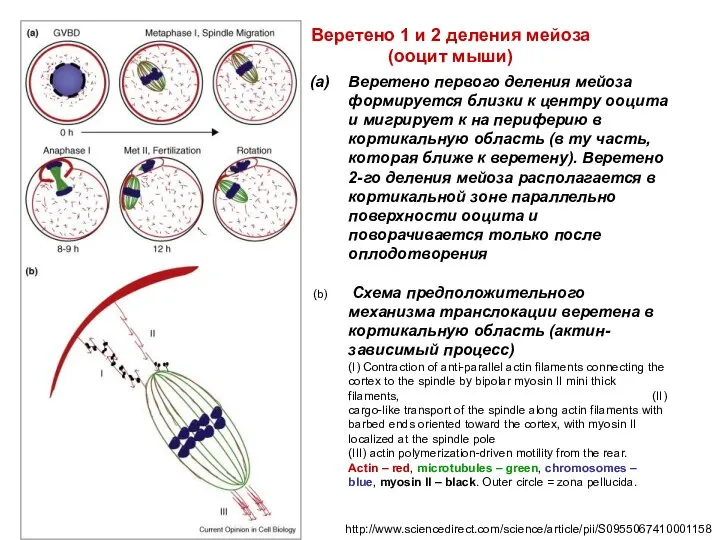
- 56. http://www.sciencedirect.com/science/article/pii/S0955067410001158 Веретено первого деления мейоза формируется близки к центру ооцита и мигрирует к на периферию в
- 58. Скачать презентацию

 Мутационная изменчивость
Мутационная изменчивость Живые системы. Лекция 6
Живые системы. Лекция 6 Основы цитологии
Основы цитологии Автор: Нагаева Даша, ученица 2 класса Онохойской нош-д/с «Белочка» Заиграевского района Домашний адрес: п. Онохой, ул. Путейская
Автор: Нагаева Даша, ученица 2 класса Онохойской нош-д/с «Белочка» Заиграевского района Домашний адрес: п. Онохой, ул. Путейская  ГЕНЕТИЧНО-МОДИФІКОВАНІ ОРГАНІЗМИ - ЦЕ ТАКІ ОРГАНІЗМИ, В ЯКІ ДОДАЮТЬ ІНШІ ГЕНИ – РОСЛИН ЧИ ТВАРИН. ЦЕ ЗМІНЮЄ ВЛАСТИВОСТІ РОСЛ
ГЕНЕТИЧНО-МОДИФІКОВАНІ ОРГАНІЗМИ - ЦЕ ТАКІ ОРГАНІЗМИ, В ЯКІ ДОДАЮТЬ ІНШІ ГЕНИ – РОСЛИН ЧИ ТВАРИН. ЦЕ ЗМІНЮЄ ВЛАСТИВОСТІ РОСЛ Выполнила: ученица 7а класса Горобец Ксения.
Выполнила: ученица 7а класса Горобец Ксения. Презентация на тему "Развитие животных с превращением и без превращения" - скачать презентации по Биологии
Презентация на тему "Развитие животных с превращением и без превращения" - скачать презентации по Биологии Надкласс Рыбы
Надкласс Рыбы Проверка домашнего задания: Укажите какие утверждения верны. Все микробы- бактерии. Все заболевания человека вызываются бактери
Проверка домашнего задания: Укажите какие утверждения верны. Все микробы- бактерии. Все заболевания человека вызываются бактери Презентация на тему "Дрожжи" - скачать презентации по Биологии
Презентация на тему "Дрожжи" - скачать презентации по Биологии Надцарство Эукариоты Царство Бактерии (Дробянки)
Надцарство Эукариоты Царство Бактерии (Дробянки) Разнообразие земноводных Автор: Бажутова Н. В., учитель начальных классов ГБОУ СОШ № 546
Разнообразие земноводных Автор: Бажутова Н. В., учитель начальных классов ГБОУ СОШ № 546 На что способен наш мозг...
На что способен наш мозг... Генетика антитіл. Схема будови антитіла
Генетика антитіл. Схема будови антитіла Ритмы сна и бодрствования
Ритмы сна и бодрствования Удивительные ягоды красного цвета
Удивительные ягоды красного цвета Вирусы и бактерии
Вирусы и бактерии Сон и бодрствование
Сон и бодрствование В мире животных. Игра по биологии для 7 – 8 классов
В мире животных. Игра по биологии для 7 – 8 классов Природные зоны Африки
Природные зоны Африки Совоподібні
Совоподібні Распознавание хвойных растений по силуэту
Распознавание хвойных растений по силуэту Особенности строения ферментов
Особенности строения ферментов Сельскохозяйственные биотехнологии
Сельскохозяйственные биотехнологии Чёрный аист
Чёрный аист Самые редкие породы кошек В список самых редких пород кошек попали и молодые гибридные породы и породы с вековой историей. Все
Самые редкие породы кошек В список самых редких пород кошек попали и молодые гибридные породы и породы с вековой историей. Все  Взаимодействие неаллельных генов
Взаимодействие неаллельных генов Селекция микроорганизмов и биотехнология
Селекция микроорганизмов и биотехнология