Содержание
- 2. В Б О М С Д Ж Н Г Т У З М Е В Ы
- 3. Задание: Из букв правильных ответов определите название класса веществ О С Т Ы Л К И
- 4. КИСЛОТЫ Орлова В.Н. Учитель химии и биологии МАОУ «Гимназия Тарасовка»
- 5. Цели урока Сформировать понятие о кислотах. Рассмотреть состав, название, классификацию кислот. Познакомиться с представителями неорганических кислот.
- 6. Кислоты вокруг нас
- 7. Кислоты вокруг нас
- 8. Кислоты вокруг нас
- 9. Кислоты вокруг нас
- 10. Кислоты в организме человека Аскорбиновая кислота – источник витамина С Фолиевая кислота – жизненно важный витамин
- 11. Формулы и названия некоторых кислот HCl HNO3 HNO2 H2S H2SO4 H2SO3 H2CO3 H2SiO3 H3PO4 Соляная (хлороводородная)
- 12. Кислоты - это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка HxR
- 13. X I HxR
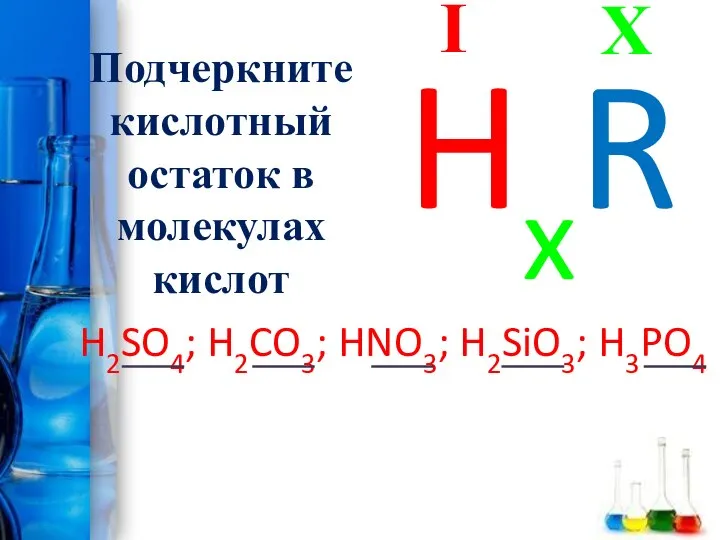
- 14. Подчеркните кислотный остаток в молекулах кислот H2SO4; H2CO3; HNO3; H2SiO3; H3PO4 X I HxR
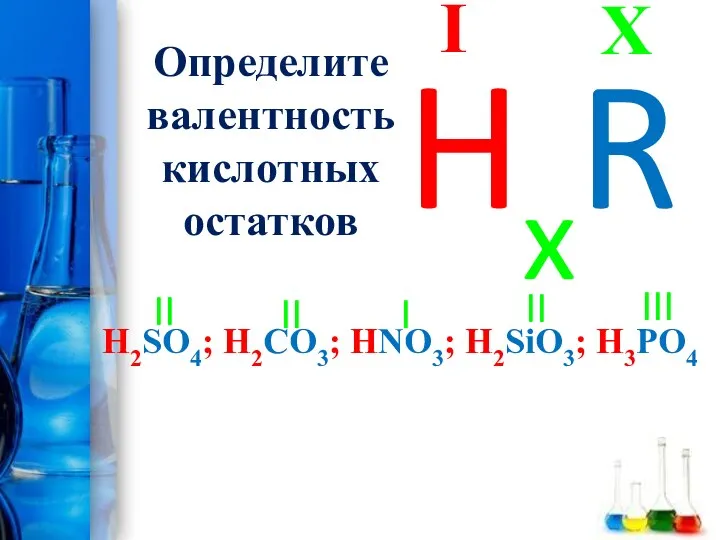
- 15. Определите валентность кислотных остатков H2SO4; H2CO3; HNO3; H2SiO3; H3PO4 X I HxR II III I II
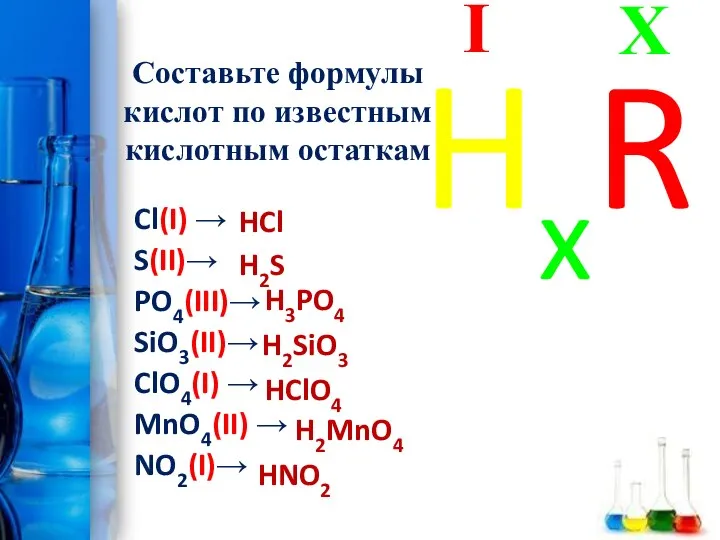
- 16. Составьте формулы кислот по известным кислотным остаткам Cl(I) → S(II)→ PO4(III)→ SiO3(II)→ ClO4(I) → MnO4(II) →
- 17. Классификация кислот По какому признаку кислоты разделены на группы HNO3 - азотная HNO2 - азотистая HClO4
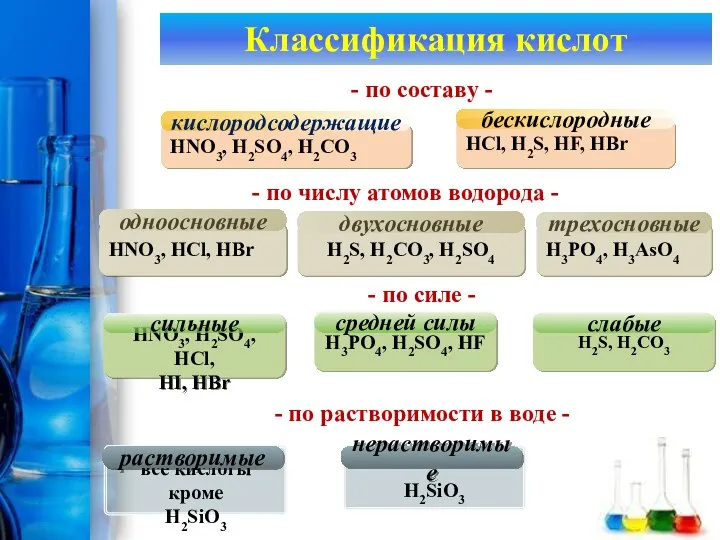
- 18. Классификация кислот HNO3, H2SO4, H2CO3 кислородсодержащие HCl, H2S, HF, HBr бескислородные - по составу -
- 19. Классификация кислот HF - фтороводородная HCl - хлороводородная HBr - бромоводородная HI - йодоводородная HNO3 -
- 20. Классификация кислот HNO3, HCl, HBr одноосновные HNO3, H2SO4, H2CO3 кислородсодержащие HCl, H2S, HF, HBr бескислородные -
- 21. Классификация кислот HNO3, HCl, HBr одноосновные HNO3, H2SO4, HCl, HI, HBr сильные HNO3, H2SO4, H2CO3 кислородсодержащие
- 22. Общие химические свойства кислот Опыт №1. Действие кислот на индикаторы Опыт №2. Взаимодействие кислот с основаниями
- 23. Опыт №3. Взаимодействие кислот с оксидами металлов Кислота + оксид металла = соль + вода H2SO4
- 24. Опыт №4. Взаимодействие кислот с солями Кислота + соль = новая соль + новая кислота H2SO4
- 25. Это интересно!
- 26. Закрепление! 1. Найдите группу формул кислот: 2. Выберите формулу «третьего лишнего» вещества в каждом ряду: HCl
- 27. 3. Даны вещества: Закрепление! CuF2 Расположите их в таком порядке, чтобы внизу получилось название индикатора. KCl
- 28. Домашнее задание: § 32 упр. 2, 7 ,8 подготовиться к химическому диктанту
- 30. Скачать презентацию











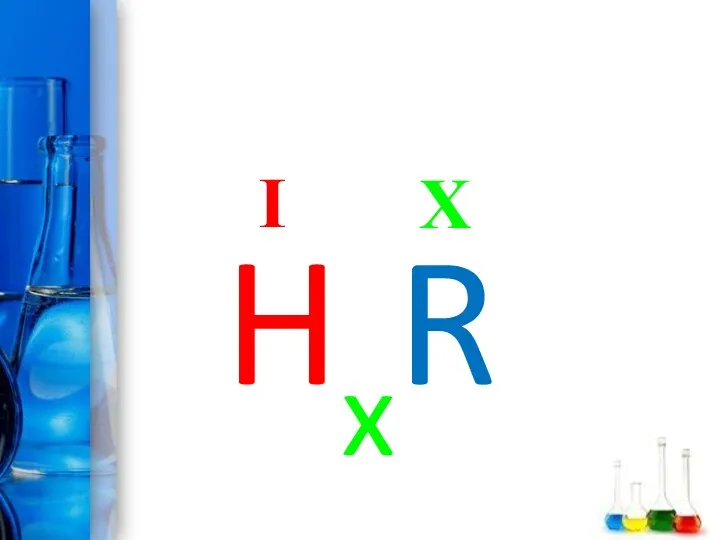











 Введение в медицинскую генетику
Введение в медицинскую генетику Презентация по биологии Отдел моховидные
Презентация по биологии Отдел моховидные  Развитие осевого скелета. Тема 3
Развитие осевого скелета. Тема 3 Цікаве про птахів Цікаве про птахів Птахи “жують” шлунком. Більшість птахів не мають зубів. Зазвичай вони ковтають гальку або гравій, які енергійно переміщуються в шлунку і сприяють перемелюванню їжі. Пташеняті може знадобитися два дні, щоб вибра
Цікаве про птахів Цікаве про птахів Птахи “жують” шлунком. Більшість птахів не мають зубів. Зазвичай вони ковтають гальку або гравій, які енергійно переміщуються в шлунку і сприяють перемелюванню їжі. Пташеняті може знадобитися два дні, щоб вибра Значение грибов и грибоподобных организмов в природе
Значение грибов и грибоподобных организмов в природе Теории возникновения жизни на Земле
Теории возникновения жизни на Земле Адаптация организмов к условиям обитания как результат действия естественного отбора
Адаптация организмов к условиям обитания как результат действия естественного отбора Презентация на тему Развитие половых клеток
Презентация на тему Развитие половых клеток Мейоз
Мейоз Введение в фитотоксикологию
Введение в фитотоксикологию Голосеменные растения
Голосеменные растения Кожа. Дерматология как наука
Кожа. Дерматология как наука Презентация на тему Экологические ситуации
Презентация на тему Экологические ситуации  Опорно-двигательный аппарат. Мышечная система. Осанка
Опорно-двигательный аппарат. Мышечная система. Осанка «Разнообразие птиц и их значение» Автор: Зиновьева Ольга, Максимук Марина ученицы 10 «В» класса
«Разнообразие птиц и их значение» Автор: Зиновьева Ольга, Максимук Марина ученицы 10 «В» класса Микроскопия. Строение микроскопа
Микроскопия. Строение микроскопа Photosynthesis
Photosynthesis Неживая и живая природа (2 класс)
Неживая и живая природа (2 класс) Знания, полученные во время исследований, помогают сохранять серых китов
Знания, полученные во время исследований, помогают сохранять серых китов Появление первичных живых организмов. Возникновение биосферы
Появление первичных живых организмов. Возникновение биосферы Белки, их строение,свойства, биологические функции
Белки, их строение,свойства, биологические функции Основы медицинской экологии
Основы медицинской экологии Движение крови по сосудам 8 класс - Презентация_
Движение крови по сосудам 8 класс - Презентация_ Общая характеристика подцарства Низшие растения (Thallobionta)
Общая характеристика подцарства Низшие растения (Thallobionta) Борьба за существование Формы борьбы за существование
Борьба за существование Формы борьбы за существование  Flora of the river Vodla
Flora of the river Vodla Эндокринная система
Эндокринная система Типы питания и дыхания бактерий
Типы питания и дыхания бактерий