Содержание
- 2. План лекции Вторичная структура Третичная структура Четвертичная структура
- 3. Вторичная структура
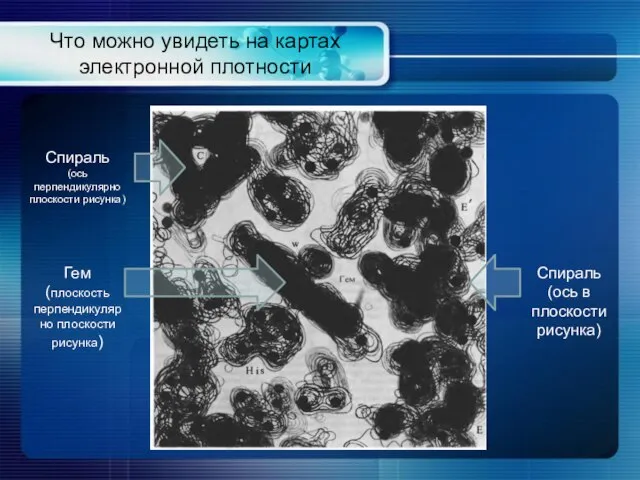
- 4. Что можно увидеть на картах электронной плотности Спираль (ось перпендикулярно плоскости рисунка) Спираль (ось в плоскости
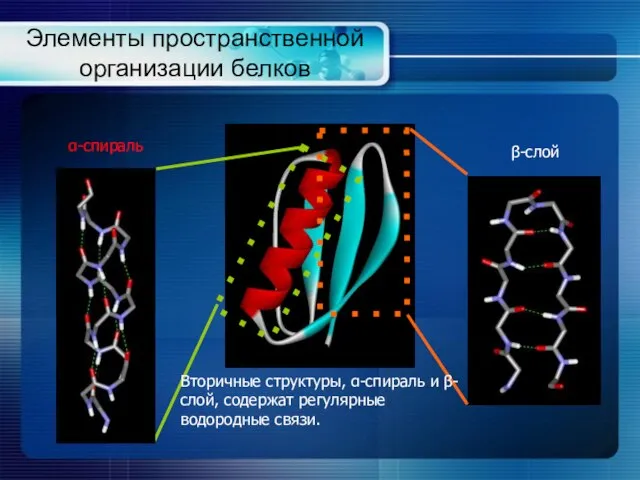
- 5. Элементы пространственной организации белков α-спираль β-слой Вторичные структуры, α-спираль и β-слой, содержат регулярные водородные связи.
- 6. α-спираль Л.К. Полинг, Р.Б. Кори 1951 г. Классическая альфа-спираль Полинга-Кори-Брэнсона Альфа-спираль (α-спираль) — типичный элемент вторичной
- 7. β-слои и другие типы вторичной структуры β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых
- 8. Полипролиновые спирали коллаген Полипролиновые спирали не содержат водородных связей в цепи: Полипролин I – левая спираль,
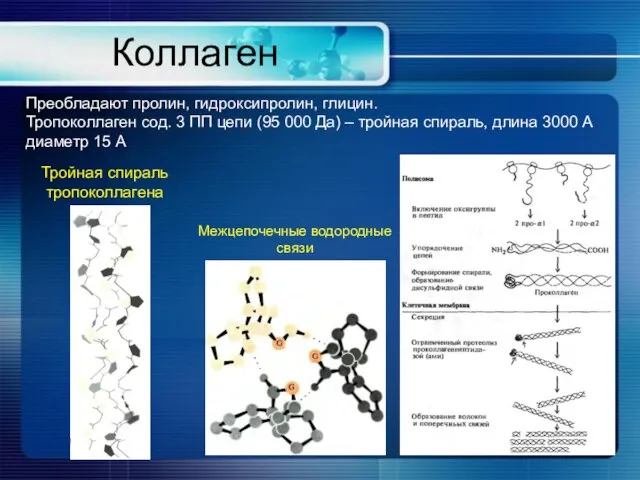
- 9. Коллаген Преобладают пролин, гидроксипролин, глицин. Тропоколлаген сод. 3 ПП цепи (95 000 Да) – тройная спираль,
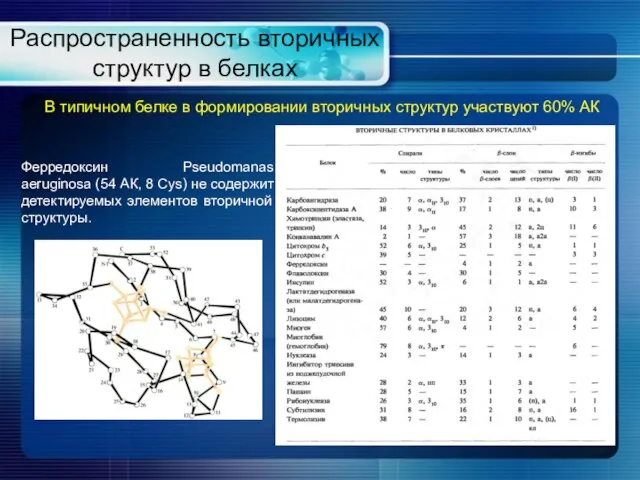
- 10. Распространенность вторичных структур в белках В типичном белке в формировании вторичных структур участвуют 60% АК Ферредоксин
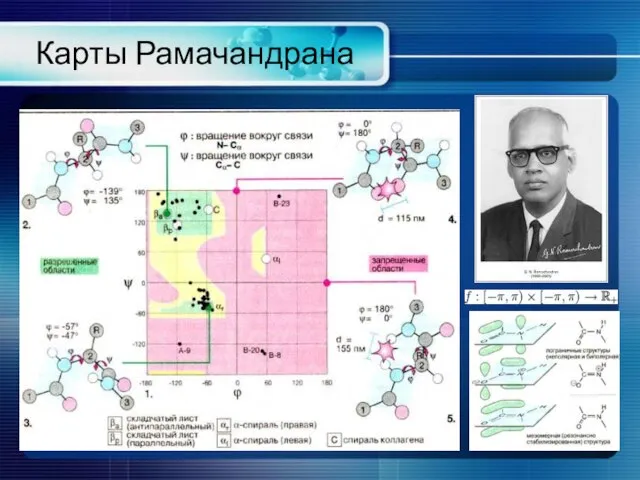
- 11. Карты Рамачандрана Общая карта Рамачандрана не очень отличается от такой же, только без глицина и пролина.
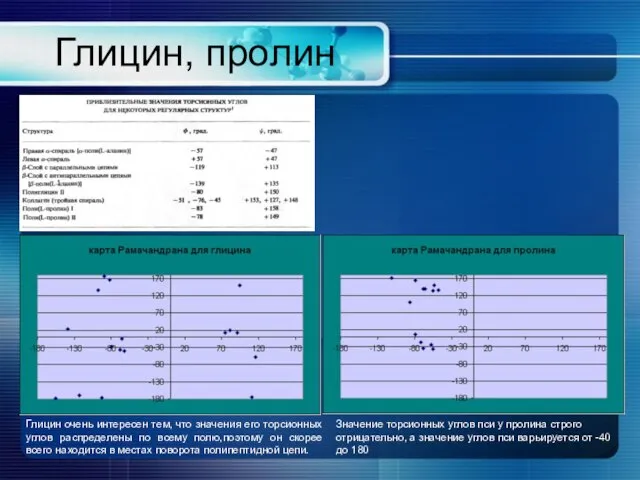
- 12. Глицин, пролин Глицин очень интересен тем, что значения его торсионных углов распределены по всему полю,поэтому он
- 13. Третичная структура
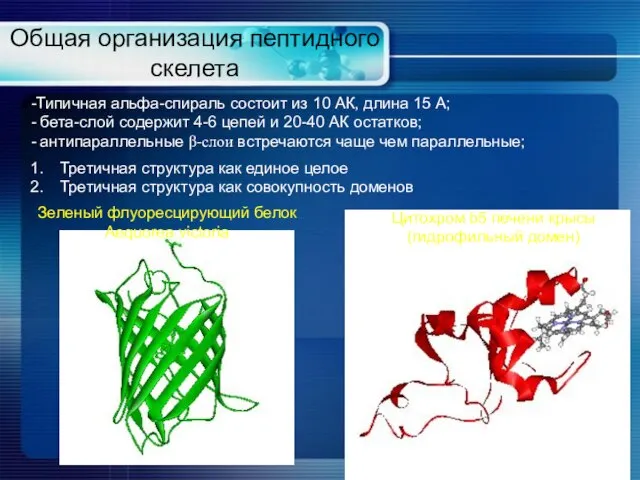
- 14. Общая организация пептидного скелета Типичная альфа-спираль состоит из 10 АК, длина 15 А; бета-слой содержит 4-6
- 15. Окружение отдельных остатков Конформации отдельных пептидных групп лежат в областях наибольшей стабильности; Заряженные остатки располагаются на
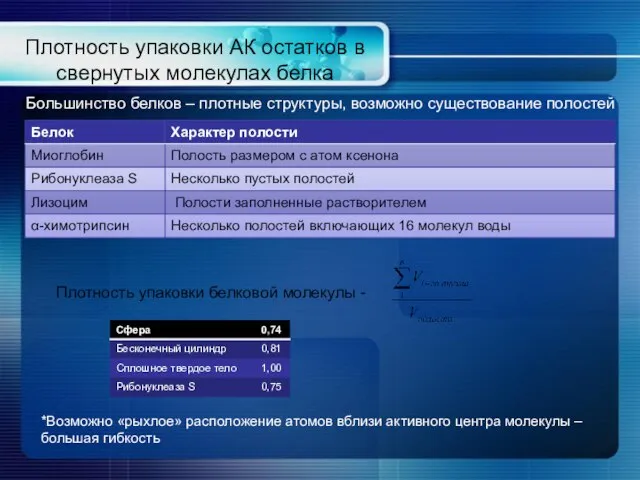
- 16. Плотность упаковки АК остатков в свернутых молекулах белка Большинство белков – плотные структуры, возможно существование полостей
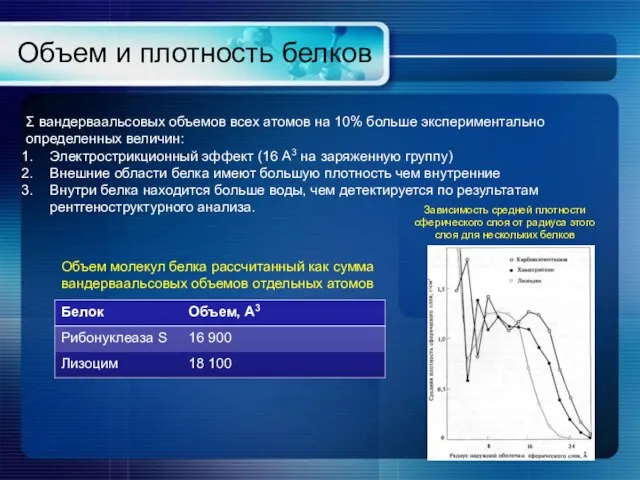
- 17. Объем и плотность белков Σ вандерваальсовых объемов всех атомов на 10% больше экспериментально определенных величин: Электрострикционный
- 18. Динамичность третичной структуры Методы изучения динамики – поляризованная флуоресценция, ЯМР С13, МД Оценка проницаемости – тушение
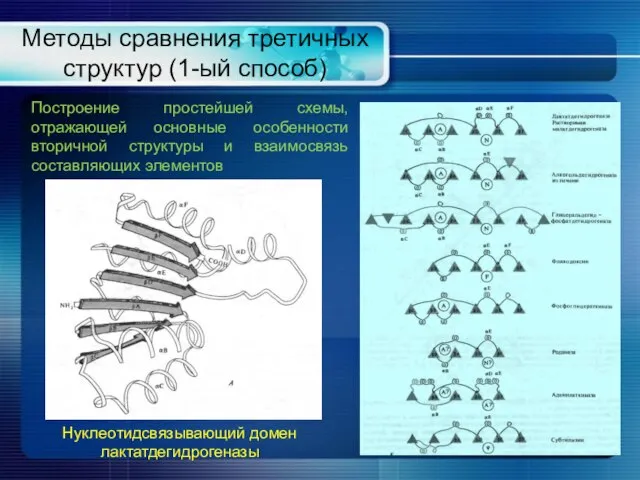
- 19. Методы сравнения третичных структур (1-ый способ) Нуклеотидсвязывающий домен лактатдегидрогеназы Построение простейшей схемы, отражающей основные особенности вторичной
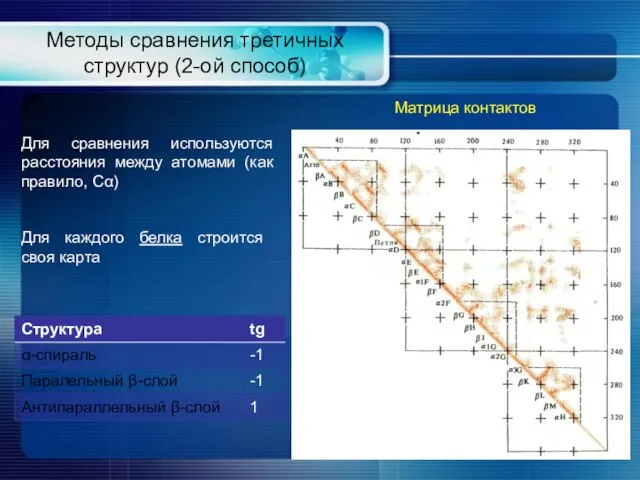
- 20. Методы сравнения третичных структур (2-ой способ) Матрица контактов Для сравнения используются расстояния между атомами (как правило,
- 21. Парадокс Левинталя 1968 г., Сайрус Левинталь «Промежуток времени, за который полипептид приходит к своему скрученному состоянию,
- 22. Четвертичная структура
- 23. Четвертичная структура Третичная структура Четвертичная структура
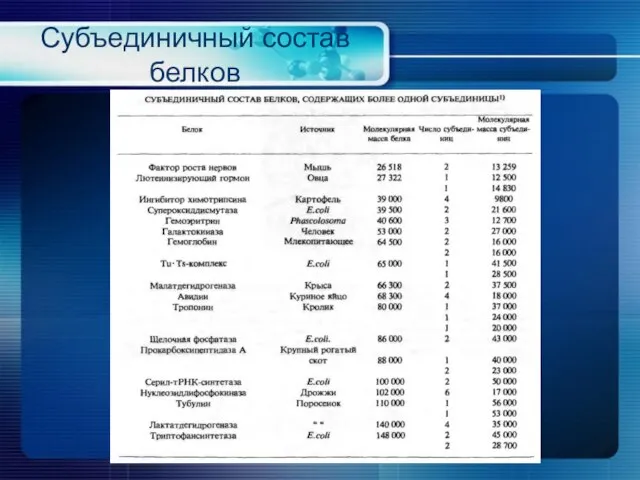
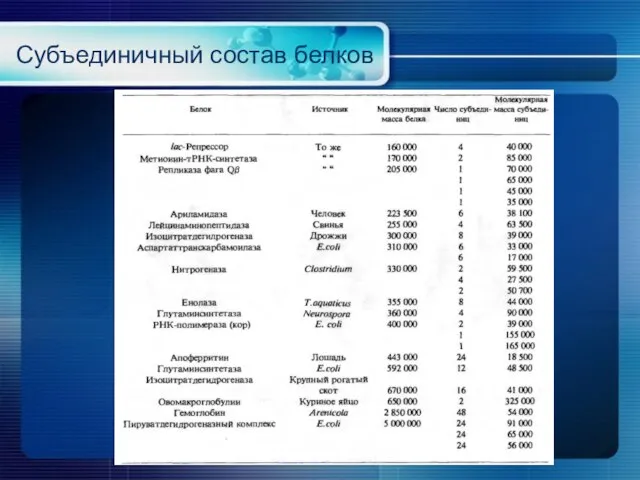
- 24. Субъединичный состав белков
- 25. Субъединичный состав белков
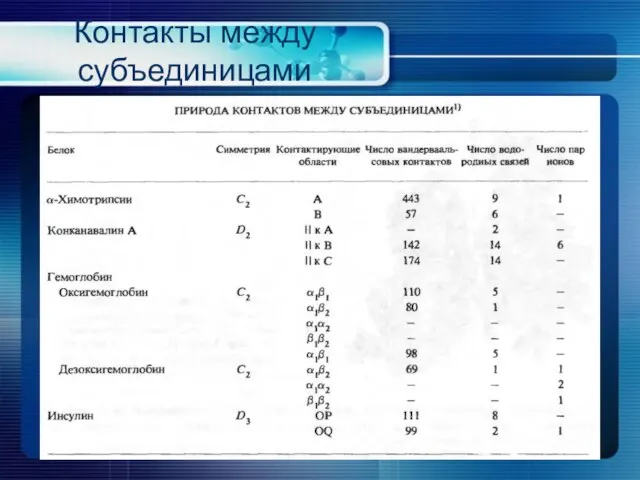
- 26. Контакты между субъединицами
- 28. Скачать презентацию











 Класс Oligohymenophorea
Класс Oligohymenophorea Жизнь маленьких щенят
Жизнь маленьких щенят Железы внутренней секреции Электронное учебное пособие по биологии 8 класс Авторы: Белоусов Д.Л., Приймак Т.В.,
Железы внутренней секреции Электронное учебное пособие по биологии 8 класс Авторы: Белоусов Д.Л., Приймак Т.В.,  Презентация Наша маленькая планета Земля
Презентация Наша маленькая планета Земля  Санитарная микробиология
Санитарная микробиология Полость живота. Полость брюшины. Отношение органов брюшине. Забрюшинное пространство. Производные брюшины (занятие 4)
Полость живота. Полость брюшины. Отношение органов брюшине. Забрюшинное пространство. Производные брюшины (занятие 4) Презентация на тему Испарение воды растениями
Презентация на тему Испарение воды растениями Синтетическая теория эволюции
Синтетическая теория эволюции Продолжительность жизни животных
Продолжительность жизни животных  Туя западная
Туя западная Тема урока: Живые царства. Грибы: строение и многообразие.
Тема урока: Живые царства. Грибы: строение и многообразие. I и II законы Менделя
I и II законы Менделя Шенталинское школьное лесничество
Шенталинское школьное лесничество Презентация на тему Фрукты
Презентация на тему Фрукты Генетика пола. Генетика пола. Наследственные заболевания.
Генетика пола. Генетика пола. Наследственные заболевания.  Строение древесного стебля голосеменного растения. Строение древесного стебля двудольного растения
Строение древесного стебля голосеменного растения. Строение древесного стебля двудольного растения Современные подходы к кормлению высокопродуктивных кроссов птицы, критерии биологической полноценности инкубационных яиц
Современные подходы к кормлению высокопродуктивных кроссов птицы, критерии биологической полноценности инкубационных яиц Урок биологии в 6 классе «Фотосинтез»
Урок биологии в 6 классе «Фотосинтез» Презентация на тему Органы чувств: Глаз
Презентация на тему Органы чувств: Глаз Микрофлора, дисбиозы
Микрофлора, дисбиозы Как живые организмы запасают энергию солнца Тема 9
Как живые организмы запасают энергию солнца Тема 9 Презентация на тему ПЧЕЛЫ И МУРАВЬИ -ОБЩЕСТВЕННЫЕ НАСЕКОМЫЕ
Презентация на тему ПЧЕЛЫ И МУРАВЬИ -ОБЩЕСТВЕННЫЕ НАСЕКОМЫЕ Рычаги в природе и технике
Рычаги в природе и технике Микроэволюция. Видообразоваание
Микроэволюция. Видообразоваание Как выйдя на прогулку со смартфоном стать частью мировой науки
Как выйдя на прогулку со смартфоном стать частью мировой науки Предмет и история антропологии
Предмет и история антропологии Организация исследовательской деятельности в учебно- воспитательном процессе
Организация исследовательской деятельности в учебно- воспитательном процессе  Рыбы
Рыбы