Содержание
- 2. ГАЗОВЫЕ ЗАКОНЫ (10 класс)
- 3. Цели урока 1.Способствовать формированию у учащихся знания молекулярно-кинетической теории идеального газа; выявить причинно-следственные связи между величинами,
- 4. Способствовать эмоционально-ценностному отношению к физическим явлениям в природе. Создать позитивные условия для проявления познавательного интереса у
- 5. Выявить взаимосвязь теории и эксперимента как критерия истины. Продолжить работу по развитию мышления и мировоззрения школьников.
- 6. Структура урока Актуализация знаний. Объяснение нового материала. Закрепление. Домашнее задание.
- 7. Единый план изучения газовых законов Определение и условия осуществления процесса. Уравнение и формулировка закона. Историческая справка.
- 8. Уравнение Менделеева-Клапейрона Уравнение состояния идеального газа
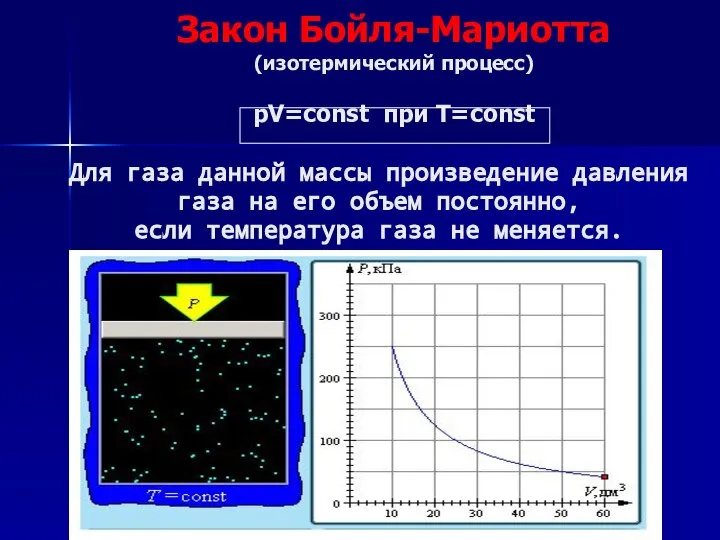
- 9. Закон Бойля-Мариотта (изотермический процесс) pV=const при T=const Для газа данной массы произведение давления газа на его
- 10. Бойль (Boyle) Роберт (25.I.1627–30.XII.1691) Английский физик и химик, член Лондонского королевского общества. Работы Бойля в области
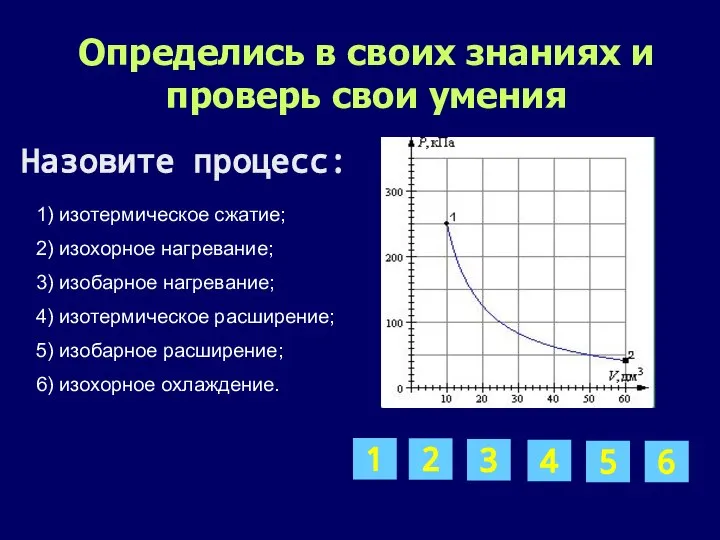
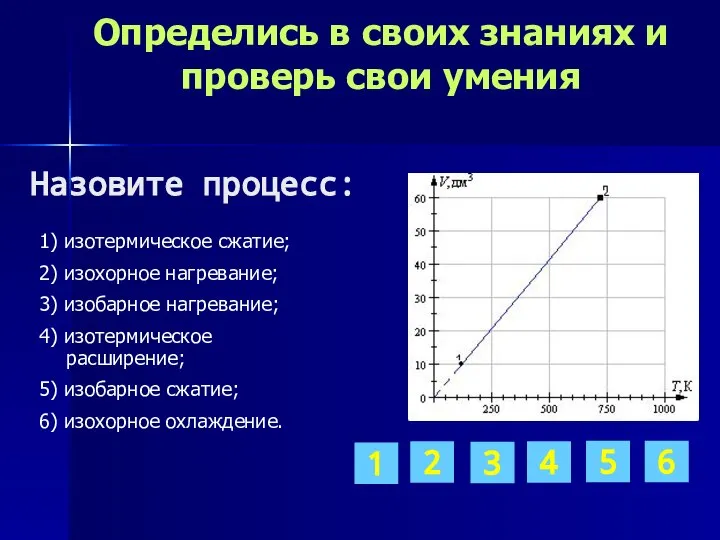
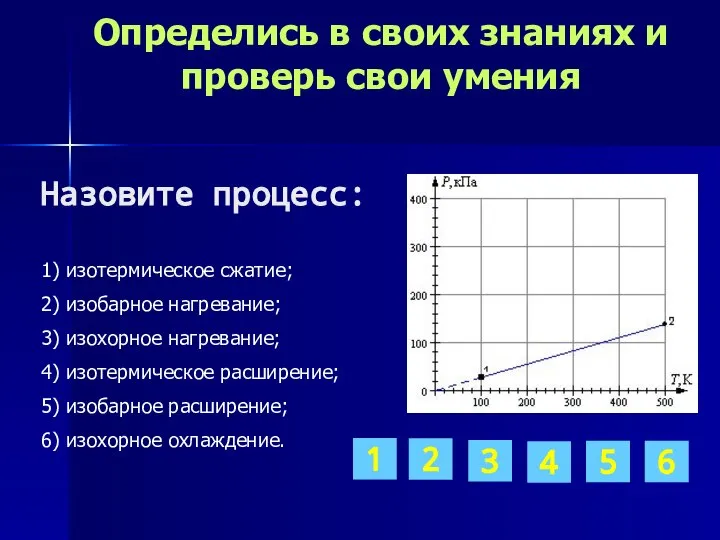
- 11. Определись в своих знаниях и проверь свои умения 1) изотермическое сжатие; 2) изохорное нагревание; 3) изобарное
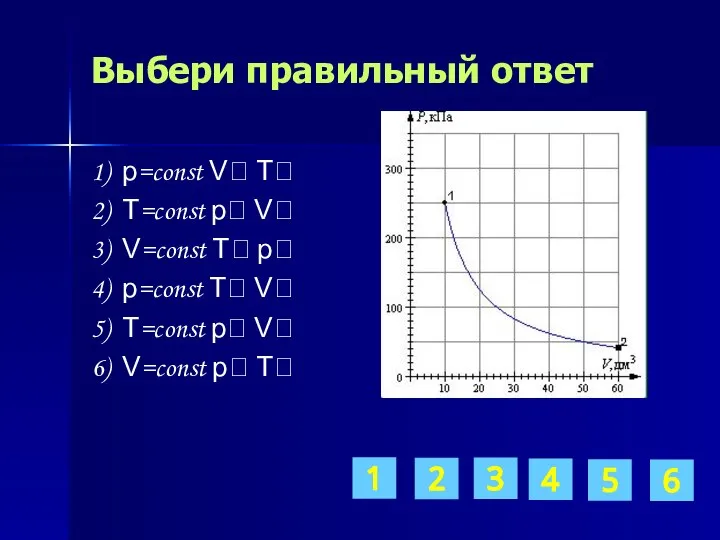
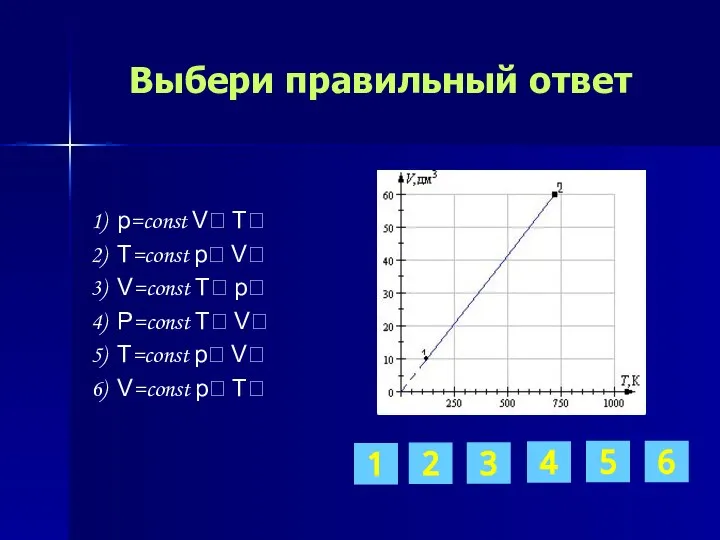
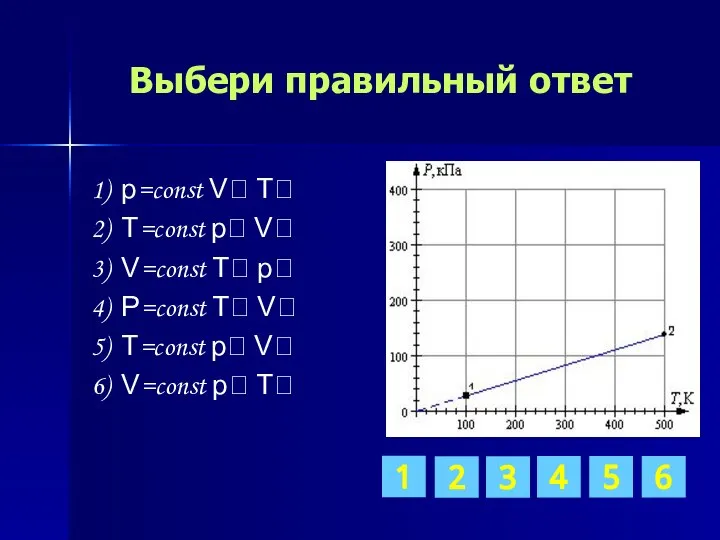
- 12. Выбери правильный ответ 1) p=const V T 2) T=const p V 3) V=const T p 4)
- 13. Реши задачу Воздух под поршнем насоса имеет давление 105 Па и объем 260 см3. При каком
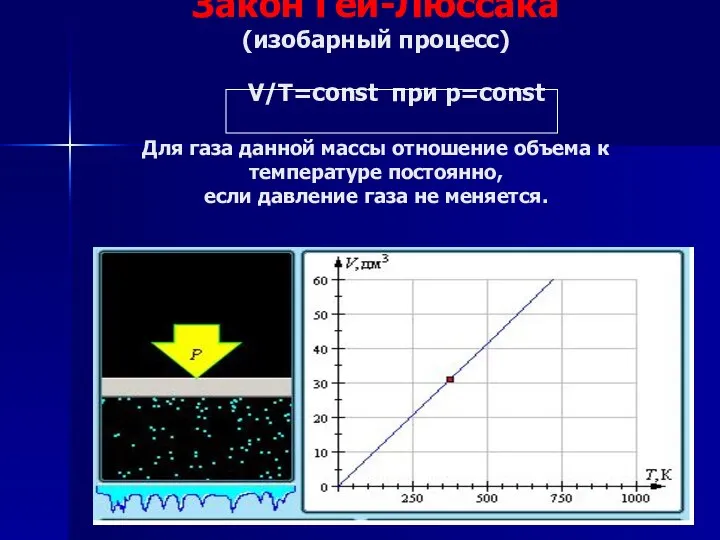
- 14. Закон Гей-Люссака (изобарный процесс) V/Т=const при р=const Для газа данной массы отношение объема к температуре постоянно,
- 15. Гей-Люссак (Gay-Lussac) Жозеф Луи (6.XII.1778–9.V.1850) Французский химик и физик, член АН в Париже (1806). В 1802,
- 16. Определись в своих знаниях и проверь свои умения 1) изотермическое сжатие; 2) изохорное нагревание; 3) изобарное
- 17. Выбери правильный ответ 1) p=const V T 2) T=const p V 3) V=const T p 4)
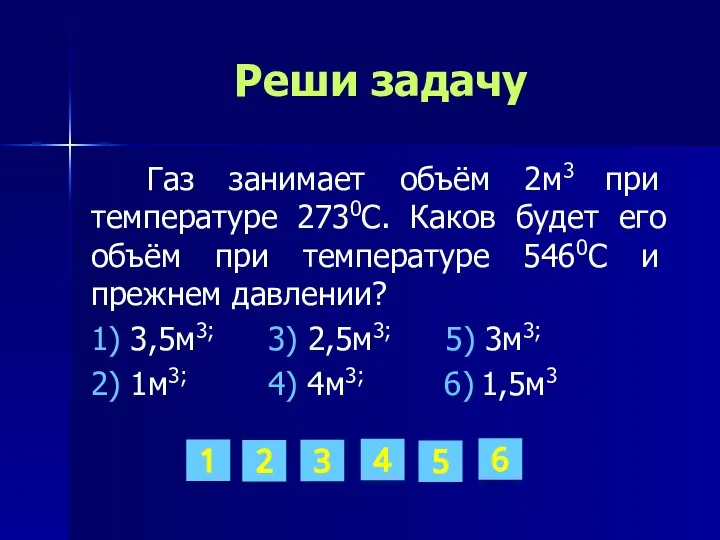
- 18. Реши задачу Газ занимает объём 2м3 при температуре 2730С. Каков будет его объём при температуре 5460С
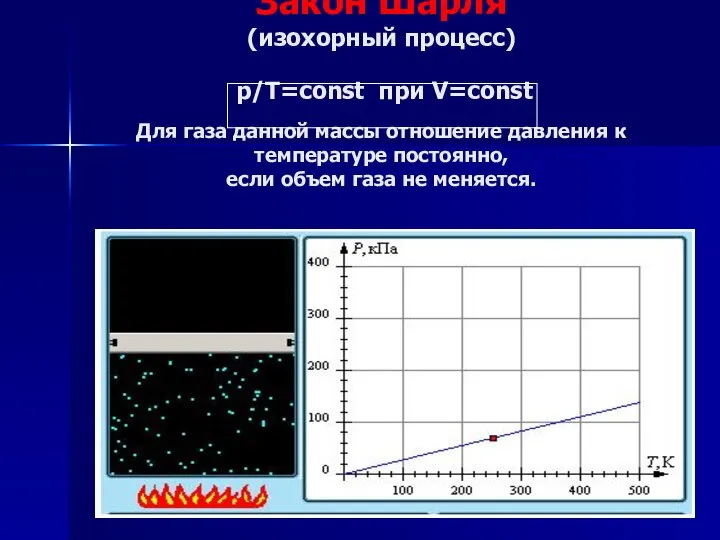
- 19. Закон Шарля (изохорный процесс) р/Т=const при V=const Для газа данной массы отношение давления к температуре постоянно,
- 20. Определись в своих знаниях и проверь свои умения 1) изотермическое сжатие; 2) изобарное нагревание; 3) изохорное
- 21. Выбери правильный ответ 1) p=const V T 2) T=const p V 3) V=const T p 4)
- 22. Реши задачу Газ находится в баллоне при температуре 288 К и давлении 1,8 МПа. При какой
- 25. Подумай!
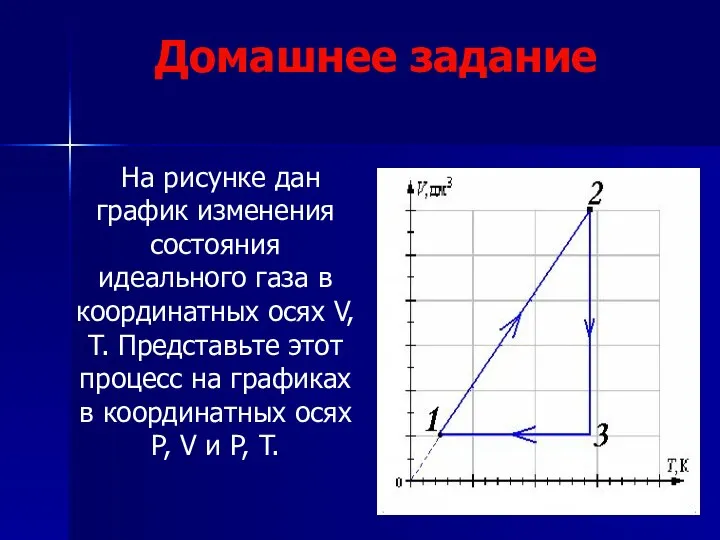
- 26. Домашнее задание На рисунке дан график изменения состояния идеального газа в координатных осях V, T. Представьте
- 28. Скачать презентацию














 Управління режимом роботи фрагменту електричної мережі напругою 110/35 кВ Києво-Святошинського РП в умовах його експлуатації
Управління режимом роботи фрагменту електричної мережі напругою 110/35 кВ Києво-Святошинського РП в умовах його експлуатації Радиоактивный распад атомных ядер. (Тема 1.2)
Радиоактивный распад атомных ядер. (Тема 1.2) Презентация Электробезопасность Опасности электрических систем
Презентация Электробезопасность Опасности электрических систем  Nəbi Xəzri
Nəbi Xəzri Звукові Хвилі Виконав учень 10 класу Васильківської ЗОШ І-ІІІ ступенів №9 Вінтула Богдан
Звукові Хвилі Виконав учень 10 класу Васильківської ЗОШ І-ІІІ ступенів №9 Вінтула Богдан  Плоские волны
Плоские волны Подшипники. Конструкция подшипника скольжения
Подшипники. Конструкция подшипника скольжения Решение задач
Решение задач Опиливание заготовок их сортового проката
Опиливание заготовок их сортового проката Испарение и конденсация
Испарение и конденсация Загальне знання повітряних суден. Планер літального апарата
Загальне знання повітряних суден. Планер літального апарата Оптика. Линзы
Оптика. Линзы I.Механика. Кинематика
I.Механика. Кинематика Электричество. Постоянный ток
Электричество. Постоянный ток Введение в динамику системы. Масса. Центр масс. Моменты инерции
Введение в динамику системы. Масса. Центр масс. Моменты инерции Основные понятия и определения
Основные понятия и определения Динамика материальной точки (частицы)
Динамика материальной точки (частицы) Презентация по физике "усилители" - скачать
Презентация по физике "усилители" - скачать  Синхронды машиналар
Синхронды машиналар Электрический двигатель своими руками
Электрический двигатель своими руками Жылулық құбылыстар
Жылулық құбылыстар Схема системы технического обслуживания и ремонта
Схема системы технического обслуживания и ремонта Закон Максвелла. Электромагнитное поле
Закон Максвелла. Электромагнитное поле Електростатика. Закон взаємодії електричних зарядів
Електростатика. Закон взаємодії електричних зарядів Крыло. Его назначение
Крыло. Его назначение Внутрицентровое поглощение света на примесных уровнях в ИК-диапазоне
Внутрицентровое поглощение света на примесных уровнях в ИК-диапазоне Конденсатори
Конденсатори  Определение технического состояния трансмиссии автомобилей
Определение технического состояния трансмиссии автомобилей