Содержание
- 2. Поверхностное натяжение как результат асимметрии сил когезии на поверхности Поверхностное натяжение жидкостей вызывает образование капель и
- 3. Взаимодействие молекул в поверхностном слое происходит в нескомпенсированном силовом поле. Молекулы стремятся уйти с поверхности в
- 4. Фундаментальное уравнение Гиббса для плоского поверхностного слоя Удельная свободная энергия поверхностного слоя 2. 3. Изохорные функции
- 5. Поверхностное натяжение (в мН/м) для некоторых жидкостей при 25 °С Вода 72 Этанол 22 Хлороформ 27
- 6. Методы измерения поверхностного натяжения Равновесное поверхностное натяжение 1. К простым способам измерения поверхностного натяжения относится метод
- 7. 3. Одним из наиболее распространенных методов измерения поверхностного натяжения являются сталагмометрический и тензиометрический методы. Сталагмометрический метод
- 8. В некоторых системах равновесное состояние устанавливается очень долго, и измерения поверхностного натяжения в этих случаях занимают
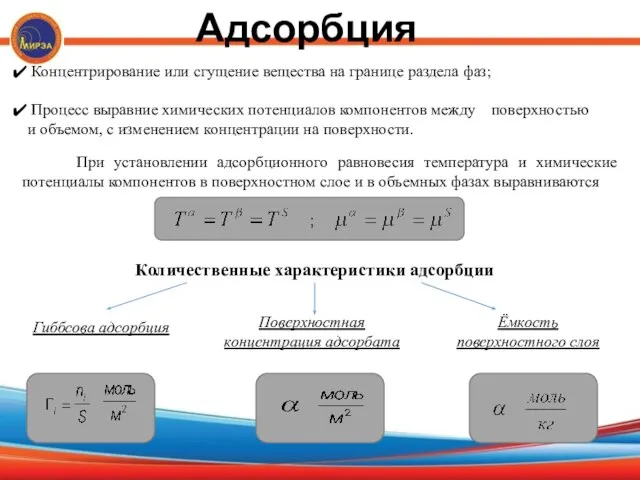
- 10. Адсорбция Концентрирование или сгущение вещества на границе раздела фаз; Процесс выравние химических потенциалов компонентов между поверхностью
- 11. ВЫВОД АДСОРБЦИОННОГО УРАВНЕНИЯ ГИББСА - выражает количественную связь адсорбции с поверхностным натяжением Запишем фундаментальное уравнение Гиббса
- 12. (7) при Т=const уравнение Гиббса принимает вид: – мера избыточного содержания компонента в поверхностном слое, мера
- 13. Перейдем к концентрации: , где С – равновесная концентрация в объеме. (10)
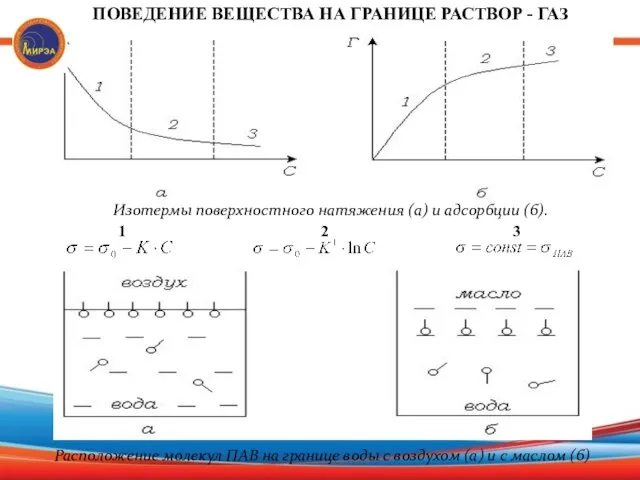
- 14. Изотермы поверхностного натяжения (а) и адсорбции (б). ПОВЕДЕНИЕ ВЕЩЕСТВА НА ГРАНИЦЕ РАСТВОР - ГАЗ 2 1
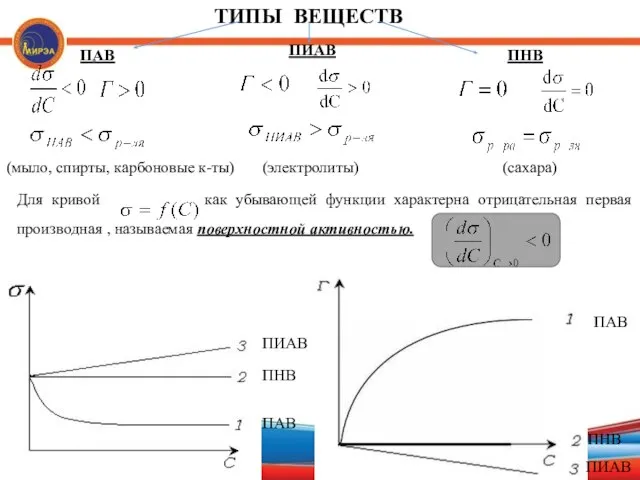
- 15. ТИПЫ ВЕЩЕСТВ ПАВ ПИАВ ПНВ Для кривой как убывающей функции характерна отрицательная первая производная , называемая
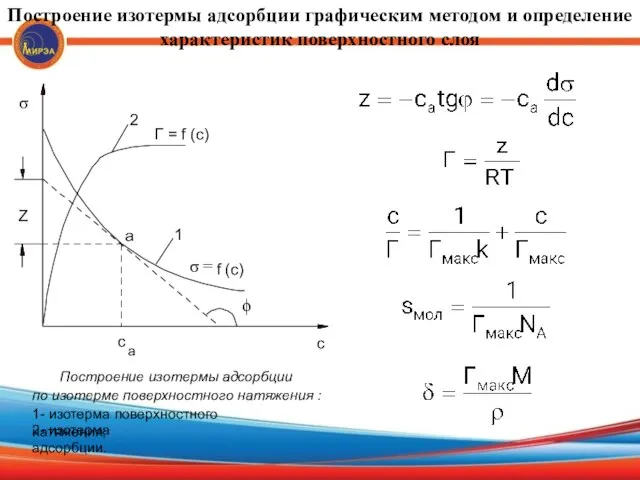
- 16. Построение изотермы адсорбции графическим методом и определение характеристик поверхностного слоя ϕ σ σ = Z f
- 17. Вид изотермы поверхностного натяжения. Уравнение Шишковского На изотерме поверхностного натяжения имеются три участка Первый и третий
- 18. При малых : по формуле разложения в ряд уравнение принимает вид: т. е. описывает первый прямолинейный
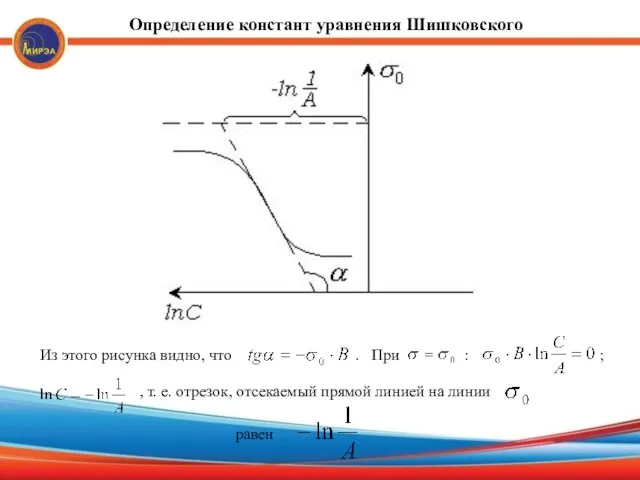
- 19. Определение констант уравнения Шишковского Из этого рисунка видно, что . При : ; , т. е.
- 20. Связь уравнений Ленгмюра и Гиббса с помощью уравнения Шишковского Уравнение Шишковского является эмпирическим. После разработки представлений
- 22. Скачать презентацию














 Действия электрического тока. Танасюк Ирина Николаевна учитель физики МБОУ лицей №6 Г. Невинномысска
Действия электрического тока. Танасюк Ирина Николаевна учитель физики МБОУ лицей №6 Г. Невинномысска Презентация по физике "Учебно-методический комплекс. Физика, 10 класс" - скачать
Презентация по физике "Учебно-методический комплекс. Физика, 10 класс" - скачать  Фрактальная размерность проводников и полупроводников
Фрактальная размерность проводников и полупроводников Техническая диагностика автомобилей
Техническая диагностика автомобилей Кафедра общей физики и молекулярной электроники
Кафедра общей физики и молекулярной электроники Презентация по физике "Магнітна дія струму. Дослід Ерстеда" - скачать бесплатно
Презентация по физике "Магнітна дія струму. Дослід Ерстеда" - скачать бесплатно Презентация по физике "Интерференция света в тонких пленках" - скачать
Презентация по физике "Интерференция света в тонких пленках" - скачать  Механическое движение тела
Механическое движение тела Энергетические ресурсы Мирового океана
Энергетические ресурсы Мирового океана Термодинамика. Термодинамиканың бірінші бастамасы
Термодинамика. Термодинамиканың бірінші бастамасы Ядерный (атомный) реактор
Ядерный (атомный) реактор Моделирование обтекания вертолёта при взлёте и посадке
Моделирование обтекания вертолёта при взлёте и посадке Мифы и легенды физики
Мифы и легенды физики Уравнения теории упругости. Напряженное состояние в точке. Гипотеза Сен-Венана. (Лекции 1-2)
Уравнения теории упругости. Напряженное состояние в точке. Гипотеза Сен-Венана. (Лекции 1-2) Магниты на основе современных массивных высокотемпературных сверхпроводников
Магниты на основе современных массивных высокотемпературных сверхпроводников Презентация по физике "Магнитное поле Земли" - скачать
Презентация по физике "Магнитное поле Земли" - скачать  конвекция 8 класс
конвекция 8 класс Таинственный мир электричества
Таинственный мир электричества Автоматизация в современном производстве
Автоматизация в современном производстве Механическое движение. Равномерное и неравномерное движение
Механическое движение. Равномерное и неравномерное движение Искусственные Спутники Земли Пономарёв Михаил 9 В
Искусственные Спутники Земли Пономарёв Михаил 9 В Термодинамика негіздері
Термодинамика негіздері Закон сохранения момента импульса
Закон сохранения момента импульса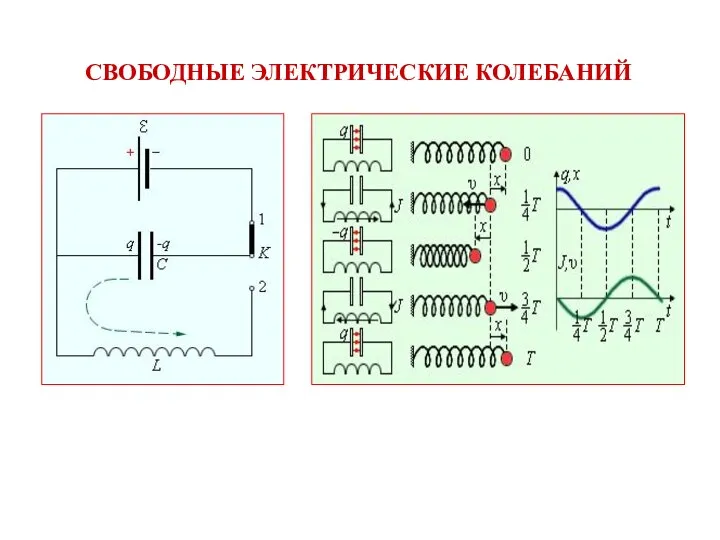 Свободные электрические колебаний
Свободные электрические колебаний Фотоэлектронные приборы (фоторезисторы, фотодиоды, фототранзисторы)
Фотоэлектронные приборы (фоторезисторы, фотодиоды, фототранзисторы) ЭДС в движущихся в магнитных полях проводниках
ЭДС в движущихся в магнитных полях проводниках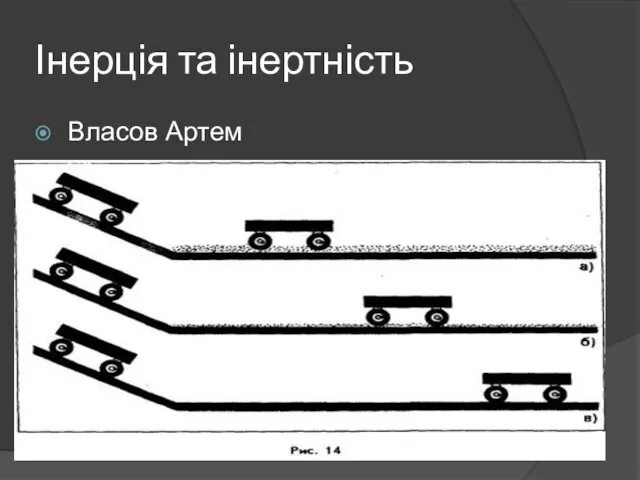 Інерція та інертність
Інерція та інертність Закон Ома для участка цепи
Закон Ома для участка цепи