Содержание
- 2. ФАРАДЕЙ (Faraday) Майкл (1791-1867) Английский физик, основоположник учения об электромагнитном поле, иностранный почетный член Петербургской АН
- 3. Термин «электролит» (от греческого «разлагаемый электричеством») впервые предложил английский химик и физик М.Фарадей
- 4. Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества.
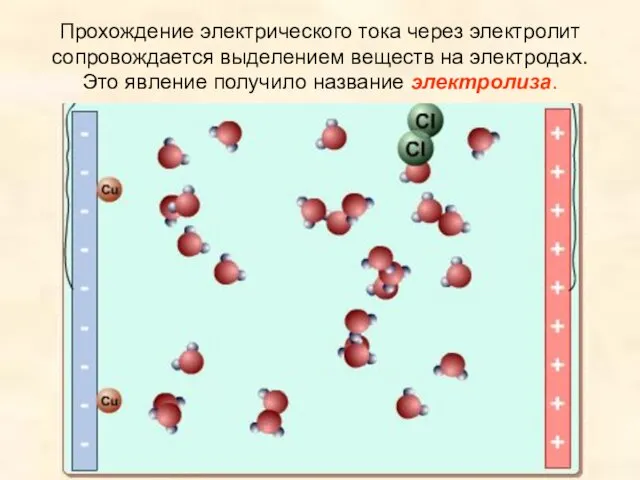
- 5. Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
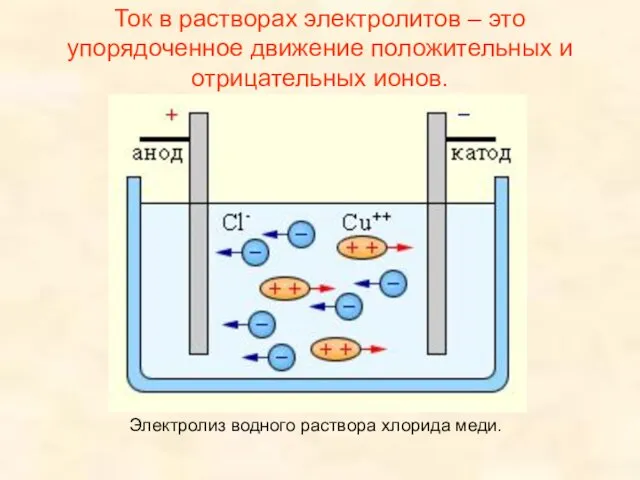
- 6. Ток в растворах электролитов – это упорядоченное движение положительных и отрицательных ионов. Электролиз водного раствора хлорида
- 7. Первый закон электролиза. Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон
- 8. Первый закон электролиза. Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду q, прошедшему через электролит:
- 9. Второй закон Фарадея Данный закон отвечает на вопрос от чего зависит электрохимический эквивалент. Электрохимические эквиваленты различных
- 11. Скачать презентацию






 Электростатика. Электродинамика
Электростатика. Электродинамика Локальные системы молниезащиты объектов электроэнергетики
Локальные системы молниезащиты объектов электроэнергетики Квантово-полевая картина мира
Квантово-полевая картина мира Ренгенофлуоресцентный анализ
Ренгенофлуоресцентный анализ Биофизика, как наука. История и методология биофизики. Кинетика биологических процессов. Термодинамика биологических процессов
Биофизика, как наука. История и методология биофизики. Кинетика биологических процессов. Термодинамика биологических процессов Релейный регулятор для движения по границе черного и белого
Релейный регулятор для движения по границе черного и белого Космические скорости
Космические скорости Строение тел. Агрегатные состояния вещества и фазовые переходы. Законы термодинамики
Строение тел. Агрегатные состояния вещества и фазовые переходы. Законы термодинамики Модели распространения радиоволн, методы предсказания напряжённости поля и потерь распространения, применяемые МСЭ-R Модели расп
Модели распространения радиоволн, методы предсказания напряжённости поля и потерь распространения, применяемые МСЭ-R Модели расп Постоянный электрический ток. Характеристики электрической цепи. Действие электрического тока и правила техники безопасности
Постоянный электрический ток. Характеристики электрической цепи. Действие электрического тока и правила техники безопасности Современные проблемы физики наноструктурных материалов. Механические свойства и механизмы деформации наноматериалов
Современные проблемы физики наноструктурных материалов. Механические свойства и механизмы деформации наноматериалов Закон Ома для участка цепи
Закон Ома для участка цепи Источники звука. Характеристики звука.
Источники звука. Характеристики звука. Звуковые волны. Урок физики в 9 классе
Звуковые волны. Урок физики в 9 классе Теория электромагнитного поля
Теория электромагнитного поля Элементы машиноведения. Устройство бытовой швейной машины
Элементы машиноведения. Устройство бытовой швейной машины Источники света. Распространение света
Источники света. Распространение света Типовые гидродинамические модели ТОУ
Типовые гидродинамические модели ТОУ Фазированные антенные решетки и их назначение
Фазированные антенные решетки и их назначение Гидродинамика. Уравнение Бернулли. Подъемная сила. Течение вязкой жидкости. Формула Стокса. Обтекание тел
Гидродинамика. Уравнение Бернулли. Подъемная сила. Течение вязкой жидкости. Формула Стокса. Обтекание тел Шкала Р.А. Реомюра
Шкала Р.А. Реомюра Podstawowe pojęcia z zakresu RADIOMETRII
Podstawowe pojęcia z zakresu RADIOMETRII Основные понятия кинематики. Тест №1. 9 класс
Основные понятия кинематики. Тест №1. 9 класс Турбина, первичный двигатель с вращательным движением рабочего органа
Турбина, первичный двигатель с вращательным движением рабочего органа Частота. Маятник
Частота. Маятник Вывод формул веществ по массовым долям элементов
Вывод формул веществ по массовым долям элементов Новое состояние материи – кварк-глюонная плазма
Новое состояние материи – кварк-глюонная плазма Двигатель внутреннего сгорания
Двигатель внутреннего сгорания